小鼠脑部SIRT1与IR受体的共定位
刘 羽,刘 翠,梁 良,黄 澜,朱 华,盛树力,秦 川
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
胰岛素在中枢神经系统中起着重要作用,其主要是通过胰岛素酪氨酸激酶受体-胰岛素受体底物1(IRS-1)-磷酸肌醇3激酶(PI3K)-AKT信号通路级联反应实现生理调节功能[1]。胰岛素受体主要分布在嗅球、海马、皮层、下丘脑等脑区[2],参与很多脑部的生理功能,如调节能量代谢、摄食、体重、繁殖、学习与记忆力等[3]。
近年来的研究显示,表观遗传学对学习和记忆力过程具有重要的调控作用[4]。组蛋白去乙酰化酶(sirtuins)属于蛋白家族,在从细菌到人类的进化过程中起着多效性作用。最早发现啤酒酵母中的Sir2是第一个人们所认知的NAD+依赖的组蛋白去乙酰化酶[5]。组蛋白去乙酰化酶 1(SIRT1)是sirtuins家族中的成员,与Sir2具有高度同源性。除了调节组蛋白乙酰化的状态以外,SIRT1可以通过调节一些转录因子和转录辅助因子在各种生理过程中起到调节作用[6],如参与能量代谢过程、突触可塑性等。最近研究显示,SIRT1在中枢神经系统的生理和疾病过程中起着重要作用[7],但具体的分子机制尚未明确。此外,SIRT1还参与糖原代谢过程和调节胰岛素分泌,当小鼠体内分泌胰岛素的β细胞受到葡萄糖刺激时,SIRT1可以通过上调胰岛素的分泌从而改善体内葡萄糖耐受水平。目前,尚无有关SIRT1与IR是否存在相互作用的报道,因此在成年小鼠脑组织中研究二者是否存在共定位,为进一步研究SIRT1在脑组织中的生理及病理作用提供形态学依据。
1 材料和方法
1.1 材料
1.1.1 SH-SY5Y细胞培养:SH-SY5Y细胞株培养条件为:MEM培养基中加入10%胎牛血清、15 mmol/L 4-HEPES、青霉素 100 IU/mL、链霉素 100 IU/mL,于37℃、5%CO2中培养,每周换液2次,传代1次。
1.1.2 实验动物:4月龄健康的C57BL/6小鼠4只购自北京华阜康生物科技股份有限公司,合格证号为[SCXK(京)2009-0007]。动物饲养于恒温为25℃,具有独立通风系统的动物房,光照12 h,黑暗12 h,自由饮水取食。动物使用许可证编号:[SYXK(京)2011-0022]
1.1.3 实验试剂:小鼠抗小鼠SIRT1单克隆抗体和MAP2单克隆抗体购自 Abcam有限公司,噻唑蓝(MTT)和PI3K抑制剂LY294002购自Sigma有限公司,兔抗小鼠IRα多克隆抗体购自Millipore有限公司。异硫氰荧光素(FITC)标记的山羊抗兔IgG、罗丹明(TRITC)标记的山羊抗小鼠 IgG、含有DAPI的水溶性封片剂购自北京中杉金桥生物技术有限公司。
1.1.4 组织制备:雄性4月龄的C57BL/6J小鼠采用安乐死并迅速取出脑组织。用OCT复合物包埋脑组织,采用冠状面的方向进行切片,切片厚度为10 μm。切片在含有4%的多聚甲醛溶液中固定20 min,0.01 mol/L 的 PBS浸泡 30 min,100% 酒精浸泡2 min。固定好的脑组织切片可以放入 -20℃冰箱中保存。
1.2 实验方法
1.2.1 噻唑蓝(MTT)代谢率测定细胞活性:每孔加 MTT(5 mg/mL)20μL,37℃ 孵育 4 h,吸出培养液,每孔加入DMSO 200 mL,振摇10 min后用酶标仪(Diagnostic Pasteur LP400)测定550 nm处光密度值(A)。
1.2.2 Western blotting:SH-SY5Y细胞接种于6孔板内,选定胰岛素100 nmol/L作用12 h,及加入胰岛素信号PI3K抑制剂LY294002浓度为20 μmol/L作用2 h后加入胰岛素检测胰岛素信号通路对SIRT1的调节作用。将l×104/mL SH-SY5Y细胞接种于75 mL细胞培养瓶中,细胞80%汇合后,更换为无血清MEM培养基,分为空白对照组、100 nM/L胰岛素组、LY294002组、LY294002加胰岛素组。于12 h后提取细胞蛋白,以 GAPDH为内参照,用Bandscan软件分析条带灰度。
1.2.3 免疫组化染色:SIRT1的组化染色按照试剂盒说明步骤进行,SIRT1一抗稀释比例为1∶200。图像拍照及分子应用ProgRes CCD摄像头及分析软件。
1.2.4 免疫荧光双标染色:冰冻切片经0.5%Triton X-100作用15 min后,接下来经8%山羊血清室温封闭30 min,直接滴加稀释好的两个不同来源的一抗,SIRT1、IRα 的稀释比例分别为 1∶200、1∶100,4℃过夜。次日用0.01 mol/L PBS清洗后加入混合稀释的荧光标记二抗,稀释比例为1∶200,37℃水浴箱内孵育40 min后,0.01 mol/L PBS充分洗涤后用含有DAPI的水溶性封片剂封片。用激光共聚焦显微镜系统(Leica TCS-SP5)对荧光染色切片进行拍照及分析。
1.2.5 统计学方法:所得数据均以均数士标准差表示,应用SPSS13.0软件进行单因素方差分析检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SIRT1在小鼠脑组织中分布
应用免疫组织化学方法检测4月龄C57小鼠脑组织中组蛋白去乙酰化酶1(SIRT1)分布,结果显示SIRT1在脑组织中分布广泛,分布于:皮层、海马、下丘脑、杏仁核等部位(图1,见封二),提示其与脑组织的发育、结构和功能存在一定联系。
2.2 SIRT1表达于神经元中
微管相关蛋白2(microtubule-associated protein 2,MAP2)是一种神经元标记物,由 FITC绿色荧光基团标记以胞浆着色为主,海马CA1区椎体细胞可见绿色荧光基团。同时,在海马CA1椎体细胞层的神经元胞核均有SIRT1的表达,为红色。拍照后的图像叠加处理发现,SIRT1主要在神经元中表达(图2,见封二)。
2.3 SIRT1与IRα的共表达
IRα为包膜蛋白,FITC绿色荧光基团标记的阳性神经元主要以包膜着色为主,胞质淡染。阳性染色神经元主要分布在皮层、海马、下丘脑区域(图3,见封二)。拍照后的图片叠加处理后发现,IRα染色阳性(绿色)的皮层区域、海马CA1区及下丘脑区的神经元胞核均有SIRT1表达(红色)。DAPI复染细胞核形成的蓝色区域与红色区域重叠证实SIRT1表达于神经元细胞核内。
2.4 胰岛素改善SH-SY5Y细胞系的活性
检测不同浓度的胰岛素(1、10、100、200 nmol/L)12 h后对细胞活性的影响。如图4所示,应用100 nmol/L的胰岛素可以增加SH-SY5Y细胞活性。向细胞内加入100 nmol/L胰岛素培养12 h,与对照相比细胞活性明显改善(P<0.01)(图4)。
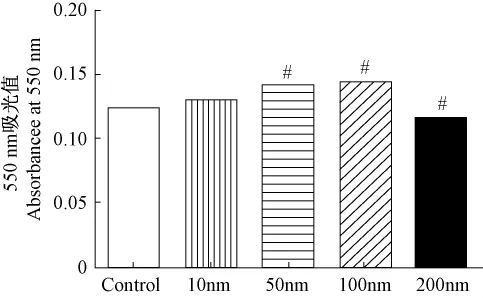
图4 MTT检测胰岛素对细胞活性的影响。Fig.4 Cell viability was determined by methylthiazole tetrazolium(MTT)assay.(#P <0.01).
2.5 胰岛素调节SIRT1表达
如图5所示在对SH-SY5Y细胞应用100 nmol/L胰岛素12 h后SIRT1蛋白表达水平增加。提前加入PI3K抑制剂 LY294002(20 μM),2 h后再加入胰岛素,Western blotting结果显示 PI3K抑制剂LY294002可以降低SIRT1蛋白表达,提示胰岛素信号调节 SIRT1表达(图5)。
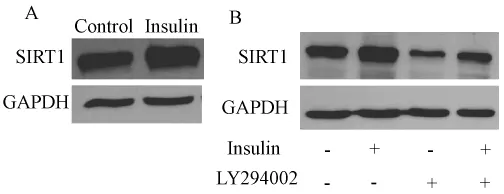
图5 胰岛素调节SIRT1表达。Fig.5 Insulin regulates the expression of SIRT1 protein.
3 讨论
组蛋白去乙酰化酶1(SIRT1)不但影响组蛋白乙酰化状态,而且可以通过影响某些转录因子和转录辅助因子调节不同的生理过程。有研究显示,SIRT1通过影响一些与能量代谢相关的转录因子,影响外周组织的能量代谢状态[8]。Sirt1mRNA表达于POMC(pro-opiomelanocortin)神经元,对脑组织的正常能量及糖原代谢过程中起着重要调节作用[9]。在外周胰岛素抵抗的情况下,SIRT1可以抑制PPT1B(protein tyrosine phosphatase1B)的转录改善胰岛素抵抗状态[10]。胰岛素受体在脑组织中表达广泛,主要表达于皮层、海马、下丘脑,参与正常的生理过程,脑部胰岛素抵抗可导致脑部多种疾病的发生(如阿尔茨海默病等)。本实验研究发现SIRT1和胰岛素受体(IR)在成年小鼠皮层、海马、下丘脑神经元存在定位,此外,体外研究显示胰岛素可以调节SIRT1的表达,表明其二者之间存在一定联系影响脑部的生理及病理状态。
近年来,染色质重塑对学习记忆的调控作用越来越成为研究的热点。本研究发现,SIRT1在小鼠海马CA1区锥体细胞核内表达丰富,且与IR存在明显共定位现象。有报道显示,SIRT1敲除小鼠其海马CA1区神经元出现树突分支减少、树突长度变短,海马依赖的短时程和长时程记忆力缺陷[11]。相反,在SIRT1过表达小鼠的学习记忆力明显改善。临床及流行病学研究显示,患有2型糖尿病的患者其发展成阿尔茨海默病的概率明显增加[12]。对患有阿尔茨海默病(Alzheimer's disease,AD)的患者研究发现,其脑部胰岛素及胰岛素受体表达水平下降。而应用胰岛素治疗可以通过调 Aβ和磷酸化tau蛋白改善海马依赖的学习记忆力[13]。
在对胰岛素β细胞特异性过表达SIRT1的转基因小鼠研究发现,该模型小鼠的胰岛素β细胞在糖原刺激下其分泌胰岛素明显增强[14]。肝脏特异性敲除SIRT1的小鼠模型出现胰岛素抵抗病理状态。综上所述,SIRT1与2型糖尿病发病过程存在某种联系。因此,推测SIRT1可能在脑部的胰岛素分泌及疾病过程中起到关键性作用。接下来,我们将会在AD动物模型中进一步研究SIRT1与胰岛素信号通路之间是否存在一点联系,这将会为AD机制研究提供新的探讨。
[1] Duarte AI,Santos P,Oliveira CR,et al.Insulin neuroprotection against oxidative stress is mediated by Akt and GSK-3beta signaling pathways and changes in protein expression[J].Biochim Biophys Acta,2008,1783(6):994-1002.
[2] Plum L,Schubert M,Brüning JC.The role of insulin receptor signaling in the brain[J].Trends Endocrinol Metab,2005,16(2):59-65.
[3] Stockhorst U,de Fries D,Steingrueber HJ,et al.Insulin and the CNS:effectson food intake, memory, and endocrine parameters and the role of intranasal insulin administration in humans[J].Physiol Behav,2004,83(1):47 - 54.
[4] 姚志刚,秦川.表观遗传修饰在学习和记忆中的调节作用[J].中国实验动物学报,2011,19(5):441-445.
[5] Imai S,Armstrong CM,Kaeberlein M,et al.Transcriptional silencing and longevity protein b is an NAD-dependent histone deacetylase[J].Nature,2000,403(6771):795 - 800.
[6] Michan S,Sinclair D.Sirtuins in mammals:insights into their biological function[J].Biochem,2007,404(1):1 -13.
[7] Gan L,Mucke L.Paths of convergence:sirtuins in aging and neurodegeneration[J].Neuron,2008,58(1):10 -14.
[8] Gerhart-Hines Z,Rodgers JT,Bare O,et al.Metabolic control of muscle mitochondrial function and fatty acid oxidation through SIRT1/PGC-1alpha[J].EMBO,2007,26(7):1913 -23.
[9] Ramadori G,Lee CE,Bookout AL,et al.Brain SIRT1:anatomical distribution and regulation by energy availability[J].Neurosci,2008,28(40):9989 -9996.
[10] Sun C,Zhang F,Ge X,et al.SIRT1 improves insulin sensitivity under insulin-resistant conditions by repressing PTP1B[J].Cell metabolism,2007,6(4):307-319.
[11] Michán S,Li Y,Chou MM,et al.SIRT1 is essential for normal cognitive function and synaptic plasticity[J].Neurosci,2010,30(29):9695-9707.
[12] Ott A,Stolk RP,van Harskamp F,et al.Diabetes mellitus and the risk of dementia:The Rotterdam Study[J].Neurology,1999,53(9):1937-1942.
[13] De Felice FG,Vieira MN,Bomfim TR,et al.Protection of synapsesagainstAlzheimer's-linked toxins:insulin signaling prevents the pathogenic binding of Abeta oligomers[J].Proc Natl Acad Sci U S A.,2009,106(6):1971-1976.
[14] Moynihan KA,Grimm AA,Plueger MM,et al.Increased dosage of mammalian Sir2 in pancreatic beta cells enhances glucosestimulated insulin secretion in mice[J].Cell metabolism,2005,2(2):105-117.

