缺血性眩晕大鼠模型的建立
刘 阳,孙建宁,王 堃,李俊青,董世芬,张硕峰,张胜威,武 汀
(北京中医药大学中药学院中药药理系,北京 100102)
缺血性眩晕是指前庭感受器、前庭神经及相应中枢缺血导致功能紊乱而引起的眩晕。现有的实验性眩晕动物模型主要由家兔结扎椎动脉模型,家兔颈椎旁注射硬化剂模型和小鼠旋转致晕模型,这些模型由于手术复杂、缺血程度差异大、动物费用较昂贵或眩晕机制不同等原因,均无法作为合适的缺血性眩晕动物模型。本研究旨在建立一种切实可行并且操作简单的缺血性眩晕动物模型,通过结扎CCA和SCA致大鼠右侧半脑不完全脑缺血,并针对缺血和眩晕两个疾病特点,观察天保宁和盐酸地芬尼多对模型动物的治疗作用,以印证模型的可塑性和适用性。
1 材料和方法
1.1 实验材料
1.1.1 实验动物:健康 SD大鼠,雌雄各半,体重180~200 g,由北京维通利华实验动物技术有限公司提供【SCXK(京)2012-0001】,动物使用许可证【SYXK(京)2011-0024】。适应性喂养3 d后进入试验。
1.1.2 实验药品:盐酸地芬尼多片,山东仁和堂药业有限公司产品,批号110103。规格:每片含主要成分地芬尼多 25 mg。人用量为 3次/d,2片/次。按60 kg体重计,大鼠等效量相当于人用量6倍计算,大鼠受试剂量为15 mg/kg。天保宁:浙江康恩贝制药股份有限公司产品,批号:031213。规格:每片含9.6 mg总黄酮醇苷,萜类内酯2.4 mg。人用量为3次/d,2片/次,按60 kg体重计,大鼠等效量相当于人用量6倍计算,大鼠受试剂量为5.76 mg/kg(以总黄酮醇苷含量计算)。
1.1.3 实验仪器:400R低温离心机(德国Heraeus有限公司);YLS-3TB跳台记录仪(济南益延科技发展有限公司);三维立体脑定位仪(美国-ASI仪器公司);激光多普勒血流仪(美国BIO公司)。
1.2 实验方法
1.2.1 缺血性眩晕大鼠模型的建立 大鼠采用10%水合氯醛(0.35 mL/100g体重)麻醉后,仰卧位固定。剪开颈部皮肤,钝性分离肌肉,暴露并分离右侧CCA,穿线结扎;沿右侧CCA向胸腔内找至与右侧 SCA的分叉处,用弯镊勾出右侧 SCA,穿线结扎。
1.2.2 旋转刺激缺血性眩晕模型大鼠跳台逃避时间实验
1.2.2.1 分组及给药 SD大鼠56只,按体重随机分为4组,即假手术组、模型组、盐酸地芬尼多组、天保宁组。
灌胃给药,1次/d,共4次,假手术给予等量饮用水(10 mL/kg体重)。第4日于术后各组大鼠清醒后给药,给药后1h进行跳台逃避电刺激实验。
1.2.2.2 跳台逃避电刺激反射训练 每日给药1 h后进行跳台逃避电刺激反射训练。将大鼠放入跳台仪中,适应3 min后连续给予电刺激5 min,电刺激强度30 V、50 Hz。以大鼠跳上平台并保持30 s为训练成功,每日训练2次,连续训练3 d,以建立牢固的大鼠逃避电刺激的条件反射。
1.2.2.3 眩晕测试 按照1.2.1方法复制缺血性眩晕大鼠模型。假手术组大鼠仅剥离CCA及SCA,不结扎血管。于术后各组大鼠清醒后给药,给药1 h后将大鼠放入离心机内以500 r/min的速度匀速旋转30 s骤停,立即置于跳台仪中,记录从大鼠受到电刺激至第1次跳上平台并且30 s内不跌落所需的时间(不包括大鼠在平台上的时间),记为潜伏期。
1.2.3 缺血性眩晕模型大鼠前庭神经核组织血流量的变化
1.2.3.1 分组及给药 SD大鼠44只,按体重随机分为3组,即对照组、模型组、天保宁组。各组灌胃给药,1次/d,共3次,模型组给予等量饮用水(10 mL/kg体重)。第3日给药后1 h开始实验。
1.2.3.2 前庭神经核组织血流量的测定 按照1.2.1方法分离大鼠 CCA及 SCA,穿线备用(不结扎)。将手术后大鼠固定在三维脑立体定位仪上,采用平颅头位,距前囟10.2 mm,中缝右侧1.1 mm~2.5 mm,深4.5 mm~5.5 mm处,定位大鼠右侧前庭神经核[1],使用激光多普勒血流仪,测定右侧前庭神经核组织血流量,描记正常血流曲线,待血流平稳后,结扎右侧 CCA、SCA,并继续描记血流曲线30min。记录结扎动脉前、结扎动脉后5、10、15、20、25、30 min的血流值(每时间点记录1 min的平均血流值)。对照组大鼠不结扎血管。
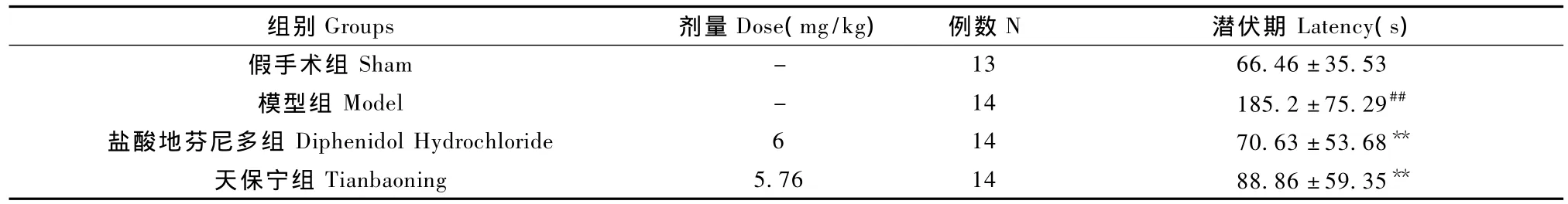
表1 各组大鼠旋转刺激后跳台逃避时间的比较Tab.1 Comparison of escape time of platform test in the rats stimulated by rotation
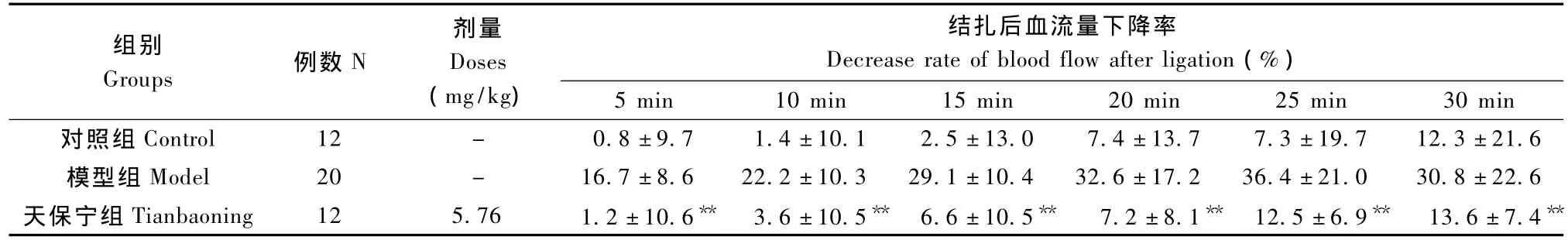
表2 各组大鼠结扎CCA及SCA后前庭神经核组织血流量下降率的比较Tab.2 Comparison of the decrease rate of blood flow of vestibular nucleus in the rats after ligating the CCA and SCA
1.2.4 统计方法 运用SPSS14.0进行数据统计分析,数值采用表示,组间比较采用ONEWAYANOVA分析,方差齐则用 LSD检验,否则用Dunnett’s T3 检验。
2 结果
2.1 旋转刺激缺血性眩晕模型大鼠跳台逃避时间实验
受离心机旋转刺激的大鼠无法准确控制肢体运动,表现为翻滚、转圈、步态不稳等,因而给予电刺激后无法迅速跳上平台逃避,或跳上平台后无法保持稳定(不少于30 s)而跌落。只有当眩晕基本消失、慢慢恢复清醒后,大鼠才能跳上平台并保持稳定不跌落。记录从大鼠受到电刺激至第1次跳上平台并且30 s内不跌落所需的时间(不包括大鼠在平台上的时间),记为潜伏期(表1)。与假手术组相比,模型组大鼠潜伏期显著增加(P <0.01),造模成功。与模型组比较,盐酸地芬尼多组大鼠潜伏期明显缩短61.9%(P<0.01),天保宁组大鼠潜伏期缩短52.0%(P<0.01),差异具有显著性。
2.2 缺血性眩晕模型大鼠前庭神经核组织血流量的变化
分别计算各组大鼠结扎 CCA及 SCA后5、10、15、20、25、30 min 血流量下降率(表 2)。模型组大鼠结扎动脉后,前庭神经核组织血流量明显减少,血流量随着时间增加下降更加明显。与模型组相比,天保宁可显著减小结扎动脉后组织血流量下降率,增加组织血流量,在结扎后 5、10、15、20、25、30 min血流量下降率分别减少 92.8%、83.8%、77.3% 、77.9% 、65.7% 、55.8%(P < 0.01)。

3 讨论
眩晕是一种常见的临床症状,发病率在10%以上[2],临床表现为平衡失调、站立不稳、倾倒、指物偏向等症状,严重影响患者的生活[3]。研究表明脑血管病是引起眩晕的重要病因,占85.4%,其中又以椎-基底动脉供血不足最为多见,占76%[4]。
实验性眩晕动物模型的建立主要选用小鼠、大鼠、豚鼠、家兔等实验动物。目前造模方法主要为3类。(1)手术结扎椎动脉法。如倪健强[5]用25%乌拉坦静脉麻醉家兔,取颈部正中切口切开皮肤至第一肋骨上缘,分离出气管,予以气管插管,沿右侧锁骨下动脉找到右侧椎动脉并结扎,造成椎基底动脉供血障碍。(2)颈椎旁硬化剂注射法,如郑重[6]、朱明双[7]用自制硬化剂775注射液10mL注射于家兔第3~5颈椎左侧横穿侧面,并于第2周重复1次,造成一侧椎动脉被压迫或牵扯致椎基底动脉供血障碍。(3)动物旋转法,如傅继华[8]选用小鼠,通过训练使其建立起逃避电刺激反射,然后通过旋转使动物产生眩晕。此外,Miyoshi向家兔右椎动脉内注射二磷酸腺苷(0.3mg/kg b.w.)造模成椎-基底动脉系统短暂脑缺血发作模型。上述3类造模方法中,手术结扎椎动脉法可有效导致脑缺血,但是手术较为复杂,不易于大量复制模型;颈椎旁硬化剂注射法与缺血性眩晕临床病因最为相符,但该法不易于控制狭窄程度,因而动物缺血程度会产生较大差异,不利于药效评价。并且上述两种方法采用的实验动物为家兔和豚鼠,成本较高,在新药药效筛选和药效评价的应用上受到限制。小鼠旋转致晕法虽然致晕效果稳定、明显,但是其眩晕机制与缺血性眩晕机制相差甚远,不能够作为缺血性眩晕模型来使用。
本模型通过结扎CCA和SCA造成前庭感受器、前庭神经核及相应中枢缺血。前庭感受器球囊、椭圆囊和半规管对迷路动脉供血变化颇为敏感,血流稍有减少即可产生恶心、呕吐、眩晕等平衡障碍[9]。前庭供血的主要来源是小脑前下动脉(AICA)[10]。AICA起源于基底动脉的近心端前2/3处[11],基底动脉起于 CCA 的前缘[12]。大鼠右侧CCA与SCA于胸锁关节的水平位置汇合成无名动脉,无名动脉起源于主动脉弓,因而沿大鼠右侧CCA向胸腔方向可找到SCA;大鼠左侧CCA与SCA不汇合,两者分别起源于主动脉弓,寻找SCA较困难,故分离结扎右侧 CCA和 SCA较为方便可行。与现有3种实验性眩晕动物模型相比,采用手术结扎右侧CCA和SCA致大鼠右侧半脑不完全脑缺血建立缺血性眩晕大鼠模型这种方法更加简单易行,且缺血差异较小,缺血程度稳定,与缺血性眩晕临床病因更为相符;选用大鼠作为实验动物,较家兔、豚鼠等更为经济。
天保宁为银杏叶提取物,具有增加脑部供血,改善脑功能的作用。研究表明银杏叶提取物可能通过银杏苦内酯稀释血液,降低血黏度,改善脑循环,增加脑血流量发挥作用[13,14]。与此同时,银杏内酯可降低麻醉犬脑血管阻力,增加脑血流量[15]。盐酸地芬尼多可改善椎底动脉供血,调节前庭系统功能,可用于各种原因引起的眩晕症,如椎基底动脉供血不全、美尼尔病、植物神经功能紊乱、晕车晕船等。缺血性眩晕主要的疾病特点是缺血和眩晕,天保宁和盐酸地芬尼多针对这两个不同的环节,有各自的治疗特点,即改善血流和治疗眩晕,具有一定代表性。并且这两个环节可能成为治疗缺血性眩晕的主要环节。因此,采用这两个药,观察药物对于模型的治疗作用,以印证模型的可塑性和适用性。
由实验结果可见,本模型脑部明显缺血,天保宁可明显增加缺血部位血流量;旋转刺激后大鼠无法准确控制肢体运动,翻滚、转圈、步态不稳等眩晕表现明显可见,通过潜伏期来反映动物眩晕程度及时间长短,盐酸地芬尼多可显著缩短模型大鼠潜伏期时间。本研究建立了一种缺血性眩晕大鼠模型,可有效应用于抗缺血性眩晕药物的研究。
[1] 包新民,舒斯云.大鼠脑立体定位图谱(第一版)[M].北京:人民卫生出版社,1999:78.
[2] 张洪庆,林铮,郎军添,等.国内眩晕研究的文献计量学分析[J].中国耳鼻咽喉头颈外科,2010,17(9):462-465.
[3] 应黎.眩晕疾病与药物治疗[J].中国全科医学,2005,8(12):991-992.
[4] 刘晓红,周维智,朱咏新,等.267例眩晕临床分析[J].卒中与神经疾病,2006,13(5):303-304.
[5] 倪健强,董万利,蔡增林.椎-基底动脉供血不足家兔模型体感诱发电位分析[J].临床神经电生理杂志,2003,12(4):56.
[6] 郑重,张泉,邓小筑.电针改善前庭功能障碍所致颈源性眩晕的实验研究[J].中国临床康复,2004,8(1):102.
[7] 朱明双,郑重,黄勇.注射硬化剂法制作家兔颈椎病椎动脉型模型[J].成都中医药大学学报,2000,23(3):18.
[8] 傅继华,余书勤,刘军.实验性眩晕动物模型的建立[J].中国药科大学学报,2002,33(6):518.
[9] 吕凡,黄魏宁.血管性眩晕[J].国外医学耳鼻咽喉科学分册,2004,28(4):209-213.
[10] AmarencoP, RosengartA, DeWittLD. Anteriorinferior cerebellar artery territory infarcts[J].Mechanism and clinical features.Arch Neurol,1993,50:154 - 161.
[11] Hegarty JL,Jackler RK,Rigby PL.Distal anterior inferior cerebellar artery syndrome after acoustic neuroma surgery[J].Otology& Neurology,2000,23:560-571.
[12] 杨安峰,王平.大鼠的解剖和组织(第一版)[M].北京:科学出版社,1985:113.
[13] 任俊,贾正平.银杏内酯对脑血管疾病防治作用的研究进展[J].中国医院用药评价与分析,2003,3(6):374-376.
[14] Xia S H,Fang D C.Pharmacological action and mechanisms of ginkgolide B[J].Chin Med J(Engl),2007,120(10):922 -928.
[15] 孙莉莎,徐江平,李琳.银杏内酯对犬脑血流量的影响[J].中西医结合学报,2005,3(1):50 -53.

