液相中地下水对过氧化氢稳定性的影响
郭 欣,张世强,麦灿基
(中国人民解放军63655 部队,乌鲁木齐841700)
某型装置工作前,需要使用5t去离子水、4t 35%的过氧化氢(Hydrogen Peroxide)将储罐及管路分别浸泡12h,以达到安全及高效的运行目的,但是由于使用去离子水清洗,不但效率低,且性价比不高,因此在不影响系统正常运行并保证安全的条件下,简化操作程序,或者降低去离子水的用量,或者能够用其他易于获得的水替代,无疑对系统运行与日常维护都具有积极的意义。
用普通水替代去离子水可能带来液相、固相杂质的负面效应。探讨简化清洗程序的可能性,核心就是评估液、固相杂质对过氧化氢稳定性的影响程度,这种影响的本质就是过氧化氢的分解效应。所以本文的研究是将过氧化氢置于干扰因素环境中,测定其浓度,以浓度随时间的变化作为判据,判断各种影响因素对过氧化氢分解的贡献,进而推断应用普通水替代去离子水、简化操作程序的可能性。
以杂质含量较高的新疆地下水为去离子水的替代对象,探讨了液相中残留地下水对过氧化氢稳定性的影响,实验结果表明,液相中少量靶场地下水对过氧化氢的稳定性没有影响。
1 实验目的及内容
探讨普通地下水中无机离子对过氧化氢稳定性的影响;实验内容主要包括过氧化氢浓度测定及高锰酸钾标准溶液标定[1],测定均采用滴定法。
2 实验原理
根据本实验的目的,判定过氧化氢稳定性以其浓度变化为依据,过氧化氢浓度标定以高锰酸钾为标准物,高锰酸钾的标定用草酸钠作基准物[2]。实验采用滴定法,根据高锰酸钾颜色变化判断终点。
2.1 过氧化氢浓度测定原理
在酸性介质中,过氧化氢与高锰酸钾发生氧化—还原反应,高锰酸钾为氧化剂,过氧化氢为还原剂:
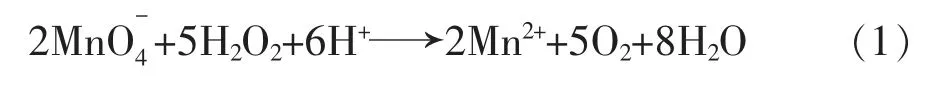
以高锰酸钾为标准物,依据高锰酸钾标准溶液的消耗量测定过氧化氢的含量。
2.2 高锰酸钾标定原理
测定过氧化氢含量,须预先知道高锰酸钾标准物的准确浓度,然而高锰酸钾本身不是基准物,因此首先需用其他基准试剂标定[3]。
草酸钠是化学上常用的基准试剂,以此作为基准物质标定高锰酸钾。反应在H2SO4介质中进行,其原理:
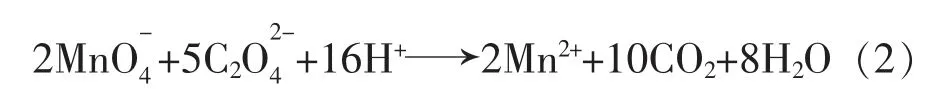
已知草酸钠含量,根据高锰酸钾溶液消耗量就可推算出浓度。
3 实验步骤
3.1 过氧化氢浓度测定
试验前,称取0.45~0.5g过氧化氢样品,称准至0.0002g,并转移至250mL容量瓶中。称量瓶用去离子水多次洗涤,洗涤液全部倒入容量瓶内,以避免过氧化氢损失,稀释至刻度,此时过氧化氢浓度大约在0.03mol/L左右。稀释转移不慎是较大误差的来源之一。
滴定时,用移液管取25.00mL过氧化氢溶液,与35mL 0.3mol/L的H2SO4溶液在250mL锥形瓶中混合,用已标定好的高锰酸钾溶液滴定至溶液呈微红色,并在30s内不消失即为滴定终点。根据KMnO4标准溶液的浓度、滴定中所消耗的体积,结合滴定度,即可求出H2O2的含量。
3.2 高锰酸钾标定
3.2.1 溶液配制
称取3.3g高锰酸钾,分别溶于1100,2200mL水中,缓缓煮沸15min,冷却后暗处保存两周,过滤于干燥的棕色瓶中。
3.2.2 标定步骤
称取0.2g草酸钠,置于称量瓶中,然后在107 ℃下烘至重量不再变化。两轮实验中,恒重后的草酸钠分别是0.2002g和0.2042g。用100mL硫酸溶液(8mL 98%H2SO4/92mL H2O,V/V)将其转移到滴定瓶中,用待标定的高锰酸钾以恒定速度滴定。近终点时,用恒温水浴加热至65 ℃,继续滴定至溶液呈粉红色,且30s内不褪色即为滴定终点。
3.3 实验及标定结果计算
根据化学方程式(1)的电子转移当量关系,可得出H2O2浓度计算公式:
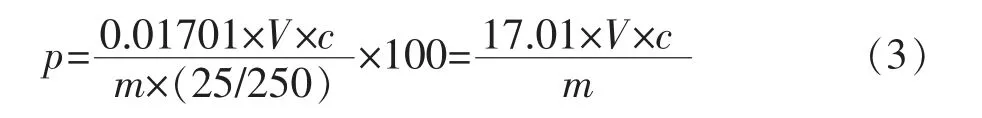
式中 p为H2O2的质量百分比浓度;0.01701为滴定度,即与1.00mL高锰酸钾标准溶液相当的H2O2质量;c为高锰酸钾标准溶液浓度,V为滴定中消耗的高锰酸钾标准溶液体积;m为所称量的H2O2试样质量;(25/250)为已用H2O2体积占其总量的比例。
根据化学方程式(2)的电子转移当量关系,可得出KMnO4浓度计算公式:
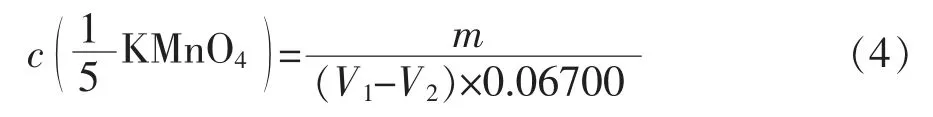
两轮实验标定的高锰酸钾浓度分别为0.1200mol/L和0.06423mol/L。
所有实验均在室温下进行(20 ℃),所有溶液均由去离子水配制。
3.4 过氧化氢样品配制
将地下水用定性滤纸过滤,以消除不溶性杂质的影响。
第一轮、第二轮实验取过滤后的地下水2.00,1.00mL分别加入1000,250mL棕色容量瓶中,再将90%过氧化氢溶液加至刻度,均匀混合,记录时间,以此作为地下水与过氧化氢相互作用的起点。实验数据中所列时间长度,均以此为时间原点[5]。
在另一样品中加入同样比例去离子水以作对比。地下水含量分别为0.2%(V/V)和0.4%(V/V)。
3.5 试剂及仪器
3.5.1 化学试剂
H2O2(92%,m/m);KMnO4(A.R.);H2SO4(98%,A.R.);Na2C2O4(基准试剂);经滤纸过滤的新疆地区地下水;去离子水。
3.5.2 仪器及玻璃器皿
DT224S赛多利斯电子天平;DZKW-D-2电热恒温水浴;101-1-5型电热恒温鼓风干燥箱。
50mL棕色酸式滴定管1支;100,250,1000mL容量瓶若干;2000mL棕色广口瓶1个;250mL锥形瓶3个;称量瓶3个;50,100,250mL烧杯若干。
4 结果与讨论
4.1 普通清洗水对过氧化氢潜在影响分析
采用普通水替代去离子水清洗过氧化氢储罐及管路,需考虑水中无机离子的影响。固相效应的主要表现有:①水中钙、镁离子或其他重金属离子与碳酸根离子结合在容器壁析出沉淀,沉淀对过氧化氢的分解;②水中不溶性杂质对过氧化氢的分解。
过氧化氢分解的后果主要有:①过氧化氢浓度减小,降低了化学反应效率,使引射能力降低,导致激光器光腔真空度达不到要求,进而使激光器出光效率降低;②分解的气体产物如果不能释放,压力累积超过容器抗压极限,可能导致爆炸,后者是最主要的威胁[6]。
4.2 地下水含量确定
新疆地区地下水中无机离子含量较高,以此为干扰对象的实验结果可以适用于全国大部分地区,具有一定的上限意义。
假如清洗水不能完全排放,残留清洗水的量从两个方面考虑,一是可能残留的上限值,二是对过氧化氢浓度影响不能太大,因此假定每次清洗残留0.2%(V/V)的洗涤水,对应实际体系约10L。
第一轮实验后,为考察地下水含量对过氧化氢稳定性的影响,所以将其含量提高到0.4%(V/V),对应实际体系约20L。
另外,以等量去离子水浓度的过氧化氢样品为对照物,并与原始样品比较,检验不同干扰物的影响效果。
4.3 实验结果
原始过氧化氢溶液加入一定量地下水后,进行了两轮测量。检测在有干扰物质的情况下,过氧化氢浓度随时间延长的变化情况。
每次实验取样前,定性观察样品外观,发现液面、瓶底、溶液内部均无气泡,定性表明样品稳定。
定量实验结果如表1、表2所示。
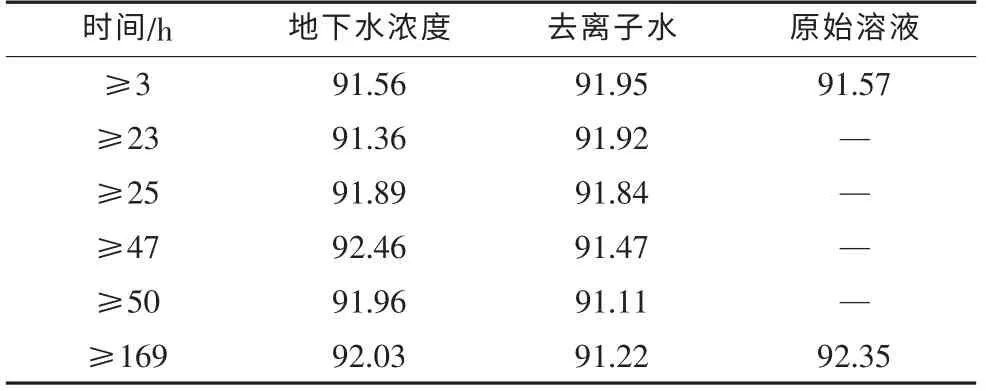
表1 第一轮实验过氧化氢浓度与时间的关系 单位:%
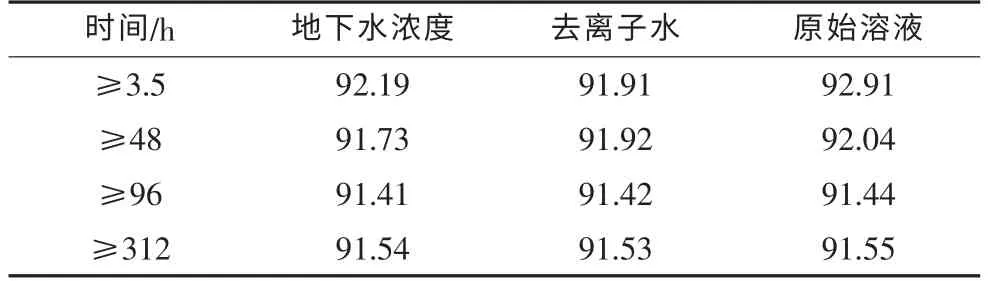
表2 第二轮实验过氧化氢浓度与时间的关系 单位:%
4.4 分析方法准确度检验
分析方法是否准确、适用,可以用校正系数检验法验证,即将实际求得的校正系数与95%置信度的理论值比较,如果实际值小于理论值,证明实验方法可靠[7]。具体步骤:
(1)计算测定结果如式(5)。

式中 M为每组样品实验结果的算术平均值;mi为实测值,n为实验次数。
由式(5)可算出两轮实验样品浓度的平均值,见表3。
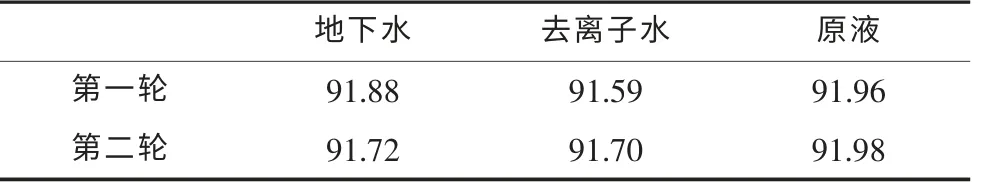
表3 两轮实验结果的平均值
(2)求出每组样品实验数据的均方根偏差S。

式中 S为单次测定标准偏差;di为第i个测定值与平均值M之差;n为实验次数。
根据方程式(6),计算得出两轮实验标准偏差,如表4所示。

表4 过氧化氢样品浓度测定值的标准偏差
求出多次测定结果的平均值M平(表3)和平均值的标准偏差:

S可由表4得出,n为实验次数,则校正系数t为:

式中 M平是每组地下水或去离子水样品的平均浓度,M真是原液平均浓度。
由方程(7)、(8)求出校正系数,如表5所示。

表5 实验方法校正系数
由表5可知,t0.95是95%置信度,实验次数分别是6和4的校正系数最大值,如果t
4.5 数据可靠性分析
实验数据是否客观可靠,是否有需要舍弃的可疑值,需要用数学方法予以检验。对于实验次数在3~10的测量来说,用迪克松(Dixon)检验法即舍弃商法(又称Q值检验法)检验可疑值比较合理。
舍弃商Q的表达式为:

式中 n疑是可疑值,n邻是可疑值的邻近值,nmax、nmin分别是测量值的最大值和最小值;将实际计算得出的Q值与理论值比较,如果Q实际>Q理论,则舍弃可疑值,反之,予以保留,表6是置信概率为95%的舍弃商值。

表6 舍弃商Q的数值
假定每组样品的最大、最小值为可疑值,根据方程(9)求出表1的舍弃商值分别为:
地下水:Qmax=0.06,Qmin=0.17
去离子水:Qmax=0.04,Qmin=0.01
由表6查出,测量次数是6,置信概率为95%的舍弃商值的上限Q0.90=0.56,地下水、去离子水极值的舍弃商值均小于该值,所以所有测量数据有效。
同理计算出第二轮实验即表2中每组数据极值的舍弃商值:
地下水:Qmax=0.59,Qmin=0.17
去离子水:Qmax=0.02,Qmin=0.22
原始溶液:Qmax=0.64,Qmin=0.08
由表6查出,测量次数是4,置信概率为95%的舍弃商值的上限Q0.90=0.76,地下水、去离子水及过氧化氢原液的Qmax、Qmin均小于该值,所以所有测量数据有效。
4.6 实验数据的置信概率的置信区间
实验数据是否可信,可以用实验结果真实值所在的范围,即置信区间,以及真实值落在此范围内的概率即置信概率说明。
由于每组样品真实浓度未知,因此近似以每组样品的算术平均浓度代替其真实值,以均方根误差代替均方根偏差。
置信区间界限P:

式中 t为校正系数;S为均方根偏差;n为测定次数。
校正系数t与置信概率及测定次数有关,在置信概率为95%、测定次数为4的情况下,t=3.18;置信概率为95%,测定次数为6时,t=2.57。
由方程(10)及表4可计算出两轮实验结果的置信界限,如表7所示。

表7 过氧化氢样品浓度测定值的置信界限
由表7可得各组样品的置信区间,如表8所示。
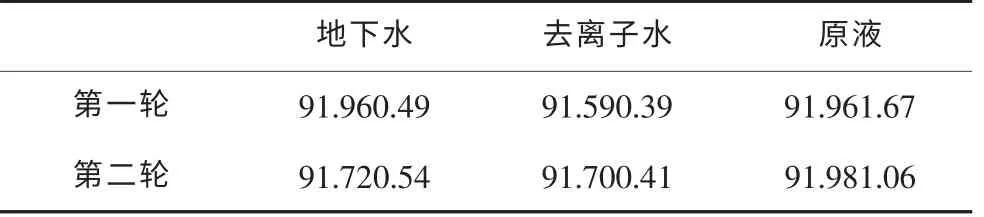
表8 过氧化氢样品浓度测定值的置信区间
由表7、表8可知,地下水样品与去离子水样品置信区间比较接近,第二轮实验比第一轮实验精密度高,加水后的样品测定结果精密度比原液的好。说明改进实验条件后减小了误差,而且实验操作、外部环境等随机因素对原液的影响较大。
4.7 实验数据误差分析
在过氧化氢原液中加入水后,其浓度应该降低。根据实验条件,第一轮、第二轮实验的过氧化氢浓度应分别降低0.2%、0.4%。表5所示地下水和去离子水样品浓度都不大于原液的浓度,与理论分析相符,其浓度平均比原液低0.3%,与理论值比较接近,考虑实验误差的影响,属于正常范围[8]。
两轮实验测定的过氧化氢原液浓度基本一致,与实际情况相符。
根据数据的标准偏差可以衡量数据的精密度。由表4可知,地下水和去离子水样品实验数据的精密度好于原液,第二轮实验结果离散度总体略好于第一轮。此结果与改进实验方法和减小滴定误差有关。
实验过程中发现,称量、过氧化氢样品转移、滴定管读数、终点判读及KMnO4标准溶液浓度变化等几个步骤对测定结果影响较大。
每次测量前,需准确称取过氧化氢液体样品,称量误差是对实验误差贡献较大的误差来源之一。因此在第二轮实验中,将称取的H2O2样品量扩大了4倍,即在1.8~2.0g范围内,通过增加样品量减小称量误差。然后将样品转移到1000mL容量瓶中。其余实验步骤、试剂用量及H2O2浓度计算公式不变。实验发现,称量用的电子天平零点不太稳定。第一轮实验时,电子天平置于通风橱下,受空气对流、温度变化及机械振动等不利因素影响比较大,所以零点漂移也较明显。第二轮实验时,将电子天平从通风橱下移至相对稳定的处所,情况略有好转,但零点漂移现象仍然存在。每次称量以5min内漂移量不大于±0.0010g为合格,一般情况下控制在0.0005g以内,否则,重新关机、预热、称量。
以绝对误差为0.0010g计算,称量样品为0.45g的情况下,δmax1=22%;在样品为1.8g的情况下,δmax1=0.056%。
计算可知,经改进后,虽然称量的绝对误差没变,但相对误差却只有原来的1/4。
称量完成后,过氧化氢样品被转移到1000mL或250mL容量瓶中。样品约只有0.34mL或1.3mL左右,稍有损失,即可带来较大误差,而且难以定量控制。
滴定步骤的误差主要有两方面,一是滴定管读数误差,二是终点颜色判断误差。
紫色KMnO4溶液在棕色滴定管中难以准确看清液面,而且滴定管最小读数是0.10mL,只能保证准确读取0.05mL。这样在第一轮实验滴定量约20mL的情况下,读数误差约0.25%。第二轮实验将高锰酸钾浓度降低一半,旨在通过增加高锰酸钾体积消耗量减小高锰酸钾滴定误差,以平均消耗KMnO440mL计,0.05mL标准溶液的误差约0.12%。
按上述方法计算,两轮实验称量误差与滴定误差两步骤的极值误差分别为:

样品转移误差也是误差重要来源之一,由于样品量少,而且转移载体每次不能全部倒完,尤其是初始几次转移,如果稍有损失,就可能给后续步骤带来很大误差,所以波动性较大。
4.8 实验数据的意义
以地下水、去离子水样品的过氧化氢浓度实验数据与时间的关系,结果如图1、图2所示。
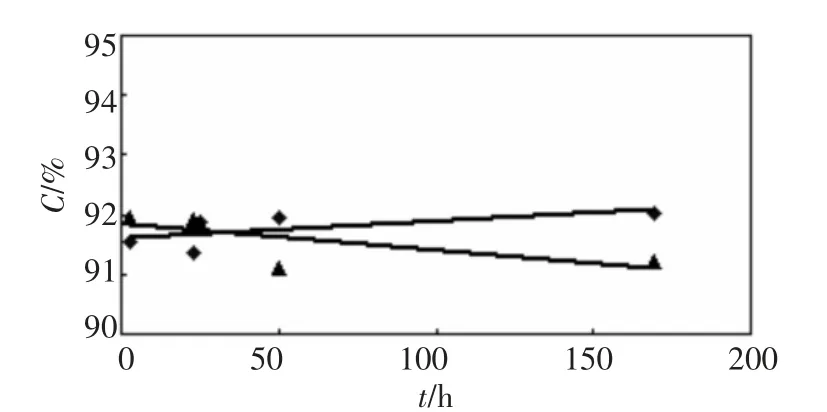
图1 第一轮实验过氧化氢浓度与时间关系
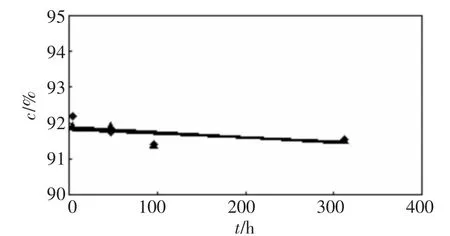
图2 第二轮实验过氧化氢浓度与时间关系
由图1可知,二样品的浓度围绕某一值波动,没有明显下降趋势;图2所示,二样品浓度也基本稳定,即使经过13d,浓度仍然没有变化。第一轮数据离散性比第二轮的大,但测定值与其平均值的偏差不大于0.5%,均在实验误差范围以内,所以浓度变化应是测量误差所致。
4.9 液相中地下水杂质对过氧化氢稳定性影响的理论分析
大多数重金属,如Fe、Cu、Ag、Pb、Hg、Zn、Co、Ni、Cr、Mn等及其氧化物和盐类都是分解过氧化氢的活性催化剂。正常情况下(不受热、无撞击等外界破坏性物理效应),催化剂导致的化学分解效应是对过氧化氢稳定性影响最重要的影响因素,必须认真评估其对过氧化氢稳定性的影响程度。
为定量考察杂质含量的影响,假如新疆地区地下水为国标Ⅳ类水质[9],相应标准如表9所示。
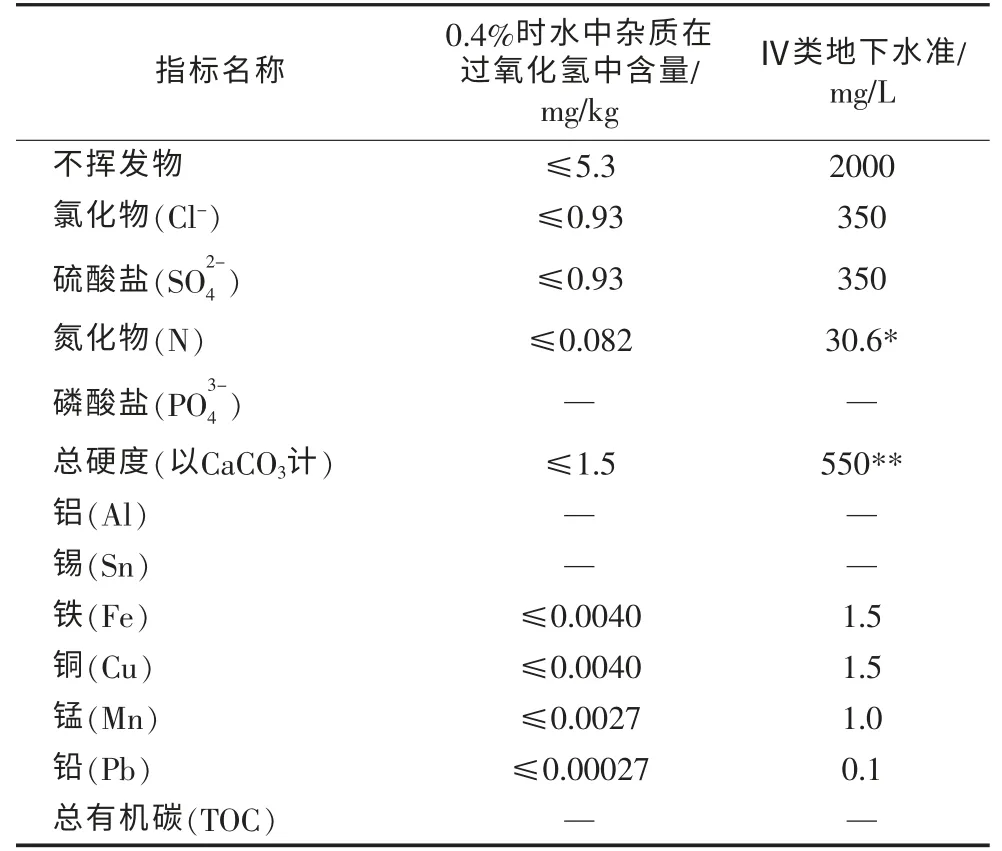
表9 杂质含量比较
由表9可见,残留洗涤水中能使过氧化氢催化分解的重金属离子含量,均远远低于过氧化氢溶液中的允许标准,溶液中重金属含量的贡献可以忽略不计,不会造成过氧化氢额外的催化分解。
表9中,氮化物浓度远低于其允许值,即使与过氧化氢中的氮化物杂质叠加,其含量也基本不会超标。
硫酸根离子含量为允许值的1/3,如果与过氧化氢中的硫酸根叠加,其含量有可能超标。但硫酸根不会催化分解H2O2,其最大影响是与重金属离子结合形成沉淀,从而导致过氧化氢分解。
以难溶、易形成沉淀的硫酸盐——BaSO4为例,其溶度积Ksp=1.1×10-10,假如Ba2+的最高限量也是0.2mg/kg,浓度为4mg/kg,近似认为离子活度等于其浓度,则二离子浓度积:
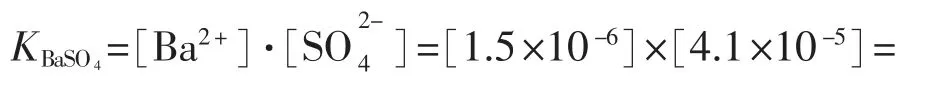

由于Ksp 氯与标准接近,但Cl-氧化后以Cl2形式逸出溶液,不会继续对过氧化氢施加影响。实际上,即使Cl-标1倍,在8t过氧化氢中不过8g,全部被氧化: 消耗的过氧化氢不超过8g,所以影响也不大。 事实上,上述假设是非常苛刻的,因为每次清洗容器后,会将洗涤水全部放掉,且放水口位于储罐最低处,罐中及管路内不可能累积20L水,即使积水也仅是表面一层水膜;其次,在水清洗程序后是3t 35%的过氧化氢浸泡,即使上一步骤有积水,并且假如过氧化氢清洗液也剩余20L,则最后清洗水的量约0.2L,其余绝大部分随过氧化氢清洗液一起排掉。如果加装2m390%的过氧化氢,则地下水带入溶液中的杂质浓度比表1中低两个数量级,所带来的附加影响可以忽略不计。 分析可知,液相中残留的地下水不会降低过氧化氢的稳定性,也不会对容器的安全性造成致命的威胁。 在90%过氧化氢溶液中杂入少量地下水,不会影响其稳定性,用地下水清洗过氧化氢储罐、管路,残留在液相中的少量地下水不会加速过氧化氢分解。 [1]陈群来.我国过氧化氢的生产和应用[J].现代化工,2001(1). [2]李承美.用基准试剂标定标准溶液称量方法的改进[J].大氮肥,1996(5). [3]柏道发.重视标准溶液的管理[J].化学分析计量,1995(1). [4]徐斌,齐广才,任乃林.滴定分析结果的一种快速计算法——摩尔滴定系数法[J].延安大学学报(自然科学版),1997(2). [5]胡长诚.近年来国内外过氧化氢行业新进展[J].化学推进剂与高分子材料,2009(1). [6]袁志平.化学氧碘激光器中BHP溶液的稳定性[J].中国工程物理研究院科技年报,2002(6). [7]韩永志,韩冰.标准物质量值的溯源性及不确定度[J].化工标准、计量、质量,2002(10). [8]冯继熙.使用基准试剂时测定值异常的原因探究[J].化工标准化与质量监督,1996(6). [9]GB/T 14848—93,中华人民共和国国家标准地下水质量标准[S].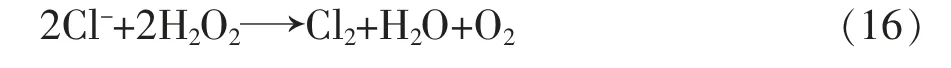
5 结语

