钨磺酸催化一锅法合成α-胺基腈化合物*
陆 军,李新生
(1.苏州百灵威超精细材料技术有限公司,江苏 苏州 215129;2.浙江师范大学 化学与生命科学学院,浙江 金华 321004)

近期,固体催化剂钨磺酸以其廉价易得(见反应式1)、无毒及对水和空气比较稳定等特点而受到人们的重视,并应用于多种有机合成反应中,获得了良好的效果[7].基于文献[8]对固体酸催化剂在有机合成方面的研究,本实验把钨磺酸应用于Strecker 反应(见反应式2)来合成α-胺基腈化合物,获得了良好的结果.

1 实验部分
1.1 仪器与试剂
1H NMR 在Bruker AMX 400 核磁共振仪上测定,以CDCl3为溶剂,四甲基硅烷(TMS)为内标;高分辨质谱(HRMS)在VG 7035 质谱仪上测定;红外光谱(IR)采用液膜或压片法,在Bio-Rad FTS 165 型红外光谱仪上测定.
所用试剂均为市售分析纯、化学纯或工业级药品.所用溶剂都经过干燥和重蒸.
1.2 钨磺酸的合成
在100 mL 圆底烧瓶中加入氯磺酸(11.6 g,0.1 mol),冰水冷却下慢慢分批加入无水钨酸钠(14.7 g,0.05 mol),振荡1 h,加入30 mL 乙醚搅拌均匀,浓缩,重复2 次以除尽氯化氢气体,得产物.
1.3 α-胺基腈的合成
在10 mL 圆底烧瓶中加入自制钨磺酸(0.3 g)和二氯甲烷(5 mL),室温搅拌下加入醛(1 mmol)和胺(1 mmol),随后加入三甲基氰硅烷(TMSCN,1.1 mmol),室温搅拌.实验过程中通过硅胶薄层色谱(TLC)跟踪,用紫外灯检测.反应完全后抽滤,固体用二氯甲烷洗涤,有机层用饱和食盐水洗涤,然后用无水硫酸钠干燥,减压蒸去溶剂,剩余物柱色谱提纯,得到产物.
2 结果与讨论
在钨磺酸的催化作用下,不同取代基的醛和胺在室温下都能顺利地进行Strecker 反应(见表1).当醛的苯环上有吸电子基时,反应产率稍微增加,反之则减少(见表1 项目1~7);当芳环为呋喃和噻吩时,产率降低很多(见表1 项目9~10).该反应在此反应条件下无副产物产生,可能是由于在钨磺酸的催化作用下,醛和胺能够快速形成亚胺,而亚胺又能够被钨磺酸活化而进行Strecker 反应.钨磺酸具有无毒及对水和空气稳定的优点,同时,它能够被回收使用,其催化活性循环使用3 次均保持不变,避免了
在反应中使用毒害性大的催化剂,使反应环境友好.
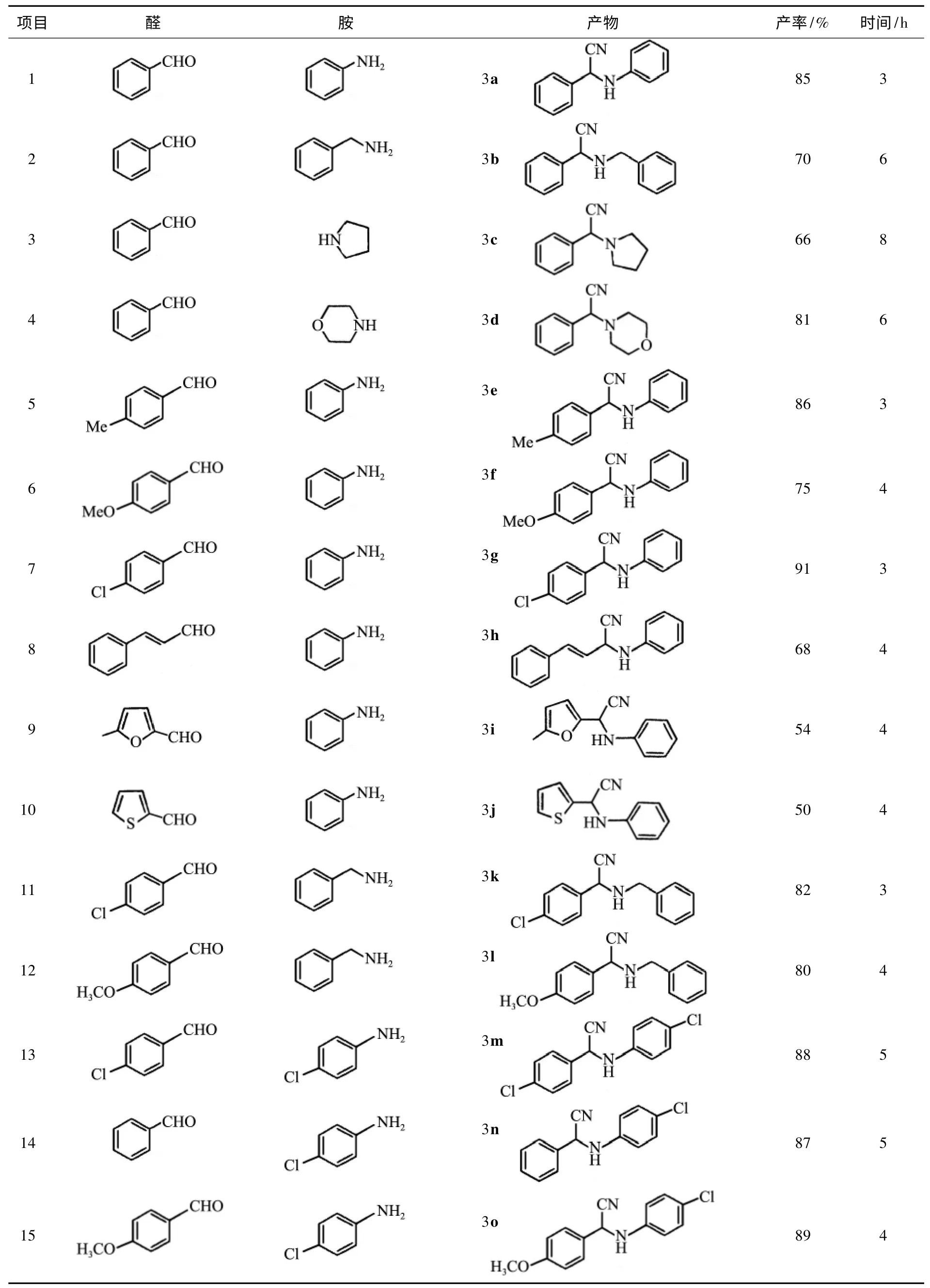
表1 钨磺酸催化的α-胺基腈化合物的合成
3a IR(KBr)σ/cm-1:3 370,2 236,1 606,1 488.1H NMR(400 MHz,CDCl3)δ/ppm:4.02(d,J=8.4 Hz,1H),5.41(d,J=8.4 Hz,1H),6.74(d,J=7.8 Hz,2H),6.92(d,J=7.8 Hz,1H),7.29~7.25(m,2H),7.48~7.40(m,3H),7.69~7.58(m,2H).HRMS 计算值:C14H12N2,208.100 0;文献值:208.100 2.
3b IR(KBr)σ/cm-1:3 332,2 228.1H NMR(400 MHz,CDCl3)δ/ppm:1.83(br,s,1H,NH),3.95(q,J=14.85 Hz,2H),4.69(s,1H),7.27~7.51(m,10H).HRMS 计算值:C15H14N2,222.115 7;文献值:222.116 3.
3c IR(KBr)σ/cm-1:2 228.1H NMR(400 MHz,CDCl3)δ/ppm:1.82(m,4H),2.64(m,4H),5.04(s,1H),7.34~7.53(m,5H).HRMS 计算值:C12H14N2,186.115 7;文献值:186.115 3.
3d IR(KBr)σ/cm-1:2 231.1H NMR(400 MHz,CDCl3)δ/ppm:2.57(t,J=4.62 Hz,4H),3.72(t,J=4.62 Hz,4H),4.81(s,1H),7.37~7.54(m,5H).HRMS 计算值:C12H14N2O,202.110 6;文献值:202.109 7.
3e IR(KBr)σ/cm-1:3 338,2 236;1H NMR(400 MHz,CDCl3)δ/ppm:2.45(s,3H),4.15(d,J=8.04 Hz,1H),5.40(d,J=8.01 Hz,1H),6.81(d,J=8.43 Hz,2H),6.95(m,1H),7.28~7.35(m,4H),7.51(d,J=8.04 Hz,2H).HRMS 计算值:C15H14N2,222.115 7;文献值:222.116 1.
3f IR(KBr)σ/cm-1:3 360,2 235;1H NMR(400 MHz,CDCl3)δ/ppm:3.84(s,3H),4.15(d,J=8.43 Hz,1H),5.36(d,J=8.04 Hz,1H),6.79(d,J=8.43 Hz,2H),6.90~6.99(m,3H),7.29(t,J=8.03 Hz,2H),7.50(d,J=8.01 Hz,2H).HRMS 计算值:C15H14N2O,238.110 6;文献值:238.110 2.
3g IR(KBr)σ/cm-1:3 382,2 238;1H NMR(400 MHz,CDCl3)δ/ppm:4.10(d,J=8.43 Hz,1H),5.36(d,J=8.43 Hz,1H),6.72(d,J=7.65 Hz,2H),6.88(t,J=7.43 Hz,1H),7.24(t,J=7.83 Hz,2H),7.37(d,J=8.43 Hz,2H),7.47(d,J=8.22 Hz,2H).HRMS 计算值:C14H11ClN2,242.061 1;文献值:242.060 5.
3h IR(KBr)σ/cm-1:3 429,2 232;1H NMR(400 MHz,CDCl3)δ/ppm:3.91(d,J=9.24 Hz,1H),5.04(m,1H),6.25(dd,J=16.05 Hz,J=5.22 Hz,1H),6.76(q,J=3.21 Hz,2H),6.89(t,J=7.43 Hz,1H),7.03(dd,J=15.63 Hz,J=1.59 Hz,1H),7.23~7.39(m,7H).HRMS 计算值:C16H14N2,234.115 7;文献值:234.115 5.
3i IR(KBr)σ/cm-1:3 423,2 241;1H NMR(400 MHz,CDCl3)δ/ppm:2.33(s,3H),4.21(d,J=8.82 Hz,1H),5.43(d,J=8.85 Hz,1H),6.01(q,J=1.07 Hz,1H),6.46(d,J=2.82 Hz,1H),6.79(d,J=8.43 Hz,2H),6.92(m,1H),7.29(m,2H).HRMS 计算值:C13H12N2O,212.095 0;文献值:212.095 2.
3j IR(KBr)σ/cm-1:3 338,2 235;1H NMR(400 MHz,CDCl3)δ/ppm:4.20(d,J=8.85 Hz,1H),5.58(d,J=9.24 Hz,1H),6.74(d,J=7.62 Hz,2H),6.89(t,J=7.43 Hz,1H),7.00(q,J=2.81 Hz,1H),7.21~7.33(m,4H).HRMS 计算值:C12H10N2S,214.056 5;文献值:214.056 3.
3k IR(KBr)σ/cm-1:3 315,2 238,1 596,1 466;1H NMR(400 MHz,CDCl3)δ/ppm:7.49(d,J=8.4 Hz,2H),7.39~7.28(m,7H),4.73(s,1H),3.99(AB q,J=12.8 Hz,2H).HRMS 计算值:C15H13ClN2,256.076 7;文献值:256.076 2.
3l IR(KBr)σ/cm-1:3 325,3 031,2 923,2 231,1 598,1 491;1H NMR(400 MHz,CDCl3)δ/ppm:1.83(s,1H),3.82(s,3H),4.00(AB q,J=12.8 Hz,2H),4.70(s,1H),6.92(d,J=8.4 Hz,2H),7.41~7.29(m,5H),7.44(d,J=8.8 Hz,2H).HRMS 计算值:C16H16N2O,252.126 3;文献值:252.125 9.
3m IR(KBr)σ/cm-1:3 307,3 064,2 238,1 595,1 490;1H NMR(400 MHz,CDCl3)δ/ppm:4.05(d,J=8.4 Hz,1H),5.38(d,J=8.4 Hz,1H),6.69(d,J=9.2 Hz,2H),7.23(d,J=8.4 Hz,2H),7.44(d,J=8.4 Hz,2H),7.54(d,J=8.8 Hz,2H).HRMS 计算值:C14H10Cl2N2,276.022 1;文献值:276.021 8.
3n IR(KBr)σ/cm-1:3 336,2 234;1H NMR(400 MHz,CDCl3)δ/ppm:4.25(d,J=8.43 Hz,1H,NH),5.38(d,J=8.43 Hz,1H,CH),6.69(d,J=8.43 Hz,2H,CH2),7.21(d,J=8.85 Hz,2H,CH2),7.44~7.58(m,5H).HRMS 计算值:C14H11ClN2,242.061 1;文献值:242.060 6.
3o IR(KBr)σ/cm-1:3 328,3 033,2 236,1 596,1 495;1H NMR(400 MHz,CDCl3)δ/ppm:3.84(s,3H),4.00(d,J=7.6 Hz,1H),5.31(d,J=7.6 Hz,1H),6.69(d,J=8.8 Hz,2H),6.97(d,J=8.4 Hz,2H),7.22(d,J=8.8 Hz,2H),7.49(d,J=8.8 Hz,2H).HRMS 计算值:C15H13ClN2O,272.071 6;文献值:272.071 4.
3 结论
钨磺酸能有效地催化醛、胺和三甲基氰硅烷间的三组分Strecker 反应,且反应条件温和、操作简单、催化剂可循环使用,是一锅法合成α-氰基化合物的简单有效的方法.
[1]Groger H.Catalytic enantioselective strecker reactions and analogous syntheses[J].Chem Rev,2003,103(8):2795-2828.
[2]Paraskar A S,Sudalai A.Cu(OTf)2or Et3N-catalyzed three-component condensation of aldehydes,amines and cyanides:a high yielding synthesis of α-aminonitriles[J].Tetrahedron Lett,2006,47(32):5759-5762.
[3]De S K,Gibbs R A.Vanadyl triflate as an efficient and recyclable catalyst for trimethylsilyl cyanide addition to carbonyl compounds[J].J Mol Catal A:Chem,2005,232(1/2):123-125.
[4]De S K.RuCl3catalyzed one-pot synthesis of α-aminonitriles[J].Synth Commun,2005,35(5):653-656.
[5]De S K,Gibbs R A.Praseodymium trifluoromethylsulfonate as an efficient and recyclable catalyst for the synthesis of α-aminonitriles[J].Synth Commun,2005,35(7):961-966.
[6]邬继荣,陈巍峰,罗蒙贤,等.三碘化钐催化的一锅法合成α-胺基腈化合物[J].有机化学,2010,20(10):1497-1501.
[7]Karami B,Montazerozohori M.Tungstate sulfuric acid (TSA)/KMnO4as a novel heterogeneous system for rapid deoximation[J].Molecules,2006,11(9):720-725.
[8]Chen Weiyi,Lu Jun.Silica sulfuric acid catalyzed one-pot synthesis of α-aminonitriles[J].Synlett,2005(15):2293-2295.

