饥饿胁迫下福寿螺的存活和产卵情况及器官组织损伤观察
郭 靖,章家恩,2,3,赵本良,2,3,罗明珠,2,邓智心
1华南农业大学农学院,广东 广州510642;2华南农业大学农业部热带农业环境重点开放实验室,广东 广州510642;3广东省高等学校农业生态与农村环境重点实验室,广东 广州510642
福寿螺Pomacea canaliculata Lamarck,又名大瓶螺、苹果螺,原产于南美洲亚马逊河流域。因其蛋白质含量丰富、营养成分高且繁殖能力强,1980年前后,福寿螺被作为一种水生经济动物引入台湾、菲律宾和日本,并迅速扩散到东亚和东南亚其余国家(Halwart,1994)。1981年,福寿螺被引入我国广东省中山市,之后在全国范围内兴起一股养殖热潮,福寿螺迅速扩散到我国多个省份(杨叶欣等,2010)。而后因食味不佳,遭弃养的福寿螺扩散到野外自然环境中,由于其生长迅速和适应能力强,目前已在南方大部分省(市)形成自然种群,严重危害作物生产。2003年,福寿螺被列入首批入侵中国的16 种外来物种名单(国家环保总局和中国科学院,2003)。
在自然水环境下,由于食物空间分布的不均匀及出现时间的季节差异,水生动物在其生活史中遭受饥饿胁迫的现象较为普遍(薛明等,2010)。近年来,有关福寿螺的研究主要集中在生物学特性、农业危害及防控等方面。其中,关于饥饿胁迫对福寿螺的影响亦有报道,如刚出生幼螺饥饿8 d 后的存活率在50%以上,14 d 后仍有1%的幼螺能够存活(谌江华等,2011);个体越小的福寿螺受饥饿胁迫影响越严重(董胜张和俞晓平,2011)。赵鑫等(2013)研究发现,福寿螺部分器官组织细胞在饥饿胁迫下会出现衰竭的情况,而关于饥饿胁迫对福寿螺器官组织造成损伤后的表观结构变化尚未见报道。为此,本研究通过扫描电镜技术,从组织学角度探析饥饿胁迫对福寿螺头部和肝脏表层结构的影响,并调查了福寿螺存活和产卵情况,以期为研究其生物入侵机制及防控策略提供一定的参考。
1 材料与方法
1.1 试验材料
于2012年10月初自华南农业大学校内农场水渠采集福寿螺个体,放入玻璃水缸中,每天投喂新鲜生菜,驯养15 d 后,选取表观正常、活力较强、体型较为一致、雌雄比为1:1 的福寿螺个体共180只,量取壳高[(31.35 ±0.10)mm,大小相当于成螺]后,于2012年10月22日开始试验。试验所用透明玻璃缸规格为47 cm ×27 cm ×39 cm,试验期间温度24 ~30 ℃。
1.2 试验方法
设置饥饿组和对照组2 个处理,每个处理均设3 个重复,每个重复用1 个玻璃缸,每缸放入雌雄福寿螺各15 只,共30 只。试验过程中玻璃缸保持水层为21 cm,使用曝气的自来水进行缸内换水,每天换水量为原水量的2/3,如有福寿螺死亡时,进行全量换水,以避免其影响其余福寿螺的正常生长。饥饿处理组不投喂任何食物,对照组每天投喂足量新鲜生菜。本试验共持续25 d,每天记录福寿螺死亡和产卵情况。
1.3 电镜扫描样品制备与观察
取25 d 后的饥饿组和对照组中的福寿螺各6 只(每个重复中取2 只),用镊子将福寿螺壳轻轻剥离,再用剪刀将头部和肝脏分离,经4%戊二醛固定液固定24 h,1%四氧化锇固定3 h 后,用0.1 mol·L-1磷酸缓冲液浸洗,30%、50%、70%、80%、90%、100%乙醇梯度脱水,乙酸异戊酯置换2 次,放入冷冻干燥仪二氧化碳冰点干燥(日本电子,型号JFD-310),然后用导电银胶将样品固定于样品台,用离子溅射仪喷钯金(日本电子,型号JFC-1600)。将样品置于XL-30ESEM 环境扫描电镜下观察头部和肝脏并拍照,加速电压为20.0 kV。
1.4 数据分析
采用SPSS 17.0 统计软件对饥饿组和对照组每天的死亡数和总产卵量进行t 检验。
2 结果与分析
2.1 饥饿对福寿螺存活和产卵的影响
图1显示,正常投喂下,福寿螺在第18 天时首次出现死亡,25 d 内平均每缸死亡0.67 只;而在饥饿处理下,25 d 内平均每缸死亡数量为2.00 只,与对照组差异未达到显著性水平(P >0.05)。同时,饥饿组在25 d 后存活率仍在90%以上,可见,福寿螺耐饥能力较强。此外,与对照组相比,饥饿组首次出现福寿螺死亡的时间提前(即在处理前5 d 内已有福寿螺死亡),两者死亡数量均随着处理时间的延长而逐步增多,但1 ~25 d 均未出现明显差异(P >0.05)。
福寿螺在食物缺乏的条件下,其产卵受到明显影响,平均每缸产卵量为4.00 块,显著低于对照组(24.33 块)(P <0.05)。饥饿处理前期(0 ~12 d),福寿螺的产卵量未受到明显影响,处理第12 天时,仍发现有福寿螺产卵的情况;之后产卵停滞,而对照组后期产卵量迅速增大,两者之间差异达到显著性水平(P <0.05)(图2)。
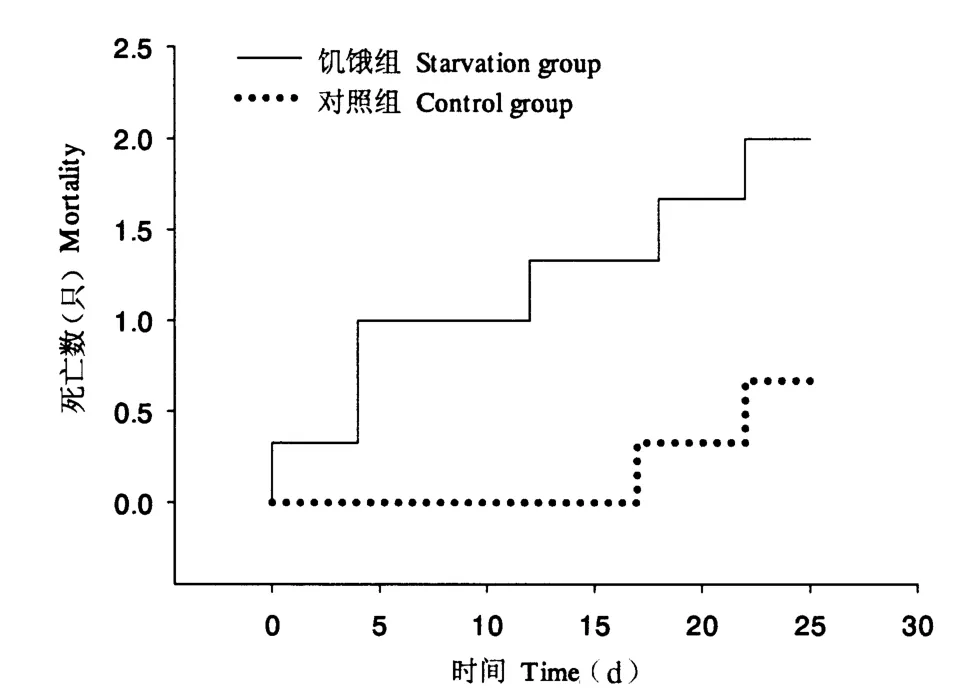
图1 福寿螺的死亡情况Fig.1 The mortality of P.canaliculata under control and starvation treatments
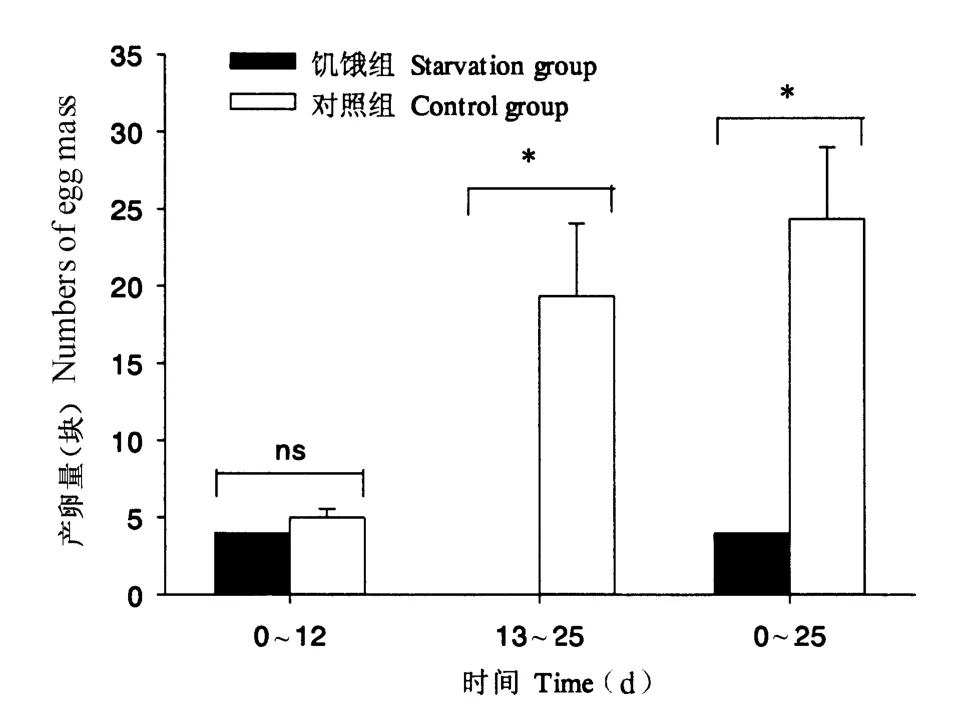
图2 福寿螺的产卵情况Fig.2 Mean numbers of egg mass of P.canaliculata under control and starvation treatments
2.2 福寿螺电镜扫描观察
2.2.1 头部 由图3A 和图3B 可知,在相同的电镜观察范围内,对于饥饿组,可同时观察到福寿螺头部的吻及其两边的触角,但在对照组中仅能见到福寿螺头部的吻(因其头部较大,其他部分分布于观察视野之外)。这意味着饥饿组福寿螺的头部要小于对照组,其原因可能是长期遭受饥饿,其头部逐渐出现整体萎缩的状况。同时,对照组头部表面肌肉排列有序,纹路清晰,有少许细小裂痕(图3C),且肌肉非常平整光滑(图3E);而饥饿处理组头部肌肉出现较大而清晰的裂痕(图3D),部分肌肉表面组织出现明显的杂乱无序状,呈现絮状物多层次堆叠现象,有明显的组织损伤(图3F)。
2.2.2 肝脏 扫描电镜观察结果显示,对照组福寿螺的肝脏饱满圆润,螺旋结构形态规整(图4A),且其表面平整(图4C),肝脏表面呈颗粒状的组织排列紧密,未见损伤(图4E);而饥饿处理组中福寿螺的肝脏整体有些变形,螺旋结构呈现松散状态(图4B),表面出现不规则的褶皱,部分地方出现杂乱絮状物(图4D),且部分组织结构断裂,有深浅不一的裂痕,絮状物呈现多层次无序堆叠,可见其表层组织受损严重(图4F)。
3 结论与讨论
3.1 福寿螺对饥饿胁迫的耐受性
食物是影响动物生长发育、存活、繁殖以及种群发展的必备要素(Rion & Kawecki,2007)。福寿螺在扩散过程中可能会遇到食物不足的环境条件,若其具有较强的耐饥能力,将有助于种群建立和快速扩散。董胜张和俞晓平(2011)研究发现,福寿螺在水族箱中饥饿25 d 后存活率在90%左右,且其耐饥能力随着温度(15 ~30 ℃)的降低而延长,最长生存时间为92 d。本研究也有类似发现,即在饥饿状况下福寿螺存活率达90%以上。研究表明,39%的福寿螺能持续饥饿42 d,少部分能存活140 d以上(Lach et al.,2000)。可见,福寿螺在饥饿条件下具有较高的存活率和较长的耐受时间。然而,福寿螺在饥饿胁迫下,生长繁殖活动会受到一定影响。饥饿程度越大,生长越慢,交配及产卵越容易受影响(Tamburi & Martín,2009)。本研究发现,饥饿组和对照组在25 d 内平均每缸产卵量分别为4.00 和24.33 块,两者差异显著,且饥饿组在饥饿12 d 后无产卵。
综上所述,在水稻生产过程中,可以通过栽培措施干扰或减少福寿螺的食物获取途径,进而在一定程度上降低福寿螺种群的增长速度与种群密度。例如,在水稻苗期采取旱直播方法,可减少福寿螺对秧苗的采食,进而减少其食物来源;在稻田休耕期间(即在秧苗移栽前或水稻收获后),及时清除田间绿色杂草,一方面可减少食物来源,另一方面可消除其藏匿场所,进而在一定程度上减轻福寿螺对下一季水稻的危害程度。
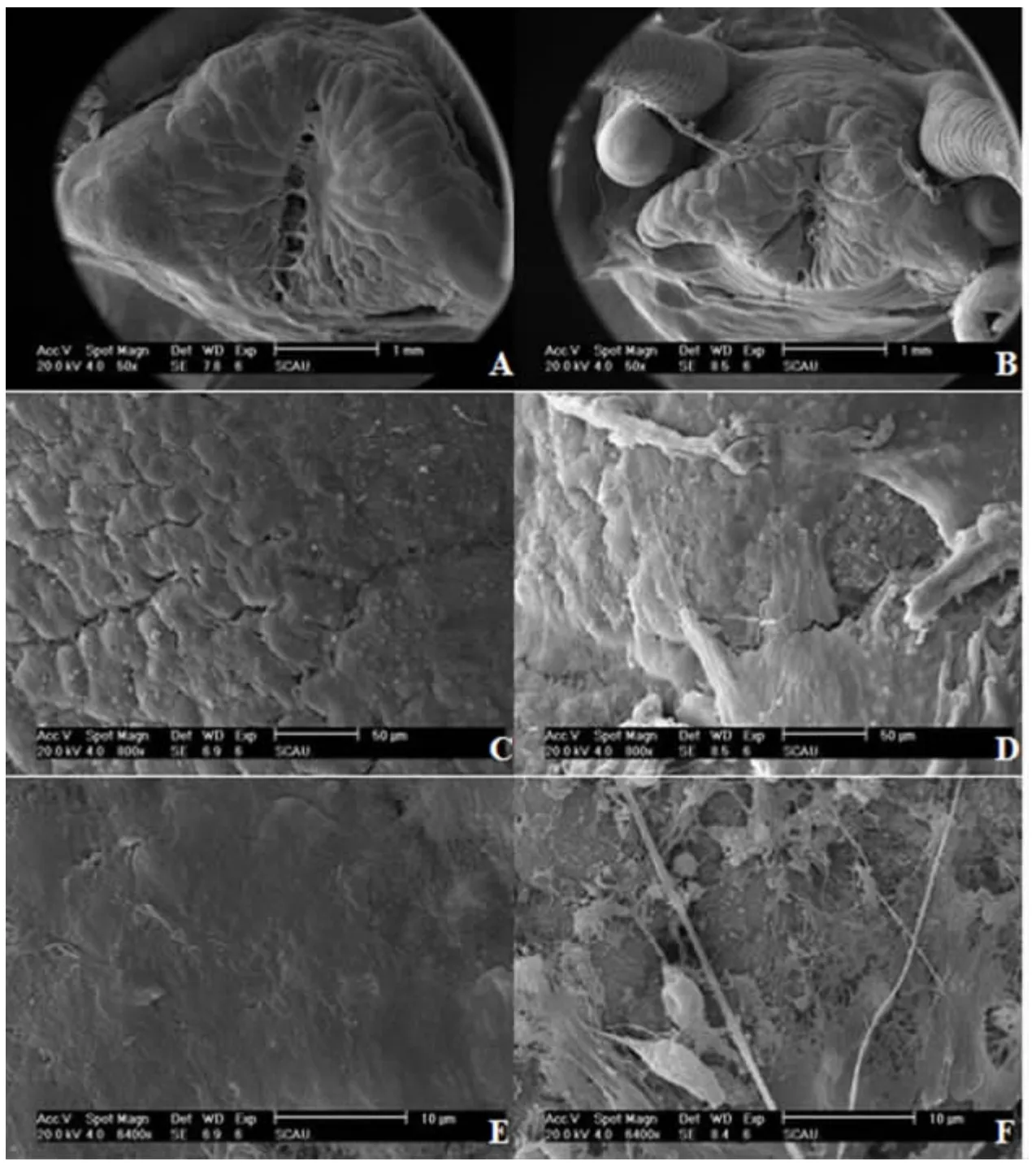
图3 福寿螺头部表面结构Fig.3 The surface of head of P.canaliculata
3.2 饥饿胁迫对福寿螺器官组织的损伤
研究发现,生物长期遭受饥饿会导致其免疫机能受到影响,自身免疫力下降(孙红梅等,2006)。同时,长期饥饿能对生物神经系统造成损害(陈代陆等,2001;陆之辉等,2010)。本研究发现,长期饥饿可导致福寿螺头部萎缩和损伤。福寿螺头部遍布着大量的神经元,神经系统的破坏会造成正常生理功能紊乱,头部的受损,最终将影响福寿螺的运动机能。因此,福寿螺在长期饥饿状态下,活动明显减少,甚至静止不动(赵鑫等,2013)。
本试验也发现,福寿螺在长期饥饿后,其肝脏的螺旋结构松散,且表面有侵蚀絮状损伤,并出现较大裂痕。肝脏的破损会导致一些酶的分解和合成发生障碍,进而造成福寿螺一些生理生化反应的紊乱(宋春秀等,2010)。同属水生动物的克氏原螯虾Procambarus clarkii Girard 肝脏在饥饿胁迫下会出现萎缩、分泌物减少、肝细胞中脂肪滴大量减少、细胞间隙增大、细胞内线粒体肿胀等情况(魏克强等,2010);饥饿后的犬齿牙鲆Paralichthys dentatus L.和银鲳Pampus argenteus Euphrasen 也出现肝细胞间隙增大、线粒体水肿等情况(徐善良等,2013;Bisbal & Bengtson,1995)。
赵鑫等(2013)研究发现,福寿螺在饥饿条件下,消化腺同样受到影响,主要表现在消化细胞的衰竭,胞浆颗粒化,甚至出现断层、破碎,直至消化细胞凋亡,但消化腺的衰退是一个可逆的过程。那么,对于饥饿条件下福寿螺头部和肝脏的表层损伤能否在恢复摄食后得到自我修复,尚需进一步研究。
陈代陆,夏正武,王振华.2001.长期饥饿应激对大鼠肠神经系统神经递质的影响.临床消化病杂志,13(5):195-196.
谌江华,姚冬明,刘芳睿,陈若霞.2011.福寿螺卵和幼螺抗逆性的初步研究.浙江农业科学,(4):902-905.
董胜张,俞晓平.2011.食物种类与饥饿胁迫对福寿螺生长发育的影响.生物安全学报,20(3):213-219.
国家环保总局,中国科学院.2003.中国第一批外来入侵物种名单.中华人民共和国国务院公报,(23):41-46.
陆之辉,张小平,程爱国.2010.完全饥饿大鼠肠神经及肠道动力学改变研究.解放军医学杂志,35(11):1367-1369.
宋春秀,章家恩,罗明珠,赵本良,何铭谦.2010.薇甘菊浸提液对福寿螺主要器官组织损伤的扫描电镜观察.生态环境学报,19(8):1876-1880.
孙红梅,黄权,丛波,吕大成.2006.饥饿对黄颡鱼免疫机能的影响.水利渔业,26(3):80-81.
魏克强,赵婷,王建军,宋欣.2010.饥饿胁迫对克氏原螯虾消化器官组织结构的影响.山西农业大学学报:自然科学版,30(6):519-523.
徐善良,邱成功,谷江稳,王丹丽.2013.银鲳(Pampus argenteus)幼鱼饥饿前后侧囊及肝脏超微结构的变化.海洋与湖沼,44(4):1016-1023.
薛明,柯才焕,魏永杰.2010.饥饿对方斑东风螺幼螺生化组成和消化酶活力的影响.热带海洋学报,29(3):120-125.
杨叶欣,胡隐昌,李小慧,汪学杰,牟希东,宋红梅,王培欣,刘超,罗建仁.2010.福寿螺在中国的入侵历史、扩散规律和危害的调查分析.中国农学通报,26(5):245-250.
赵鑫,吴帆,李海云,周结珊,赵永超,章家恩.2013.福寿螺消化腺的组织结构及其在饥饿状态下变化的研究.中国农学通报,29(23):21-26.
Bisbal G A and Bengtson D A.1995.Description of starving condition in summer flounder,Paralichthys dentatus,early history stages.Fishery Bulletin,93:217-230.
Halwart M.1994.The golden apple snail Pomacea canaliculata in Asia rice farming systems:present impact and future threat.International Journal of Pest Management,40:199-206.
Lach L,Britton D K,Rundell R J and Cowie R H.2000.Food preference and reproductive plasticity in an invasive freshwater snail.Biological Invasions,2:279-288.
Rion S and Kawecki T J.2007.Evolutionary biology of starvation resistance:what we have learned from Drosophila.Journal of Evolutionary Biology,20:1655-1664.
Tamburi N E and Martín P R.2009.Reaction norms of size and age at maturity of Pomacea canaliculata (Gastropoda:Ampullariidae)under a gradient of food deprivation.Journal of Molluscan Studies,75:19-26.

