霉酚酸酯对糖尿病大鼠肾组织中IGF-1、MMP-2表达的影响
李 敏,王建生,刘东伟
郑州大学第二附属医院肾内科 郑州 450014
随着许多发展中国家生活方式和饮食习惯的西化,糖尿病(diabetes mellitus,DM)及糖尿病肾病(diabetic nephropathy,DN)的发病率日趋升高,DN正成为发展中国家慢性肾脏病的主要病因。DN早期表现为肾脏体积增大、肾小球肥大和高滤过,其主要组织学改变是肾小球系膜基质增生、系膜细胞增殖、肾小球毛细血管袢及肾小管基底膜增厚[1-2]。基础研究[3-4]证实肾脏局部胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)积聚和基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)活性降低在肾小球系膜基质生成与降解失衡过程中起重要作用。霉酚酸酯(mycophenolate mofetil,MMF)是一种新型免疫抑制剂,已试验性的应用于DN的临床治疗,但确切机制尚不明确。作者观察了早期DM大鼠肾组织中IGF-1和MMP-2的表达情况,探讨MMF对DM大鼠肾脏的保护作用及可能存在的机制。
1 材料与方法
1.1实验动物SPF级SD雄性大鼠36只(由河南省实验动物中心提供),体质量200~220 g,实验过程中饲养于独立通气笼具中(河南省中医学院第二附属医院中心实验室),笼具内条件:温度(22±1) ℃,相对湿度(55±5)%,昼夜明暗交替。适应性喂养1周后进入实验。
1.2主要试剂与药品链脲菌素(STZ,美国Sigma公司),用前溶于0.01 mol/L枸橼酸缓冲液(pH=4.5)中;MMF(杭州中美华东制药有限公司)用前溶解于二甲基亚砜(美国Sigma公司)中,并用5 g/L羧甲基纤维素钠(天津市恒兴化学试剂制造有限公司)配至所需浓度;SP法试剂盒、二氨基联苯胺(DAB)显色试剂盒(北京中杉金桥生物技术有限公司);兔抗大鼠IGF-1、MMP-2多克隆抗体(美国Santa Cruz公司);辣根酶标记的山羊抗兔IgG(美国 Jackson公司);PVDF转印膜(美国Pall公司);ECL化学发光试剂盒(美国Pierce公司)。
1.3动物模型的建立及分组采用随机数字表法将实验动物随机分为对照组(n=12)和模型组(n=24),大鼠过夜禁食大于17 h,自由饮水,血糖仪(美国强生公司)测空腹血糖后,模型组以STZ 55 mg/kg一次性腹腔注射,对照组按体质量给予相当量枸橼酸缓冲液腹腔注射。48~72 h后测随机血糖,≥16.7 mmol/L为大鼠DM模型诱导成功[5-6]。模型组中3只大鼠血糖未达标,剔除后,按随机原则分为DM组(n=11)和MMF组(n=10)。每日8:00时MMF组给予MMF 15 mg/kg灌胃,对照组和DM组按体质量给予相当量溶媒灌胃。所有大鼠实验期间(8周)自由进食、饮水,不应用胰岛素。
1.4标本采集各组动物处死前置于代谢笼中,准确收集24 h尿液,测24 h尿蛋白、尿肌酐(全自动生化分析仪)。称体质量后戊巴比妥钠腹腔注射麻醉,腹主动脉取血,测血糖(强生血糖仪)、血肌酐(全自动生化分析仪),计算内生肌酐清除率(Ccr)。4 ℃生理盐水反复灌洗肾脏后,游离左肾,称质量,计算相对肾质量(左肾质量/体质量)。然后沿肾门纵向剖开,置于体积分数10%中性甲醛固定,梯度乙醇脱水,石蜡包埋。游离右肾,冰上取肾皮质切成小块,立即置于液氮中,再转入-70 ℃冰箱待测肾组织IGF-1、MMP-2。
1.5肾组织病理学观察石蜡切片(3 μm厚),常规脱蜡后,PAS染色,高倍镜下观察肾组织形态学改变。
1.6肾组织中IGF-1、MMP-2蛋白的免疫组化检测采用SP法。兔抗大鼠IGF-1、MMP-2多克隆抗体均按100倍稀释。德国Lecia显微照像系统采集图像,Biosens Digital Imaging System v1.6软件分析图像,每张切片高倍镜下测定20个视野,测定阳性区平均积分光密度值,取均值作为该切片的结果。
1.7肾组织中IGF-1、MMP-2蛋白的Westernblot检测称取100 g肾组织置于裂解液中冰上匀浆,超声粉碎,4 ℃ 12 000 r/min离心10 min,取上清,BCA法蛋白定量。取蛋白60 μg煮沸5 min,经120 g/L SDS-PAGE电泳后,转至PVDF膜,丽春红染色观察转膜效果,50 g/L脱脂奶粉室温摇床封闭1 h,加入兔抗大鼠IGF-1、MMP-2多克隆抗体(均按 1 000 倍稀释),4 ℃过夜孵育,TBST摇床洗膜10 min×3次,辣根酶标记的山羊抗兔IgG(按4 000倍稀释)杂交,室温孵育2 h,TBST摇床洗膜10 min×3次,暗室中加ECL发光剂,曝光、显影、定影,用图像分析系统对杂交信号进行光密度扫描,用Quantity One图像分析软件分析目标条带的光密度值。
1.8统计学处理采用SPSS 17.0进行分析,应用单因素方差分析和LSD-t检验比较各组大鼠生化指标、肾组织IGF-1、MMP-2蛋白表达的差异,应用Pearson积差相关系数分析24 h尿蛋白量与IGF-1、MMP-2蛋白表达量的相关性,检验水准α=0.05。
2 结果
2.1 3组大鼠一般状况及生化指标比较见表1。
2.2肾脏病理形态及免疫组化结果肾组织PAS染色显示,与对照组比较DM组肾小球体积增大,系膜区基质明显增生,肾小球毛细血管袢受压,基底膜增厚,MMF组较DM组有所改善(图1)。IGF-1、MMP-2免疫组化SP法染色示棕黄色或深棕黄色,在肾小球系膜区、基底膜及肾小管基底膜均有表达。IGF-1在DM组表达较对照组明显增加,MMF组较DM组下降;MMP-2在DM组表达较对照组下降,MMF组较DM组增加。见表2、图2。

表1 各组大鼠生化指标比较
*与对照组比较,P<0.05;#与DM组比较,P<0.05。

图1 各组大鼠肾组织病理结果(PAS,×400)

组别nIGF-1 MMP-2 对照组12103.28±11.67 167.56±14.04 DM组11165.26±18.65∗114.61±14.75∗MMF组10136.46±12.47∗#137.96±11.29∗#F67.96258.442P<0.001<0.001
*与对照组比较,P<0.05;#与DM组比较,P<0.05。
2.3肾组织中IGF-1、MMP-2蛋白的表达见表3、图3。

表3 各组大鼠肾组织中IGF-1、MMP-2蛋白的表达
*与对照组比较,P<0.05;#与DM组比较,P<0.05。
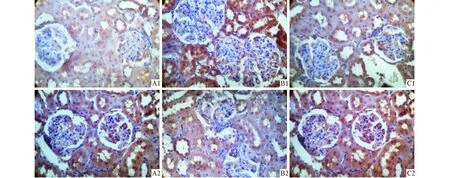
图2 各组大鼠肾组织IGF-1、MMP-2表达(SP,×400)

图3 各组大鼠肾组织中IGF-1、MMP-2蛋白的表达
2.4 24h尿蛋白量与IGF-1、MMP-2蛋白表达量的相关性24 h尿蛋白量与IGF-1相对表达量呈正相关(r=0.743,P<0.001),而与MMP-2相对表达量呈负相关(r=-0.756,P<0.001)。IGF-1与MMP-2呈负相关(r=-0.582,P<0.001)。
3 讨论
流行病学资料显示,DM是世界上大多数国家终末期肾病(ESRD)的最主要原因,但其确切发病机制仍不明确,代谢紊乱、血流动力学异常、氧化应激、炎症、遗传背景等多因素均参与其中[7]。因此,如何干预这些因素和延缓其发生、进展过程是治疗DN的关键。目前通过干预多种细胞生长因子、减少细胞外基质堆积成为DN治疗的新热点。
该研究中的免疫组化及Western blot检测均显示DM组IGF-1表达增加、MMP-2表达下调,推测IGF-1可能通过下调MMP-2,增加细胞外基质堆积,改变肾脏形态与功能,从而在DM肾脏损害过程中起作用。IGF-1作为一种细胞因子,可使大鼠系膜细胞增生,同时刺激系膜细胞合成大量Ⅳ型胶原等细胞外基质[8]。有研究[9]报道IGF-1在肾脏表达增加是导致STZ诱导的DM大鼠肾脏肥大和肾小球高滤过的原因之一,与DN的发生发展密切相关。细胞外基质的增生除与其合成增加有关外,还与其降解减少有关。MMP-2是降解Ⅳ型胶原的主要明胶酶,可以减少细胞外基质的沉积。该研究结果显示在DM大鼠肾组织IGF-1与MMP-2的表达呈负相关关系,二者与24 h尿蛋白分别呈现正相关和负相关关系,进一步证实了二者在DN进展机制中的作用。
MMF作为一种新型、高效的免疫抑制剂已成功应用于肾移植领域,近年来,随着对其药理作用的不断深入研究,MMF正逐步被应用于非移植肾脏疾病。MMF在体内代谢为霉酚酸(MPA),MPA通过抑制次黄嘌呤单核苷酸脱氢酶,耗竭细胞内的鸟苷酸池,干扰DNA的合成而发挥药理作用,可以高效抑制淋巴细胞增殖、巨噬细胞活化。国内外研究[10-11]发现,MMF可以通过抑制炎症细胞浸润对实验性DN发挥保护作用。MMF对DM大鼠肾脏IGF-1、MMP-2表达的影响国内外报道甚少。该研究结果显示MMF早期干预STZ诱导的DM大鼠,可使肾脏IGF-1表达减少、MMP-2表达上调,在病理上可见肾小球肥大、系膜细胞及细胞外基质增生情况均较DM组改善。推测MMF通过下调IGF-1表达和上调MMP-2表达,从而抑制系膜细胞的增殖和系膜基质的沉积。
综上所述,MMF对DN的保护作用可能部分与其减少IGF-1在肾脏的表达有关。随着实验的进展,将对其作用剂量和时效做进一步的分析及不良反应评估,以期为临床治疗DN提供新的思路和证据。
致谢:感谢赵瑛瑛、张文吉、张宛哲、孟晶茜、申鹏霄等老师在该研究的设计及实验阶段给予的支持和帮助,感谢河南省中医学院第二附属医院动物实验中心提供的标准化实验设施及高水波老师给予的悉心帮助!
[1]蔡广研,梁爽.临床指标判定糖尿病肾病诊断与预后价值及局限性[J].中国实用内科杂志,2012,32(6):405
[2]蔡明,王强,许亮,等.胰岛素体循环回流和胰液肠引流式胰肾联合移植手术技巧及围术期处理[J].解放军医学杂志,2011,36(12):1318
[3]Ji L,Yin XX,Wu ZM,et al.Ginkgo biloba extract prevents glucose-induced accumulation of ECM in rat mesangial cells[J].Phytother Res,2009,23(4):477
[4]Yokoi H,Mukoyama M,Mori K,et al.Overexpression of connective tissue growth factor in podocytes worsens diabetic nephropathy in mice[J].Kidney Int,2008,73(4):446
[5]吴文迅,陈香宇,王庆祝,等.糖尿病肾病大鼠肾脏组织中Ⅰ型1,4,5-三磷酸肌醇受体的表达[J].郑州大学学报:医学版,2011,46(2):195
[6]李治国,张浩军,焦亮,等.糖尿病肾病模型UCH-L1蛋白表达变化的研究[J].解放军医学杂志,2012,37(8):783
[7]刘芳,付平.我国糖尿病肾病的基础与临床研究——2007年河南郑州肾脏病年会热点回眸与展望[J].郑州大学学报:医学版,2008,43(1):14
[8]Isshiki K,He Z,Maeno Y,et al.Insulin regulates SOCS2 expression and the mitogenic effect of IGF-1 in mesangial cells[J].Kidney Int,2008,74(11):1434
[9]Levin-Iaina N,Iaina A,Raz I.The emerging role of NO and IGF-1 in early renal hypertrophy in STZ-induced diabetic rats[J].Diabetes Metab Res Rev,2011,27(3):235
[10]吕永曼,黄晓丽,易艳.霉酚酸酯对糖尿病大鼠肾间质细胞浸润及肾组织ICAM-1和MCP-1 mRNA表达的影响[J].中华肾脏病杂志,2006,22(9):576
[11]Kelly KJ,Dominguez JH.Treatment of the post-ischaemic inflammatory syndrome of diabetic nephropathy[J].Nephrol Dial Transplant,2010,25(10):3204

