板蓝根中多糖提取工艺的研究
张洪杰, 王广乐
(江苏科技大学 生物与化学工程学院, 江苏 镇江 212003)
板蓝根为常用中药材,多以菘蓝干燥根入药.目前全国所用的板蓝根分为两种:一种为十字花科植物菘蓝的根,在我国北方地区得到广泛使用,习称“北板蓝”.另一种为爵床科植物马蓝的根,在华南地区及西南大部分地区得到广泛使用,习称“南板蓝”.目前这两种商品不论在品种或质量上,都比较稳定[1].板蓝根具有味苦、性寒、归心等性质.现代临床广泛应用于预防和治疗各种病毒和细菌所引起的感冒发热、流脑、肝炎、肺炎、扁桃体炎、腮腺炎、急性眼结膜炎和疱疹皮炎等疾病.板蓝根具有较强的抗病毒活性,是公认的抗病毒中药,同时它还有抗菌消炎、免疫调节、抗内毒素、抗癌等作用[2].板蓝根的主要有效成分有:靛玉红、靛蓝、多糖、β-谷甾醇、Y-谷甾醇和精氨酸、谷氮酸等各种氨基酸.目前,人们认为具有治疗作用的活性成分主要存在于靛蓝、靛玉红和多糖中[3].多糖的提取一般是根据其溶解度的不同,选择不同温度、不同液料比的稀碱液、水作溶剂.现在人们逐渐将超声波提取、微波提取、离子交换色谱法和超临界流体萃取等应用于药用植物有效成分的提取中[4].
文中用水作提取剂,在单因素基础上,采用响应面法对浸提时间,温度和液料比工艺进行全面的研究,为提高板蓝根多糖的提取率,及其后期的开发应用提供参考依据.
1 实验
1.1 材料和试剂
板蓝根,购于南水桥药店,安徽产.
葡萄糖、苯酚、无水乙醇、浓硫酸、乙醚等均为分析纯.
1.2 实验仪器
DK-S28电热恒温水浴锅(上海精宏实验设备有限公司);FA2004电子天平(上海精密仪器制造厂);101A-2电热恒温鼓风干燥箱(上海市实验仪器总厂);VIS-723分光光度计(上海第三分析仪器厂);80-2B离心沉淀机(上海手术机械厂).
1.3 实验方法
1) 板蓝根粉末的预处理 首先采用索氏提取法乙醚回流2~3 h去除可溶性脂类,接着用80%乙醇回流2 h后过滤除去单糖和低聚糖,备用.
2) 显色液的配制 往50 mL浓H2SO4中缓慢加入10 mL蒸馏水,冷却至室温后加入0.6 g苯酚晶体,搅拌溶解,备用.
3) 板蓝根多糖的测定方法 称取一定量的已处理好的板蓝根粉末,用水作提取剂,在设定温度下提取一定时间,静止过滤,残渣洗涤2~3次,合并滤液,准确移取1.0 mL滤液于试管中,加25.0 mL蒸馏水稀释,作为测定液.移取1.0 mL测定液于干净比色管中,加入5.0 mL显色液,震荡混匀后放入沸水浴30~35 min,然后放入冷水浴中冷却至室温35 min后,以蒸馏水做空白参比液,于490 nm处测吸光度.
4) 标准曲线的绘制 准确称取100 mg葡萄糖,蒸馏水溶解后定容于100 mL容量瓶中,配成1 mg/mL的标准液.分别移取1.0,2.0,3.0,4.0,6.0,8.0 mL标准液至100 mL容量瓶中定容.分别移取上述溶液1.0 mL于10 mL比色管中,加5 mL显色液,震荡混匀,置于沸水浴中,加热30 min后冷却至室温.以蒸馏水做空白参比,于490 nm处测定吸光度,绘制标准曲线[5],可得回归方程:A=4.702 9C-0.000 3(C为葡萄糖浓度,mg/mL),R2=0.998 6.
5) 葡萄糖质量与提取率的计算
苯酚-硫酸法[5],以葡萄糖为基准物作标准曲线,根据标准曲线计算多糖含量.
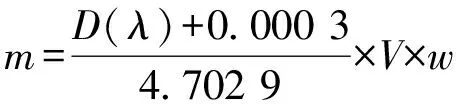
(1)
式中:m为多糖质量(g);D(λ)为样品溶液吸光度;V为过滤后体积(mL);w为稀释倍数.

(2)
式中:y为多糖提取率(%);m为多糖质量(g);M为原料质量(g).
6) 提取液波谱分析
准确称取5.0 g已处理好的板蓝根粉末,加150 mL蒸馏水,于90 ℃下水浴7 h后过滤,取1.0 mL滤液加25.0 mL蒸馏水稀释作为待测液.移取1.0 mL待测液于10mL比色管中,加5.0 mL显色液于沸水浴中煮30 min,取出冷却至室温,于450~550 nm范围内每隔10 nm测其吸光度,在490 nm处有最大吸收.
7) 显色稳定性实验
取0.04 mg/ mL的葡萄糖溶液于10.0 mL比色管中,加5.0 mL显色液,于沸水浴中煮30 min,取出冷却至室温,在490 nm下每隔5 min测一次吸光度,考察其显色稳定性(图1).

图1 显色稳定性实验Fig.1 Stability after color test
由图1可看出,样品在冷却后60 min内稳定性较好,其中20 min内吸光度逐渐增加,35 min后趋于稳定,因此实验最好在样品冷却至室温35 min后测定吸光度.
2 结果与分析
2.1 单因素实验
2.1.1 浸提时间对板蓝根多糖提取率的影响
准确称取5份5.0 g已处理好的板蓝根粉末于5个锥形瓶中,液料比为30 ∶1(mL/g),浸提温度为80 ℃,浸提时间分别设置为4,5,6,7和8 h,过滤,残渣洗涤2~3次,合并滤液,准确移取1.0 mL滤液于试管中,加25.0 mL蒸馏水稀释,测定相应吸光度.根据式(2)计算多糖提取率,考察浸提时间对多糖提取率的影响(图2).

图2 时间对多糖提取率的影响Fig.2 Effect of time on the extraction of radix isatidis polysaccharide
由图2可知,在一定范围内,随着浸提时间的延长,多糖提取率随时间的延长而增加;4~7 h内多糖提取率增加显著,7~8 h内多糖提取率增加趋势变缓.时间过长会使多糖的结构破坏,从而影响多糖提取率.
2.1.2 液料比对板蓝根多糖提取率的影响
准确称取5份5.0 g已处理好的板蓝根粉末于5个锥形瓶中,控制浸提时间为7 h,浸提温度为80 ℃,液料比分别设置为10 ∶1,20 ∶1,30 ∶1,40 ∶1和50 ∶1 mL/g,过滤,残渣洗涤2~3次,合并滤液,准确移取1.0 mL滤液于试管中,加25.0 mL蒸馏水稀释,测定相应吸光度.计算多糖提取率,考察液料比对多糖提取率的影响,结果见图3.
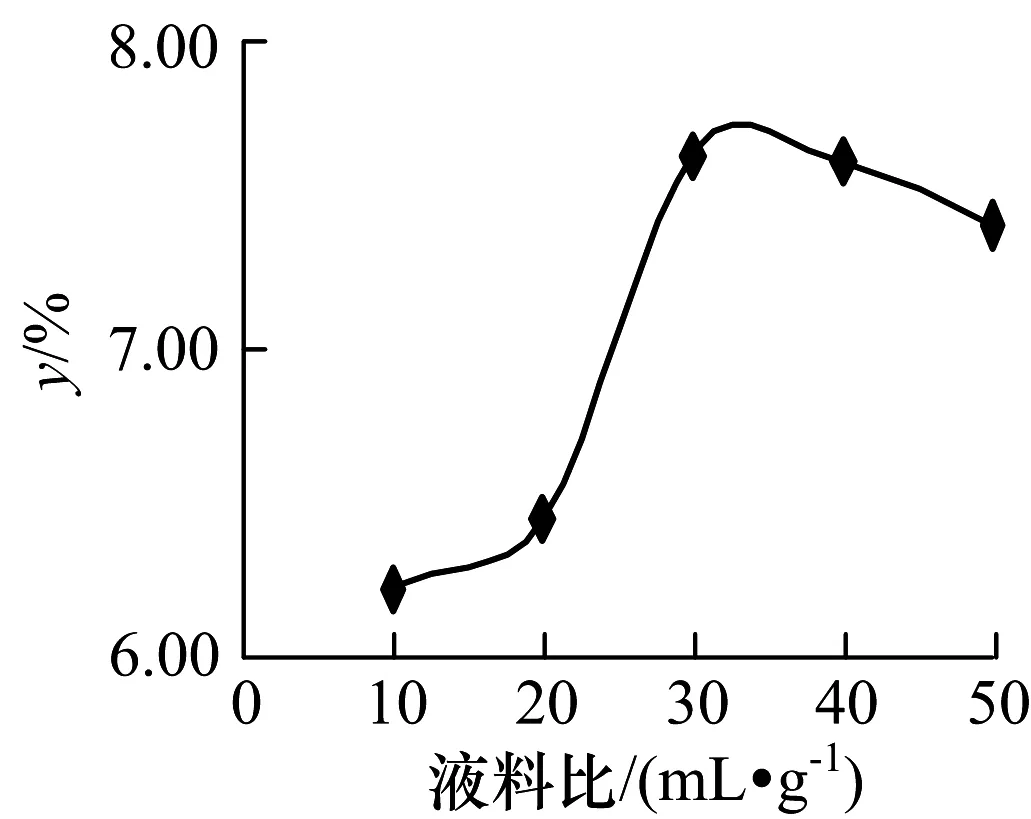
图3 液料比对板蓝根多糖提取率的影响Fig.3 Effect of liquid-solid ratio on extraction of radix isatidis polysaccharide
由图3可知:在浸提开始阶段随溶剂的增加,板蓝根多糖提取率增加,当液料比为30 ∶1时多糖提取率最大.当液料比大于30 ∶1(mL.g-1)时多糖提取率变化不明显,说明多糖已基本溶出.从节约能源角度考虑,选择较佳液料比30 ∶1.
2.1.3 浸提温度对板蓝根多糖提取率的影响
准确称取5份5.0 g已处理好的板蓝根粉末于5个锥形瓶中,浸提温度分别设置为60,70,80,90和100 ℃,设定液料比为30 ∶1 mL/g,浸提时间为7 h,过滤,残渣洗涤2~3次,合并滤液,准确移取1.0 mL滤液于试管中,加25.0 mL蒸馏水稀释,测定相应吸光度.计算多糖提取率,考察浸提温度对多糖提取率的影响(图4).

图4 温度对板蓝根多糖提取率的影响Fig.4 Effect of temperature on extraction of radix isatidis polysaccharide
由图4可知:在60~90 ℃范围内,随温度升高多糖提取率增加,这是由于温度升高分子热运动加快,多糖的溶出效果增强;但当温度达到100 ℃时多糖提取率又出现下降趋势,这是因温度过高,容易引起多糖的降解,从而导致多糖提取率下降.
2.2 响应面优化分析
2.2.1 响应面分析因素水平的选取
根据Box-Benhnken中心组合实验设计原理[6-9],综合2.1单因素实验结果,选取液料比、浸提温度、浸提时间对多糖提取率影响显著的3个因素,在单因素实验的基础上采用三因素三水平的响应面分析方法.实验因素与水平设计见表1.

表1 响应面实验因素与水平Table 1 Factors and levels of response surface(RS) test
2.2.2 响应面分析实验设计方案
以液料比(A)、浸提温度(B)、浸提时间(C)为自变量,以多糖提取率为响应值(Y),进行响应面分析实验.实验方案及结果见表2.
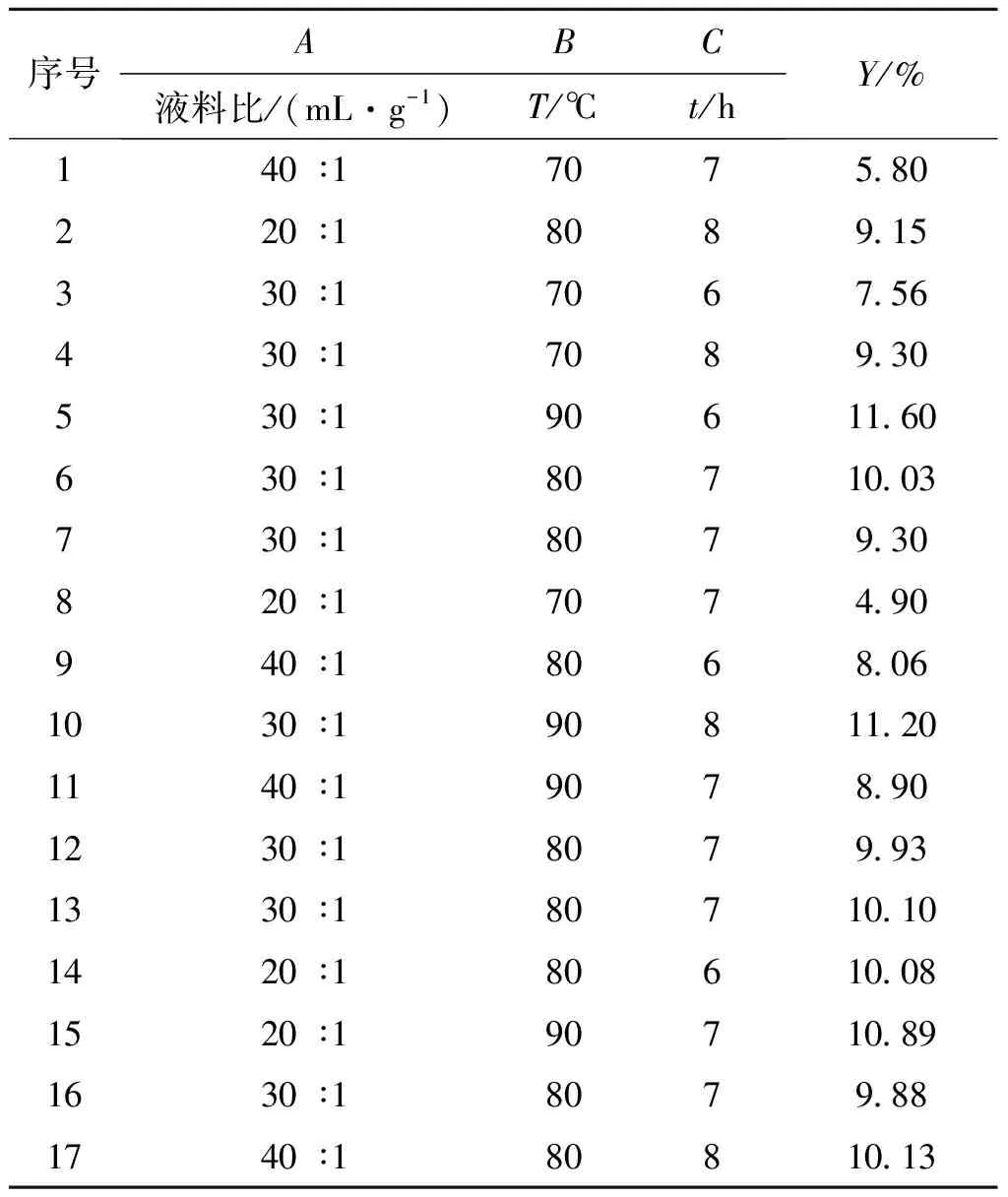
表2 响应面及实验分析结果Table 2 Results of the RS test
2.2.3 响应面方差分析
利用Design-Expert软件对表2实验数据进行多元回归拟合,得到各因素与多糖提取率的二次多项回归模型:Y=9.85-0.27A+1.88B+0.31C-0.72AB+0.75AC-0.54BC-1.39A2-0.83B2+0.90C2;运用响应面分析法对所建立的数学模型结果进行方差分析,回归分析结果见表3.

表3 回归分析结果Table 3 Statistical results of regression analysis
回归方程中各变量对指标(响应值) 影响的显著性是由F值来判定的,p越小,相应变量的显著性就越高.表3中模型的F值为23.21,p值为0.000 2,表明模型是非常显著的.失拟项不显著(p值0.103 1),说明该模型是合理的.由p值可知,各因素对提取率影响的大小顺序为:浸提温度>浸提时间>液料比.B,AB,AC,A2,B2和C2的p值小于0.05,对多糖提取率的影响显著.A,B,C的交互影响作用大小为AC>AB>BC.R2=0.967 6,则证明该模型可以解释96.76%响应值的变化,说明该模型拟合程度较好,可以用来分析和预测多糖提取率.
2.2.4 响应面分析结果绘制3D图
由图5可知,当液料比较低,浸提温度较高时,提取率较高,浸提温度和液料比相互影响明显;当液料比较大时,浸提温度升高,多糖提取率先增大后又有所减小.

图5 Y=f(A, B)的响应面和等高线Fig.5 Responsive surfaces and contours of Y=f(A,B)
由图6可知,多糖提取率随液料比的增大,先增加后减小,当浸提时间较短时多糖提取率变化显著,但随着浸提时间的延长,这种变化变得缓慢.液料比和浸提时间的交互作用显著.

图6 Y=f(A, C)的响应面和等高线Fig.6 Responsive surfaces and contours of Y=f(A,C)
由图7可知:在浸提温度较低时,随浸提时间的延长,多糖提取率有增大趋势;而当浸提温度较高时,多糖提取率随时间的延长,先减小后增大.
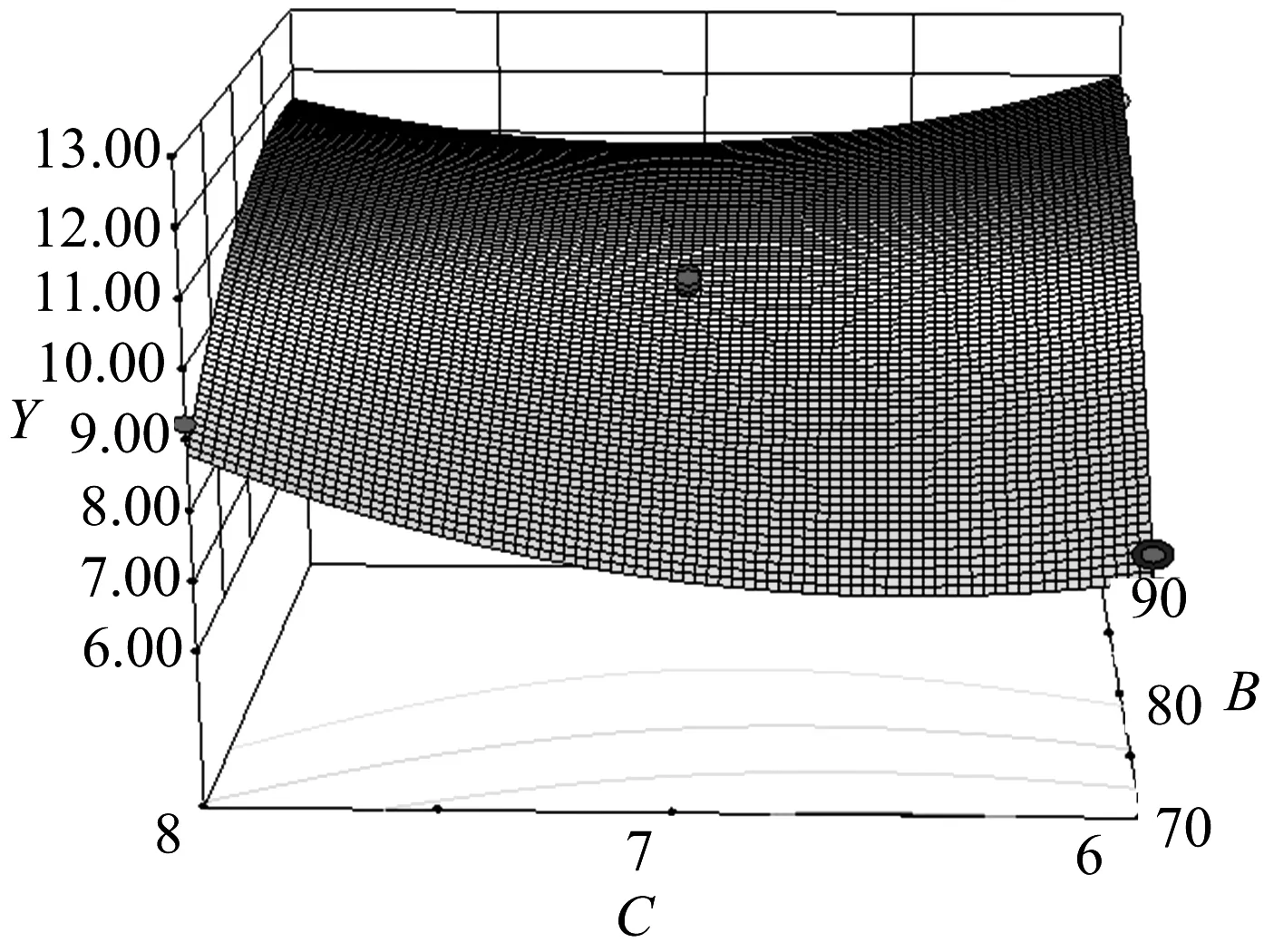
图7 Y=f(B,C)的响应面和等高线Fig.7 Responsive surfaces and contours of Y=f(B,C)
应用Design-Expert软件分析可知,最优条件为:浸提温度90 ℃、浸提时间6 h、液料比23.8 ∶1 mL/g,板蓝根多糖提取率为12.56%.根据实际调整: 浸提温度90 ℃、浸提时间6h、液料比24 ∶1 mL/g.验证实验得出实际提取率为11.92%,与理论值的误差为0.64%.由此可知,响应面优化板蓝根多糖提取工艺参数准确,具有实际可操作性.
3 结论
1) 各因素对多糖提取率影响的大小顺序为:浸提温度>浸提时间>液料比.
2) 最佳提取工艺条件为:浸提温度90 ℃、液料比24 ∶1 mL/g、浸提时间6 h,在此条件下多糖提取率最高,达到11.92%.实际提取率与理论值相差较小,说明该模型能够很好地预测实验结果,可以简单快速地用来设计和分析各种与此相关的实验.
参考文献(References)
[1] 楼之岑,秦波.常用中药材品种整理和质量研究:1册[M].北京:北京医科大学、中国协和医科大学,联合出版社,1995:303-306.
[2] 孙小兵,盛家荣,王定培.南板蓝根化学成分及药理作用研究[J].广西师范学院学报:自然科学版,2008,25(4):66-69.
Sun Xiaobing, Sheng Jiarong, Wang Dingpei.Research progress of chemical constituents and pharmacological activities for baphicacanthus cusia (Nees) bremek[J].JournalofGuangxiTeachersEducationUniversity:NaturalScienceEdition,2008,25(4):66-69.(in Chinese)
[3] 国家药典委员会.中华人民共和国药典〔S〕一部[G].北京:化学工业出版社,2000,490-491.
[4] 车荣珍,吴艳,艾连中,等.超声波辅助提取板蓝根多糖的工艺优化[J].时珍国医国药,2011, 22 (10):2498-2501.
Che Rongzhen, Wu Yan, AI Lianzhong, et al.Optimization of ultrasonic-assisted extraction process of polysaccharides from indigowoad root[J].LishizhenMedicineandMateriaMedicaResearch,2011, 22 (10):2498-2501.(in Chinese)
[5] 徐光域,颜军,郭晓强,等.硫酸—苯酚定糖法的改进与初步应用[J].食品科学,2005,26(8): 342-346.
Xu Guangyu,Yan Jun,Guo Xiaoqiang,et al.The Betterment and apply of phenol-sulphate acid method[J].FoodScience, 2005,26(8): 342-346.(in Chinese)
[6] Lee W C,Yusof S,Hamid N S A, et al.Optimizing conditions for enzymatic clarification of banana juice using reponse surface methodology(RSM)[J].JournalofFoodEngineering, 2006, 73(1):55-58.
[7] Muralidhar R V, Chirumamil R R, Marchant R, et al.A response surface approach for the comparison of lipase production by candida cylindracea using two diffrent carbon sources[J].BiochemicalEngineeringJournal, 2001, 9(1): 17-21.
[8] Wu Yan, Cui Steve W, Tang Jian, et al.Optimization of extraction process of crude polysaccharides from boat-fruited sterculia seeds by response surface methodology[J].Foodchemistry, 2007, 105(4): 1599-1602.
[9] 朱方明,马新,张安强,等.响应面法优化超声波提取北沙参多糖的工艺研究[J].食品科技,2011, 36(7):153-156.
Zhu Fangming, Ma Xin, Zhang Anqiang, et al.Optimization of ultrasound-assisted extraction of radix glehniae polysaccharides using response surface methology[J].FoodScienceandTechnology, 2011, 36(7):153-156.(in Chinese)

