低强度激光和有氧运动对大鼠围绝经期骨结构和骨代谢的影响
覃飞,张馨蕾,阮洋,刘云,肖万方,张二磊,郝选明
(华南师范大学 体育科学学院,广东 广州 510006)
骨质疏松症(Ostcoporosis,OP)是一种以骨量减少、骨组织微观结构破坏,导致以骨脆性增高和骨折危险性增加为特征的系统性、全身性骨骼疾病。国际骨质疏松基金会的统计数据显示,骨质疏松症目前危害着全球大约1/3的50岁以上女性和1/5的50岁以上男性,已成为一个全球性的公共卫生问题。女性骨质疏松症多发于围绝经期(绝经期前一年及后一年这一时间区间)。由于卵巢功能下降,雌激素减少,骨质丢失速度呈指数增加,每年可达1%~5%,尤其在绝经后3年内丢失最多,且主要影响松质骨(如脊柱、股骨远端等)[1]。药物防治会导致经济负担增加而且治疗周期长,带来的副作用往往不易为患者所接受。因此,利用非药物手段治疗和预防围绝经期骨质疏松,探索安全、方便和经济的治疗方式具有十分重要的现实意义。
低强度激光(Low level laser,LLL)可产生某种类似超声波、针灸等物理因子的生物刺激效应,且对生物组织不会造成不可逆性损伤。目前已有一些研究表明,低能量激光治疗可以活化成骨细胞[2],促进骨修复[3]。因此,本研究通过建立围绝经期自然生长大鼠模型,试图通过研究运动与低强度激光对围绝经期大鼠骨密度、骨结构、骨生物力学性能和骨代谢的影响,探索防治绝经后骨质疏松更为安全有效的方法。
1 材料与方法
1.1 模型构建与分组
SPF级雌性SD大鼠(8周龄,体重(220±20) g,许可证号:SCXK(粤)2008-0020,广州中医药大学实验动物中心)30只。正常喂养12个月,每周监测体重及健康状况,直至达到14月龄,体重(340±20) g,采取阴道脱落细胞涂片HE染色法连续观察3个动情周期(15 d),并通过尾部静脉取血收集大鼠血清,检测血清E2含量[4]。以阴道细胞学表现为动情周期紊乱、动情间期延长者及血清 E2含量显著低于其年轻分泌水平者为围绝经期大鼠模型建立成功。造模过程中2只死亡,4只未达到上述评价标准。将24只造模成功的大鼠,随机分为模型对照组(C)、单纯运动组(E)、激光治疗组(L),“运动+激光”组(E+L),每组6只。
1.2 运动方案
造模成功后,运动组大鼠适应性训练1周后,正式开始下坡跑台运动训练,速度15 m/min,跑道倾角-5°,隔天训练一次,每次运动2组,每组15 min(组间休息5 min),持续8周[5-6]。
1.3 低强度激光治疗
参考Júlia S等治疗方案,进行8周低强度激光治疗(GaAlAs,激光波长810 nm,光斑直径4 mm),隔天照射大鼠双侧股骨颈前、后、内侧、外侧4个照射点(无麻醉,手握制动,照射光纤接触皮肤),每个照射点30 s (50 mW,11.94 J/cm)[7]。激光联合运动干预组,激光治疗后30 min进行跑台运动。
1.4 主要仪器及试剂
双能 X线骨密度测试仪(GE,美国,暨南大学附属第一医院核医学科);酶标仪(PE VICTOR3,美国);LD-1型半导体激光治疗仪(GaAlAs,激光波长810 nm,光斑直径4 mm,广州市激光技术应用研究所);石蜡包埋机、脱水机、染色机、石蜡切片机(LEICA,德国);显微镜(Olympus,日本);生物复合材料试验系统(MTS 858,MTS Systems Corporation,美国,南方医科大学临床解剖学研究所);雌二醇(E2)ELISA试剂盒(越研生物,上海);抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,STR-ACP)(南京建成);碱性磷酸酶(alkaline phosphatase,AKP)(南京建成)。
1.5 检测指标及方法
1)雌激素水平测试。
将收集的全血室温静置后,3 000 r/m in离心20 min,分离血清,-80 ℃保存。采用ELISA法检测血清E2含量。具体步骤严格按照试剂盒说明书进行操作。
2)骨密度测量。
每只大鼠实验干预前后接受两次双能X线全身骨密度扫描,运用乙醚麻醉大鼠使其保持不动,检测完毕后,同一操作者使用小动物测量专用分析软件画出相应感兴趣区(左右股骨),最终得出全身、左右股骨骨密度。
3)骨形态结构观察。
将剔除肌肉、筋膜的大鼠股骨快速称重、测量后,放入质量分数为 10%中性甲醛溶液固定 24 h后置于EDTA脱钙液中(每2 d换一次EDTA),约5周完成脱钙。随后将标本流水冲洗,沿股骨长轴正中剖开,常规乙醇梯度脱水,石蜡包埋,平行股骨长轴连续切片(5 µm),制作股骨头、股骨颈和股骨干整体切片。HE染色,中性树脂封片,镜下观察骨髓腔、骨小梁变化,显微镜每张切片中骨小梁随机采集 10个视野,运用Imagepro plus软件进行骨小梁面积定量分析。
4)三点弯曲试验。
剔除大鼠股骨主要肌肉,灭菌,喷洒生理盐水后以纱布包裹,装入冻存管液氮保存待用。实验前将标本室温自然解冻,放在MTS 858生物复合材料试验机上进行股骨三点弯曲实验,所有数据均由机器自带软件自动记录,加载速度 v=1 mm/min,最大加载位移Smax=3.5 mm,跨距25 mm。
5)骨代谢相关指标测试。
取出-80 ℃大鼠血清,严格按照试剂说明书检测碱性磷酸酶(AKP,比色法)及抗酒石酸酸性磷酸酶(STR-ACP,比色法)。
1.6 数据统计学处理
所有数据用平均数士标准差(x±s)表示,用SPSS Statistics 17.0统计软件进行统计处理;实验前后比较采用配对样本t检验,组间比较采用单因素方差分析(one-way ANOVA),显著性水平取P<0.05。
2 结果及分析
2.1 大鼠血清E2质量浓度
模型对照组治疗周期前后,血清 E2质量浓度显著降低(P<0.01),其余 3组(单纯运动组、激光治疗组、运动+激光组)E2质量浓度显著升高(P<0.01),且运动、运动+激光组升高幅度均大于激光治疗组。治疗结束后,激光治疗组(P<0.05)、单纯运动组(P<0.01)、运动+激光组(P<0.01)血清E2含量均显著高于安静对照组(见表1)。
表1 各组大鼠干预前后血清E2质量浓度 ng/L
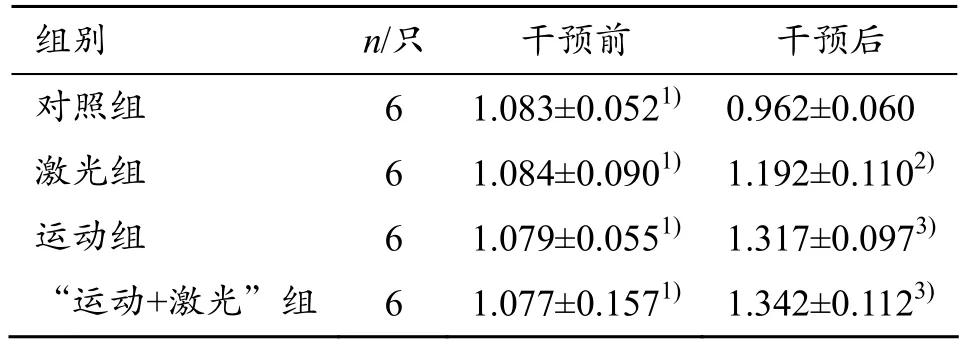
表1 各组大鼠干预前后血清E2质量浓度 ng/L
1)与干预后比较,P<0.01;2)与安静组比较,P<0.05;3)与安静组比较,P<0.01
组别 n/只 干预前 干预后对照组 6 1.083±0.0521) 0.962±0.060激光组 6 1.084±0.0901) 1.192±0.1102)运动组 6 1.079±0.0551) 1.317±0.0973)“运动+激光”组 6 1.077±0.1571) 1.342±0.1123)
2.2 大鼠骨密度测试
对照组干预前后股骨、全身 BMD均极显著降低(P<0.01),其余治疗组(单纯运动组、激光治疗组、“运动+激光”组)股骨、全身BMD均显著升高(P<0.01),其中运动组股骨BMD升高幅度最大,“运动+激光”组全身 BMD升高幅度最大。干预治疗结束后,运动组、“运动+激光”治疗组股骨BMD均显著高于安静对照组(P<0.01)、(P<0.05)。单纯运动组、激光治疗组、“运动+激光”组全身BMD显著升高(P<0.05)(见表2)。
表2 大鼠股骨及全身BMD g/cm2
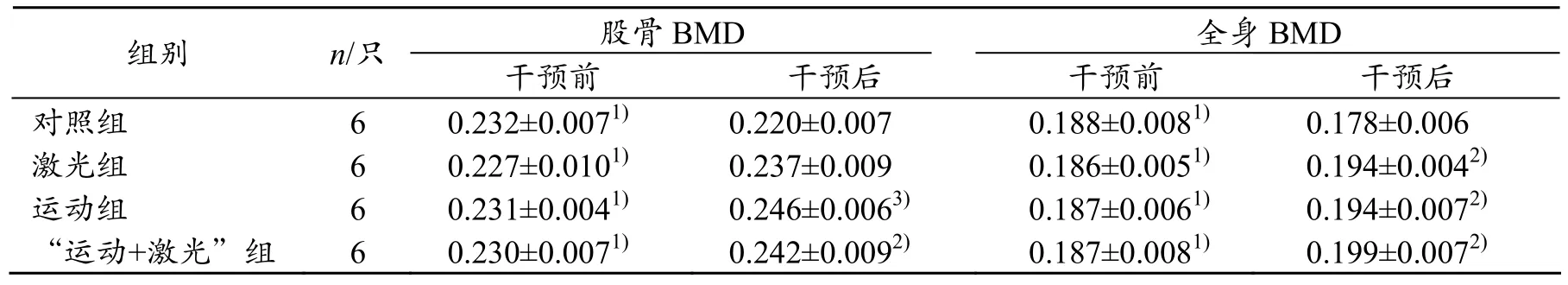
表2 大鼠股骨及全身BMD g/cm2
1)与干预后比较,P<0.01;2)与安静组比较,P<0.05;3)与安静组比较,P<0.01
组别 n/只 干预前 干预后 干预前 干预后股骨BMD 全身BMD对照组 6 0.232±0.0071) 0.220±0.007 0.188±0.0081) 0.178±0.006激光组 6 0.227±0.0101) 0.237±0.009 0.186±0.0051) 0.194±0.0042)运动组 6 0.231±0.0041) 0.246±0.0063) 0.187±0.0061) 0.194±0.0072)“运动+激光”组 6 0.230±0.0071) 0.242±0.0092) 0.187±0.0081) 0.199±0.0072)
2.3 大鼠股骨HE染色组织学观察
对照组(C组)骨小梁明显减少、变细,部分小梁中断且逐渐被吸收;拱桥形结构变薄、塌陷,骨小梁间隙明显加宽,骨髓腔增大,出现大片无骨小梁骨髓区。骨小梁附近及表面可见破骨细胞增生活跃。其余3组:单纯运动组(E组)、激光治疗组(L组)、“运动+激光”组(E+L组)骨小梁较粗大,小梁连接点较多,可见拱桥形结构呈圆形、卵圆形或梭形紧密排列,可见较多的成骨细胞排列在骨小梁表面(见图1)。运用IPP软件分析骨小梁面积发现(见图 2):激光治疗组(P<0.05)、单纯运动组(P<0.01)、“运动+激光”组(P<0.01)骨小梁面积均显著高于对照组且“运动+激光”组骨小梁面积显著高于激光治疗组(P<0.05)。
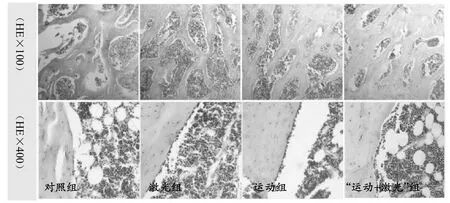
图1 大鼠股骨组织形态学观察

图2 各组大鼠股骨骨小梁面积
2.4 大鼠股骨生物力学指标
如图 3所示,激光治疗组(L组)、单纯运动组(E组)、“运动+激光”组(“E+L”组)与对照组(C 组)相比股骨最大载荷均增大,且运动+激光组具有显著性差异(P<0.05)。
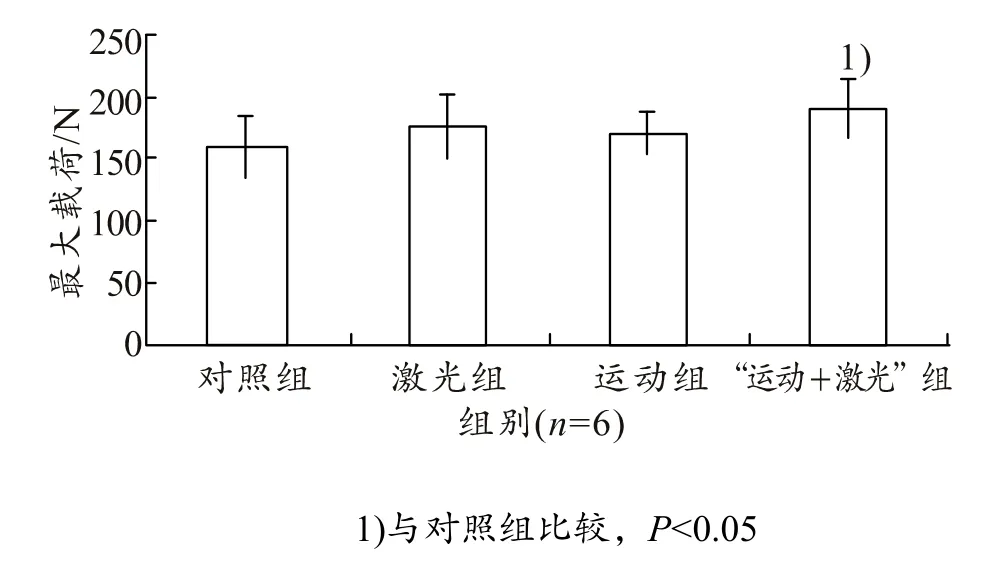
图3 各组大鼠股骨最大载荷变化量
2.5 大鼠血清STR-ACP及AKP酶活性
运动组(E组)血清AKP显著高于(P<0.01)安静对照组(C组)、激光治疗组(L组)、运动+激光组(“E+L”组)。3个干预组血清 STR-ACP均下降,但无显著性差异(P>0.05);运动组、“运动+激光”组血清STR-ACP与AKP比值较之对照组极显著降低(P<0.01)。
表3 各组大鼠血清中AKP、STR-ACP 酶活性

表3 各组大鼠血清中AKP、STR-ACP 酶活性
1)与对照组比较,P<0.01;2)与激光组比较,P<0.01;3)与运动组比较,P<0.01
组别 n/只 AKP活性/(U·L-1) STR-ACP/(U·L-1) STR-ACP活性/AKP活性对照组 6 102.46±16.14 4.72±0.59 0.046±0.0057激光组 6 105.53±14.07 4.24±0.60 0.040±0.0053运动组 6 141.66±8.991)2) 4.38±0.88 0.031±0.00861)“运动+激光”组 6 117.74±14.213) 3.95±0.77 0.034±0.00881)
3 讨论
3.1 有氧运动及激光治疗对大鼠骨密度的影响
骨矿密度(Bone mineral density,BMD)是骨矿代谢中骨的量化标准,是骨骼强度的重要指标之一。BMD对于早期诊断骨质疏松十分重要,当 BMD低于某一范围时就会产生临床上所表现的骨质疏松,骨折的危险性提高。大量临床调查显示,围绝经期妇女 BMD呈指数下降,骨质疏松患病率呈高发趋势。本实验通过对各组围绝经期大鼠施加8周的跑步运动和/或低强度激光照射干预前后进行全身骨密度追踪测试,结果发现:单纯运动组(E组)通过8周中等强度下坡跑后,股骨BMD与对照组(C组)相比极显著提高(P<0.01),增加效果优于激光治疗组(L组)和“运动+激光”组(“E+L”组),但全身骨密度提高幅度低于其他2种干预方式。动物跑台运动主要为四肢运动,在应力作用下可促进矿物质在四肢的沉积,因此大鼠肢体的 BMD增加效果显著,而躯干等其他部位所承受的应力较小,BMD没呈现出大幅度增加。上述结果提示我们在运动过程中应兼顾不常锻炼的部位,才能达到运动提高全身BMD的最佳效果。
激光治疗组(L组)大鼠的股骨和全身BMD与干预前相比均显著增加,且8周干预后全身BMD明显高于对照组。其机制可能与低强度激光引发细胞低水平活性氧功能改变和成骨细胞的基因表达改变有关。有研究表明,活性氧可提高破骨细胞的活性,促进成骨细胞凋亡和直接参与骨有机质的降解[8]。Timon Liu[9]报道激光照射可调节细胞活性氧的水平和MAPK活性。这种在激光照射部位的各种细胞中产生的活性氧状态改变,可能参与了本研究中围绝经期大鼠的良好骨代谢效应机制。另外,有学者构建cDNA微点阵以鉴定低强度激光处理后成骨细胞的基因表达型,结果发现多个直接或间接的在提高细胞增殖和抑制细胞凋亡中起作用的基因上调,与抗氧化、能量代谢和呼吸链相关的基因上调[10]。这些发现为我们进一步研究低强度激光调节围绝经期大鼠骨代谢中的机制指出方向。值得注意的是,激光治疗组全身 BMD提高明显,其效果与运动干预组、“运动+激光”组没有显著性差异。提示我们局部激光照射可能通过促进全身体液循环,加速矿物质及其相关物质的代谢与吸收,或者同时通过其他机制促进矿物质在骨骼中的沉积。Hentschke VS[11]在研究中也提出通过局部的激光照射可达到身体其他部位的治疗效应。这种激光产生的良好效应,可以用来治疗和预防长期卧床和围绝经期妇女的骨质疏松症。本实验组中“运动+激光”组与干预前相比,股骨和全身BMD均显著提高(P<0.05),但3种干预方式(运动、激光、“激光+运动”)对于股骨和全身骨密度的影响,并没有呈现出显著性的差异,说明运动和低强度激光干预均能显著抑制围绝经期女性的骨量大幅度丢失,但运动和低强度激光并没有呈现明显的叠加效应,其机制需要在进一步的研究中加以探讨。
3.2 有氧运动及激光治疗对大鼠骨结构、骨生物力学性能的影响
骨质由骨密质、骨松质和骨髓腔组成。骨密质在所有骨质外表面,由规则紧密排列的骨组织构成。骨松质由很多针状或片状的的骨小梁构成,骨小梁呈拱形结构排列是骨承重的重要保证。对骨结构来说,承受压应力的能力最强,而承受剪应力和拉伸应力的能力较弱。骨小梁的拱结构恰好能使剪应力转化为压应力,使骨处于理想应力环境中[12]。本实验通过股骨HE染色观察各组形态学结构发现,围绝经期大鼠股骨的主要变化为骨小梁结构及数目的变化。对照组(C组)骨小梁明显减小并变细,部分小梁中断且被吸收,拱桥形结构变薄、塌陷。骨小梁数目减少、质量下降将导致骨承重能力下降和脆性增加。骨小梁拱形结构的破坏说明骨无论是轴心受力还是偏心受力都容易发生“失稳”状态,因而导致骨折危险度增加。本研究的干预疗程结束后,运动、激光、“运动+激光”3组大鼠的骨小梁数目、结构均有明显改善,成骨细胞在骨小梁表面排列趋于紧密,其中以“运动+激光”组(“E+L”组)效果最佳。
骨生物力学特征直接反映骨的内在质量和性能,它与骨量、骨体积、皮质骨厚度和松质骨小梁结构数目有密切关系,是对骨形态结构的综合反映[13]。其中最大载荷大小反映骨骼在外力负荷作用下的可塑性。本实验各组大鼠股骨生物力学测试结果的比较表明,围绝经期大鼠的骨拮抗变性和抗破坏能力下降,骨的硬度和韧性发生改变,是骨质疏松的表现。而3个干预组的股骨最大载荷均增大,其中“运动+激光”组差异具有显著性(P<0.05)。结合上述骨量和骨结构的统计结果,我们发现3组不同干预手段其骨量、骨结构和骨的力学性能变化并非完全同步。提示,骨量并不能完全反映骨的稳定性和强度,而骨性能好坏,应全面考虑各种因素。其中,骨的微结构(骨小梁拱形结构)、骨胶原纤维量及排列情况对于决定骨骼强度也起着重要的作用[14]。因此围绝经期女性在预防和治疗骨质疏松症的过程中,应选择多种有效的干预方式,全面提升自身骨骼的质量和性能。
3.3 有氧运动及激光治疗对大鼠血清E2质量浓度及骨代谢指标的影响
性激素在围绝经期骨质疏松症发病机制中发挥重要作用。冯利等[15]研究表明:围绝经期骨质疏松症,是由于卵巢功能的衰退,导致神经-内分泌-免疫系统功能改变。其中,E2水平下降导致下丘脑垂体-性腺轴生殖内分泌紊乱是引起围绝经期代谢变化和临床病症的主要原因。本实验通过测试干预前后大鼠血清E2质量浓度发现,随着围绝经期进程的发展,安静对照组E2水平逐渐下降(P<0.01),而其他施加干预的3组,E2水平不同程度的增高,其中运动组和“运动+激光”组升高效果优于激光组。卜淑敏等[16]的研究结果为解释这一差别提供了一定的线索,缺乏运动可导致皮下脂肪或腹腔内脂肪中 17ß-类固醇脱氢酶增加,进而增加睾酮含量,导致E2合成通路障碍。其他学者12个月的临床随机实验亦表明,运动可以降低超重绝经后妇女循环血液中的睾酮水平,提高E2水平[17]。因此运动这一干预因素对提高围绝经期女性E2质量浓度具有很好的作用。
骨形成的相对减弱和骨吸收的相对增强,即二者的偶联障碍可导致骨质疏松的发生[18]。血清碱性磷酸酶(AKP)主要由肝脏和成骨细胞合成,对于肝功能正常的机体,血液中AKP升高主要是由代偿性骨形成增强所引起,因此,血清AKP是最常用的评价骨形成和骨转换的指标,是反映成骨细胞活跃程度的生物标志物之一[13]。抗酒石酸酸性磷酸酶(STR-ACP)在骨吸收时对骨基质的溶解起重要作用,可作为反映破骨细胞活性和骨吸收情况的重要指标。本研究结果显示:运动组血清AKP显著高于安静对照组、激光治疗组、“运动+激光”组。运动组、“运动+激光”组、激光组的血清STR-ACP较之对照组虽有所降低但无显著性差异。运动组、“运动+激光”组的STR-ACP与AKP比值极显著低于安静对照组(P<0.01),提示运动组、“运动+激光”组的骨代谢平衡呈现良好的转变。以上研究结果说明,运动这一干预手段可有效促进骨形成过程,致使围绝经期成骨与破骨之间的平衡发生有益的改变,有效预防和延缓骨质疏松的发生。同时,“运动+激光”联合干预亦可以有效改善围绝经期成骨与破骨之间的平衡。而单纯低强度激光干预后,大鼠血清AKP、STR-ACP及其比值与对照组相比虽有改善但无显著性差异,这可能是由于治疗周期短,未能达到理想的光应答效应。
[1] 蔡大可. 丽安康的药学及治疗围绝经期骨质疏松症的药理研究和安全性评价[D]. 广州:广州中医药大学,2010.
[2] 李秋实,陈英新,周延民,等. 低能量激光治疗对成骨细胞的生物效应研究进展[J]. 中国激光医学杂志,2011,20(5):328-332.
[3] Pires-Oliveira D A,Oliveira R F,Amadei S U,et al.Laser 904 nm action on bone repair in rats with osteoporosis[J]. Osteoporos Int,2010,21(12):2109-2114.
[4] 刘冬岩. 养肝和血复方对雌性初老大鼠血清性激素及抑制素B的影响[D]. 太原:山西医科大学第二临床医学院,2009.
[5] 马涛,李世昌,梁晓霞,等. 上、下坡跑台运动对去卵巢小鼠骨密度及骨组织形态计量学指标的影响[J]. 体育科学,2011,31(1):48-55.
[6] Bedford T G,Tipton C M,Wilson N C,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures[J]. J Appl Physiol,1979,47(6):1278-1283.
[7] Diniz J S,Nicolau R A,de Melo Ocarino N,et al. Effect of low-power gallium-aluminum-arsenium lasertherapy(830 nm) in combination with bisphosphonatetreatment on osteopenic bone structure:an experimentalanimal study[J].Lasers Med Sci,2009,24(3):347-352.
[8] Altindag O,Erel O, Soran N, et al. Total oxidative/anti-oxidative status and relation to bone mineral density in osteoporosis[J]. Rheumatol Int,2008,28(4):317-321.[9] Timon Chengyi L I U,Ruochun L I U,Ling Z H U,et al. Homeostatic photobiomodulation[J]. Front Optoelectron,2009,2(1):1-8.
[10] Yamamoto M,Tamura K,Hiratsuka K,et al.Stimulation of MCM3 gene expression in osteoblast by low level laser irradiation[J]. Lasers in Medical Science,2001,16(3):213-217.
[11] Hentschke V S,Jaenisch R B,Schmeing L A,et al.Low-level laser therapy improves the inflammatory profile of rats with heart failure[J]. Lasers Med Sci,2012(8):103-112.
[12] 袭世静. 正常股骨头骨小梁的拱结构特征及其生物学意义[J]. 中华外科杂志,1991,29(8):487-488.
[13] 李世昌,季浏,刘体伟,等. 不同方式运动对去卵巢大鼠骨密度、骨生物力学及代谢指标的影响[J].体育学刊,2012,19(2):132-137.
[14] 谢斌,陈允震,刘海春,等. 骨胶原在骨质疏松中的作用[J]. 中国老年学杂志,2009,16(2):2057-2059.
[15] 冯利,葛嘉峰,孟晓润,等. 坤宁安对去势雌性大鼠血清生殖内分泌值含量影响的实验研究[J]. 中医药信息,2000(4):63.
[16] 卜淑敏,陈永杰,王颖捷,等. 中等强度跑台运动对去卵巢大鼠骨量和相关血清性激素水平的影响[J]. 中国老年学杂志,2010,20(2):342-344.
[17] M cT iernan A,Tworoger S S,Rajan K B,et al.Effect of exercise on serum androgens in postm enopausalw om en: a 12-m onth random ized clin ical tr-ial1J21Cancer[J]. Epdemiol Biomarkers Prev,2004,13 (7):1099-1051.
[18] 邝志强,张荣华. 运动联合福善美对去卵巢大鼠骨密度和神经传导的影响[J]. 中国病理生理杂志,2012,28(6):342-344.

