绝经女性体力活动特征及其与骨量关系的研究
郑陆 陈晓红 周志雄 崔玉鹏 叶鸣 谢海霞 王永升
首都体育学院(北京 100191)
研究表明,废用或骨骼失去负荷刺激导致骨量减少,而运动通过施加机械负荷刺激将有效增加骨量[1,2],因此,运动在预防和改善骨质疏松中的作用日益受到关注。运动有利于成年期骨量保持,减少随年龄增长的骨丢失[3,4],但对绝经女性骨骼的影响效应尚存在一定争议,总体认为,其延缓骨量丢失的效应优于提高骨量的效应,有利于预防和改善绝经后的骨质疏松,降低骨折风险[5-7]。
另一方面,随着年龄增长,人体整体机能水平降低,能量代谢减弱,机体体力活动水平下降,因而能耗减少[8-10],机体能量代谢呈现正平衡,并继发向中性及全身脂肪增加,导致较高的患病率和死亡率[11]。据报道,中年期经常进行体力活动者和日均能耗较高的老人,寿命相对较长[12-14]。 因此,绝经女性有必要通过增加身体活动或适度运动增加机体能耗。此外,随着年龄的增长,瘦体重降低[15],通常有骨量丢失[16],也制约机体活动或运动[17,18]。 那么,绝经女性身体活动特征与骨量是否有关?健骨锻炼(健骨操)对绝经女性骨量的影响效果如何?本研究以北京市骨量低下的绝经女性为对象,探讨健骨操运动对骨量低下绝经女性骨量的影响效应;分析日常活动特征、能量消耗、体成分及骨密度 (Bone Mineral Density,BMD)等的变化特点,探讨体力活动与机体骨量变化的关系及其机制。
1 对象与方法
1.1 研究对象
实验时间为2010年4月~2011年12月。以北京市东城、西城、崇文、宣武、石景山、海淀等的主要社区中45~62岁绝经女性为对象,在问卷调查基础上,进行骨强度检测,初步筛选出428名备选者。经对428名备选者一对一的详细问诊,排除高血压、糖尿病、心脏病、甲状旁腺功能亢进症和活跃肾结石疾病等严重慢性疾病,以及有重大妇科疾病手术、运动障碍、近两年来服用过影响内分泌和骨代谢的药物史等对象,并据中国人种特点(BMD对应的T≥-1.0为骨量正常;-1.0 > T >-2.0 为骨量减少;T ≥-2.0 为骨质疏松[19]),选出符合骨量减少标准且自愿参加健骨操运动的受试者24人作为运动组(exercise group,EG组),同时挑选23人作为骨量减少对照组(osteopenia group,OG组)。受试者签署知情同意书,实验期间,研究方为EG组购买1年期意外伤害保险。两组受试者年龄、身高、体重、绝经年限及全身骨密度 (TBBMD)等各项指标均无显著性差异 (P>0.05),见表1。
表1 受试者基本资料(±s)
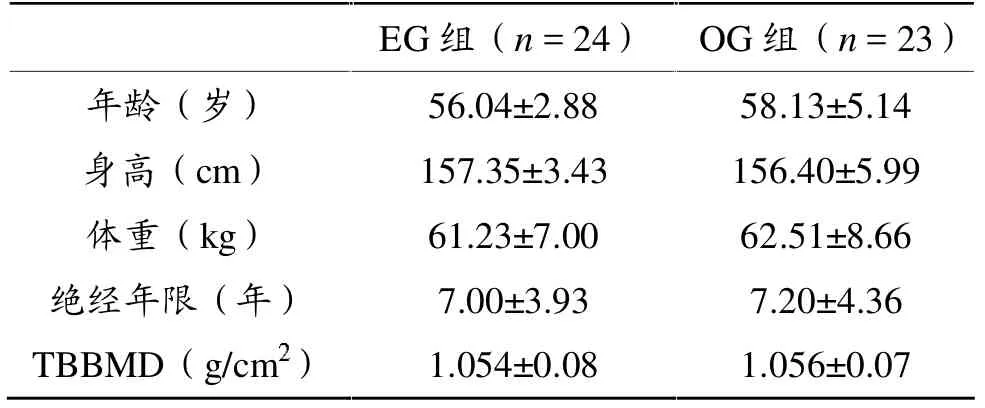
表1 受试者基本资料(±s)
EG??n = 24? OG??n = 23????? 56.04–2.88 58.13–5.14???cm? 157.35–3.43 156.40–5.99???kg? 61.23–7.00 62.51–8.66??????? 7.00–3.93 7.20–4.36 TBBMD?g/cm 1.054–0.08 1.056–0.07
1.2 实验方法
1.2.1 健骨操运动及测试
健骨操运动分为:准备活动12 min、正课36 min和整理活动12 min。准备活动为热身运动,主要包括颈椎活动、振臂、肩环绕、体侧运动、体转运动、体前屈、扩胸运动、手足运动、大步快走等;正课为有氧耐力运动、抗阻运动和冲击性有氧力量运动,主要包括翻手腕、拉手腕、大字站、后抬腿勾脚尖、手平举慢蹲起、旱地划船、旱地仰泳、十点十分操、跳跃动作等;整理活动为拉伸练习,主要包括拍打、大步慢走等放松性练习。
由于加速度计未将EG组各种形式活动或运动予以细化区别,故对健骨操运动的负荷强度及时间进行了测评[20]。采用德国 CORTEX-MetaMax 3B 便携式心肺功能遥测仪测试EG组进行健骨操运动时的负荷强度,计算运动强度及能耗。
全部锻炼均在社区健身教练示范和专人指导下进行,本项目组成员全程跟踪。同时制定考勤制度,实行监管,保证出勤率。每周运动3~4次,每次60 min左右。本实验测试工作在首都体育学院“运动机能评定与技术分析”北京市重点实验室完成。本实验时间为2010年4月~2011年12月。
1.2.2 指标测试
能量消耗测试:测定在2011年5月份一个月内完成。采用日本OMRON公司hja-350it三轴感应加速度计,测试所有受试者1周体力活动和能量消耗。OMRON加速度计自动记录并显示各项能量消耗及1~8 MET 强度活动时间(表2),其中,3MET 以下活动均默认为生活方式能耗,3MET以上活动均为步行能耗(WEE)。每日能量消耗中,总能耗为体力活动与基础代谢能耗之和,体力活动能耗是步行能耗与生活方式能耗之和。测试仪器统一佩戴在受试者右髋部,除游泳、洗澡外,全程佩戴仪器。
身体形态指标测试:分别于实验前和1年后(即实验开始时和结束时)测定受试者身高、体重(BW),并计算身体质量指数 BMI= 体重 /身高(kg/m2)。
BMD和体成分测试:分别于实验前和1年后,采用美国GE公司Lunar Prodigy双能X线骨密度测试仪测试受试者腰椎 2-4(L2-4)、股骨颈(FN)、股骨近端 (FP)和全身 (TB)BMD以及瘦体重百分比(PBM)、体脂百分比 (PBF)。骨密度仪的精度误差(CV):L2-4为 0.93%,FN 为 0.79%,TB 为 0.66%。
肌肉力量测试:分别于实验前和1年后,采用德国ISOMED2000等速肌力测试仪测试受试者髋部和腰部肌肉峰力矩和相对峰力矩。
1.3 统计学分析
采用SPSS16.0软件进行描述性统计分析,各测试指标以均值±标准差表示;对实证研究的各类指标进行正态性检验,数据不符合正态分布,故组间差异采用Independent-Samples t检验,组内差异性采用Paired-Samples t检验,相关分析采用Spearman积差相关分析。
2 结果
2.1 每日体力活动能耗
表2显示,EG组步行、体力活动及总能耗三项均显著高于OG组。两组受试者日均能量消耗差异主要由步行能耗导致。EG组基础代谢能耗高于OG组,但无显著差异。
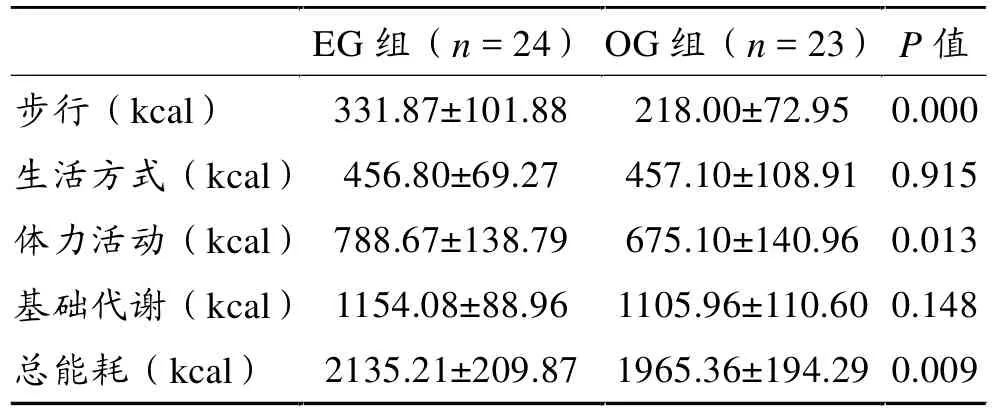
表2 两组受试者每日能量消耗比较
表3显示,两组受试者活动步数、步行时间及3-6 MET活动时间差异显著。EG组3 MET及以上强度运动时间占总运动时间的12.74%,高于OG组。
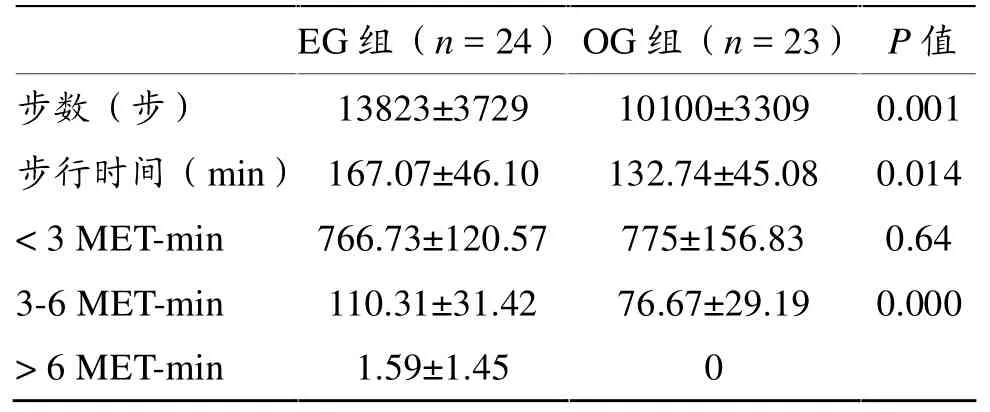
表3 两组受试者每日活动状况比较
2.2 健骨操测试结果
共17人参加健骨操测试,结果为:平均HR为(117.59±9.41)bpm,HRmax 为 (165.12±9.26)bpm,VO2为(19.94±6.88)ml/kg/min,运动时间为(52.88±1.89)min,METmax 为(5.70±1.97),能耗为(312.07±94.20)kcal,强度为(52.94±8.56)%VO2max。
将健骨操运动强度和时间与BMD进行相关分析,结果(表4)显示,运动时间与 L2-4、FNL及 TB 的BMD显著相关。运动强度(摄氧量)与TBBMD负相关。运动时间及强度对骨代谢均有影响。
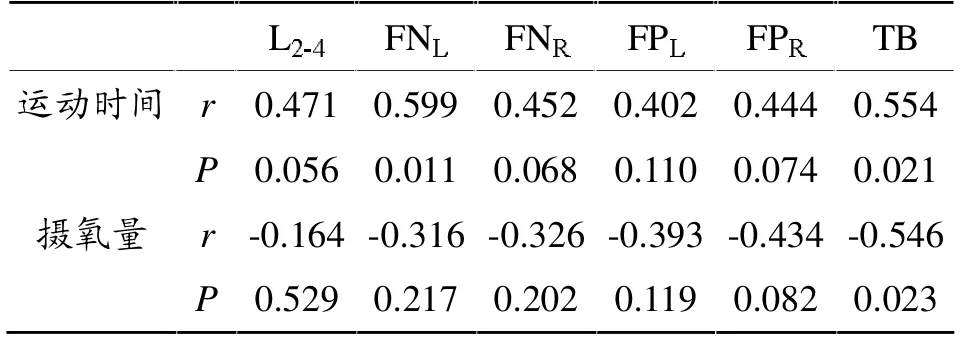
表4 运动组进行健骨操运动的强度和运动时间与BMD的关系(n=17)
2.3 BMI和体成分
表5显示,EG 组运动 1年后,BW、BMI、PBF 及PBM较运动前均发生了显著变化,BW、BMI和PBF显著降低,PBM显著升高,而肌肉含量(BM)变化无统计学意义。OG组实验1年前后,自身比较各项指标均无显著改变,但实验1年后,OG组BW、BMI、PBF均显著高于EG组。
由表6可见,两组受试者BW及体成分指标均与全身BMD显著相关,其中PBM与全身BMD显著负相关。
2.4 BMD
表7显示,自身比较,实验1年后EG组各主要部位BMD较实验前均呈升高趋势,FNL的升高有统计学意义。OG组各主要部位BMD较1年前均呈现降低趋势, 其中,L2-4、FNL、FNR和 TB 的差异具有统计学意义。实验1年后两组比较,除FPL外,EG组受试者各主要部位BMD均高于OG组,差异有统计学?意义。

表5 两组受试者1年前后BMI和体成分的变化
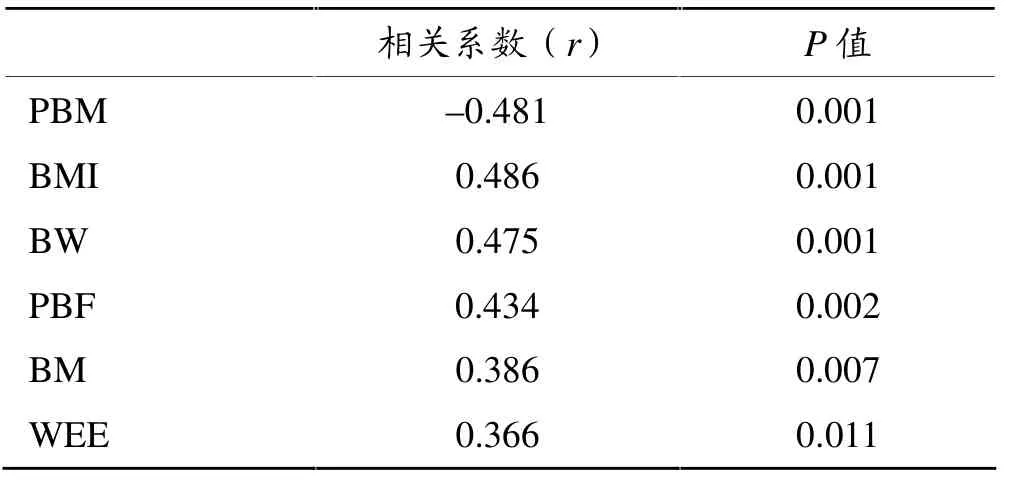
表6 两组受试者全身BMD与体重、BMI及体成分指标的相关性分析(n=47)
2.5 肌力
表8显示,自身比较,实验1年后EG组肌力较实验前发生显著变化,其中,髋等速 90°伸(Hie-90)、髋等速 180°屈(Hif-180)、髋等速 180°伸(Hie-180)及腰等速 120°屈(Dif-120)肌力均较 1年前明显升高。OG组肌力亦发生显著变化,Hif-180及Hie-180肌力均较1年前明显降低。两组受试者腰等速120°伸(Die-120)、腰等长 15°屈(Dimf-15)及腰等长 15°屈相对肌力(Dimf-15/W)均无明显改变。实验1年后, EG 组 Hif-180、Hie-180 及 Die-120 肌力均显著高于 OG 组, 而 Hie-90、Dif-120、Dimf-15 及 Dim f-15/W两组间无明显差异。
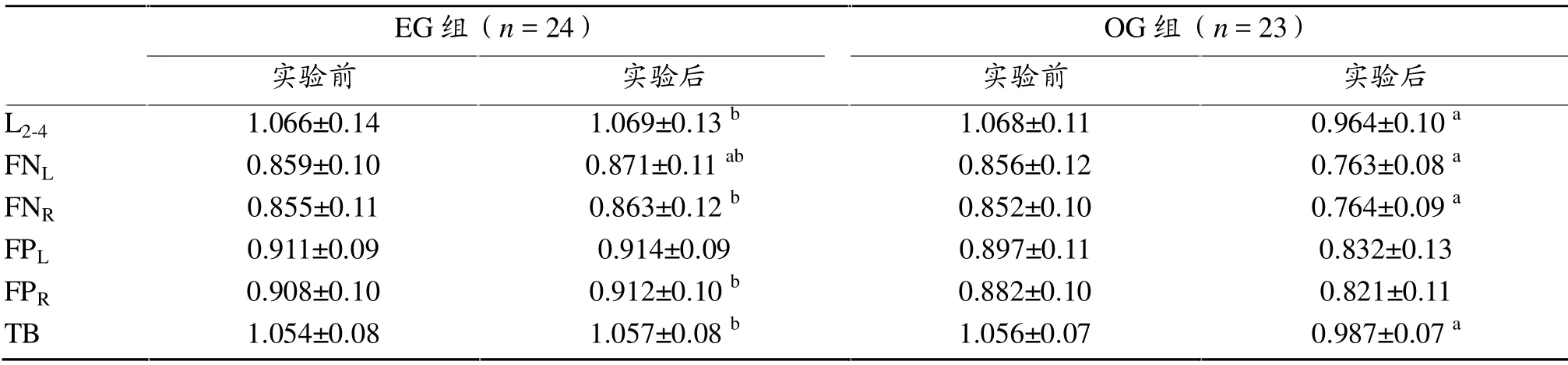
表7 两组受试者1年实验前后各部位BMD比较(g/cm2)
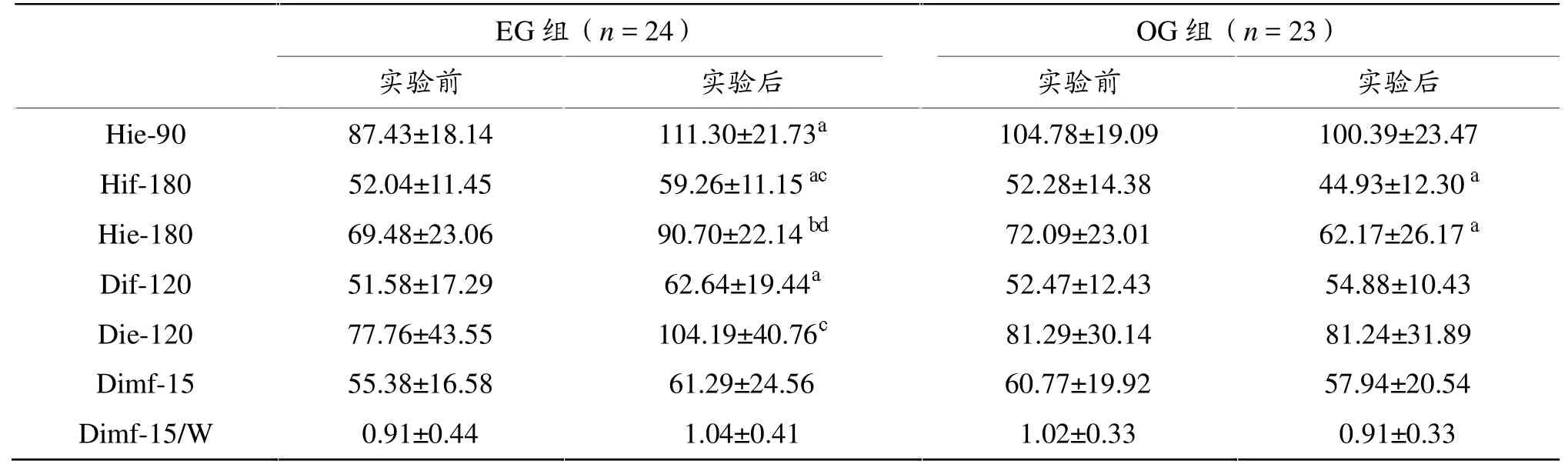
表8 两组受试者1年实验前后肌力比较
3 讨论
3.1 受试者日常体力活动特征分析
正常体重受试者(BMI 为 18.5~25 kg/m2)随年龄增加,体力活动水平和总能量消耗逐渐降低。体力活动水平(总能耗与静态能耗之比)由20岁的1.75下降到90岁的1.28,总能量消耗每10年下降约150 kcal,而食物热效应则无相应的变化[21]。本研究受试者BMI处于正常范围,采用OMRON加速度计记录受试者每日各种体力活动的情况,该加速度计将3MET强度以下活动均归为“生活方式”范畴,而“步行”活动为 3 MET 及以上强度活动[22,23],两组受试者日均活动时间为:3 MET强度以下EG组为766.73 min,OG 组为 775 min;3-6 MET 强度 EG 组为 110.31 min,OG 组为 76.67 min,分别占每日总活动时间的12.74%和9%;仅EG组有6 MET强度以上活动,为1.59 min。EG组3-6 MET强度活动时间显著长于OG组。3-6 MET属中等强度,故本研究中,EG组日均中等强度活动(包括运动)时间显著长于OG组。
分析每日能量消耗可知,总能耗 (total energy expenditure,TEE)为体力活动能耗(physical activity energy expenditure,PAEE) 与基础代谢能耗(basal metabolism energy expenditure,BMEE) 之 和 ,PAEE是步行与生活方式能耗之和。OMRON加速度计的能耗记录已经删去了食物特殊动力作用的额外能量,因此,体力活动部分测值基本满足PAEE=[TEE(0.9)-BMEE][24]。 本研究中,两组受试者生活方式能耗接近,分别为 456.8 和 457.1 kcal;EG 组的BMEE略高于OG组,但亦无显著差异;EG组步行、体力活动及总能耗三项均显著高于OG组。可见,两组受试者日均能量消耗差异主要由活动能耗造成,特别是步行能耗。EG为期1年的健骨操运动能耗也包括其中。因此,步行活动能耗(WEE)应视为受试者的有效体力活动能耗。OG组WEE显著低于EG组,表明该组活动程度低,其日均WEE仅为675.10 kcal,即通过有效肌肉收缩对机体施加的负荷刺激相对较小。推测低于675.10 kcal的日均有效体力活动能耗可能将影响维持骨量所需的负荷刺激,导致机体相应骨骼受力点因承受负荷减少产生破骨漂移和骨量减少。因此,体力活动能耗与骨量密切相关,这也是EG组骨量高于OG组的决定因素。
3.2 运动强度、运动时间及运动方式对骨量的影响
研究认为,BMD是诊断骨质疏松的金标准[25],也是预测骨折风险的最好指标[26,27]。运动强度、时间及负荷形式对BMD均有显著影响。中等强度活动(运动)有益于中老年人健康已成为共识[28,29]。 对于骨代谢平衡而言,合理有效的运动增加对骨骼的机械刺激,提高骨代谢水平。合理有效的健骨运动应满足以下条件:中等强度有氧运动[30];抗重力和阻力运动[31,32];具有一定冲击性的运动[33,34]。 本研究中,OG 组受试者由于缺乏运动,每日3 MET以上强度的活动显著低于EG组,对骨形成的刺激效应明显不足,中高强度活动较少可能是该组骨量低下的重要因素。
骨质疏松症多发于绝经后2年,也有发生于绝经后5~10年。绝经后的头3年,女性骨量每年以2.5%的速率递减,之后每年减少 0.75%~1%[35]。 本研究中,两组受试者绝经年限基本一致,均处于绝经后骨量递减的年龄阶段,OG组受试者1年中TBBMD显著降低,符合绝经后骨量随年龄增长而自然递减的规律,而EG组历经1年中等强度健骨操运动后,尽管自身1年前后比较仅有左股骨颈BMD测定值显著升高,但机体各部位BMD(除FPL外)与OG组相比均显著升高。健骨操平均强度为中等运动强度,并包括有氧耐力、抗阻及较高冲击性练习、柔韧及平衡练习等综合内容,基本满足绝经女性健骨运动的负荷要求。因此,每周3~4次、每次60 min左右、持续1年的健骨操运动,对维持和增加骨量具有较好的效果,是EG组受试者整体BMD水平优于OG组的根本原因。
3.3 体成分与BMD关系
研究表明,体重较大者BMD水平较高,因而BMD 与体重高度相关[36,37]。体重能够解释 BMD 大约30%的变异[38]。而体重由各种体成分共同构成,其中肌肉及脂肪比例具有决定作用。因此,体成分比例的改变可能导致机体骨量的相应变化。本研究相关分析结果表明,两组受试者体成分指标均与全身BMD显著相关,其中PBM与全身BMD显著负相关,相关系数由高到低排序依次为:BMI、PBM、BW、PBF 和BM。这表明受试者体成分指标对全身BMD有不同程度的影响。 这与文献报道[39-41]一致。
本研究中,EG组经过 1年运动,BW、BMI及PBF均显著降低,PBM显著升高,而髋等速90°伸、髋等速180°伸、髋等速180°屈及腰等速120°屈的肌力均较1年前明显升高。OG组实验1年前后,自身比较体成分各项指标均无显著改变,但1年后,BW、BMI、PBF均显著高于EG组。OG组实验1年前后,自身比较肌力表现为Hif-180及Hie-180的肌力均较 1 年前明显降低,EG 组 Hif-180、Hie-180 及 Die-120肌力均显著高于OG组。这表明,1年健骨操运动有效改善了EG组受试者的体成分,瘦体重比例相对提高,肌肉力量显著增加,均成为EG组骨量显著高于OG组的重要原因。
Frost指出,肌肉力量决定骨结构和骨量,使骨强度适应于力学负荷。肌肉力量变化先于骨强度改变,骨强度改变由肌肉力量变化引起。当处于废用状态或机体雌激素缺乏时,肌肉力量下降速度快于骨强度下降;而当较高强度负荷刺激或再补充雌激素时,肌肉力量增加则先于骨强度提高[42,43]。 综合分析本研究两组受试者肌肉力量的变化特点可以看出,其维持和改善BMD的主要原因是1年健骨操运动导致的肌肉相对比例的改善和肌肉力量的显著增加,特别是肌肉力量增加,有效维持或增加了机体骨量。OG组受试者由于缺乏运动刺激,致使肌肉力量降低,减弱了对骨骼的机械拉力刺激,出现骨量持续低下。
综上所述,机体骨量变化受运动负荷、运动方式、体成分、能量消耗等多种因素影响。不同程度的体力活动(运动)施加于机体的负荷刺激的强度及量具有差异,导致能量消耗的差异,进而影响体成分及骨量的变化。合理有效的运动通过改善体成分,增加肌肉力量,增加对骨骼的力学负荷刺激等诸多因素,维持和增加骨量。本研究中健骨操运动具有比较理想的维持和改善骨量的效果,其运动强度、时间及内容均比较适宜。
4 小结
4.1 有效的体力活动(包括运动)与体成分变化密切相关,体成分改变是导致骨量变化的重要因素。
4.2 健骨操运动改善体成分,增加肌肉相对比例,增加肌肉收缩力量,有效地维持和改善机体骨量。
4.3 3~6 MET 强度、每周 3~4 次、每次 60 min 左右的“健骨操”运动(有氧耐力、抗阻练习、一定冲击性练习、柔韧及平衡练习等),是绝经女性骨量维持和改善所需要的适宜运动。
[1]Howe TE,Shea B,Dawson LJ,et al.Exercise for preventing and treating osteoporosis in postmenopausal women.Cochrane Database Syst Rev,2011, (7):CD000333.doi:10.1002 /14651858.
[2]Bonaiuti D,Shea B,Iovine R,et al.Exercise for preventing and treating osteoporosis in postmenopausal women.Cochrane Database Syst Rev,2002,(3):CD000333.
[3]Borer KT.Physical activity in the prevention and amelioration of osteoporosis in women:interaction of mechanical,hormonal and dietary factors.Sports Med,2005,35 (9):779-830.
[4]Wayne PM,Kiel DP,Buring JE,et al.Impact of Tai Chi exercise on multiple fracture -related risk factors in postmenopausal osteopenic women:a pilot pragmatic randomized trial.BMC Complement Altern Med,2012,12:7.
[5]Engelke K,Kemm ler W,Lauber D,et al.Exercise maintains bone density at spine and hip EFOPS:a 3-year longitudinal study in early postmenopausal women.Osteoporos Int,2006,17(1):133-142.
[6]Martyn-St James Mand Carroll S.Meta-analysis of walking for preservation of bone mineral density in postmenopausal women.Bone,2008,43(3):521-531.
[7]Yamazaki S,Ichimura S,Iwamoto J,et al.Effect of walking exercise on bone metabolism in postmenopausal women with osteopenia/osteoporosis.J Bone Miner Metab,2004,22(5):500-508.
[8]Poehlman ET.Energy expenditure and requirements in aging humans.J Nutr,1992,122(11):2057-2065.
[9]Houston DK,Nicklas BJ,Zizza CA.Weighty concerns:the growing prevalence of obesity among older adults.J Am Diet Assoc,2009,109(11):1886-1895.
[10]Lührmann PM,Bender R,Edelmann -Sch a fer B,et al.Longitudinal changes in energy expenditure in an elderly German population:a 12 -year follow -up.Eur J Clin Nutr,2009,63(8):986-992.
[11]Starling RD.Energy expenditure and aging:effects of physical activity.Int J Sport Nutr Exerc Metab,2001,11(Suppl):S208-217.
[12]Sun Q,Townsend MK,Okereke OI,et al.Physical activity at midlife in relation to successful survival in women at age 70 years or older.Arch Intern Med,2010,25 (2):194-201.
[13]Sun Q,Townsend MK,Okereke OI,et al.Adiposity and weight change in mid-life in relation to healthy survival after age 70 in women:prospective cohort study.BMJ,2009,29;339-347.
[14]Manini TM,Everhart JE,Patel KV,et al.Daily activity energy expenditure and mortality among older adults.JAMA,2006,12(2):171-179.
[15]Poehlman ET,Arciero PJ,Goran MI.Endurance exercise in aging humans:effects on energy metabolism.Exerc Sport Sci Rev,1994,22:251-284.
[16]WHO (World Health Organization).Study Group on Assessment of fracture risk and its application to screening for postmenopausal osteoporosis.Technical Report Series,1994,843:1-10.
[17]Ho-Pham LT,Nguyen ND,Lai TQ,et al.Contributions of lean mass and fat mass to bone mineral density:a study in postmenopausal women.BMC Musculoskelet Disord,2010,26(11):59.
[18]Houston DK,Nicklas BJ,Zizza CA.Weighty concerns:the growing prevalence of obesity among older adults.J Am Diet Assoc,2009,109(11):1886-1895.
[19]中国老年学学会骨质疏松委员会骨质疏松诊断标准学科组.中国人骨质疏松症建议诊断标准 (第二稿).中国骨质疏松杂志,2000,6(1):1-3.
[20]Swain DP,Abernathy KS,Smith CS,et al.Target heart rates for the development of cardiorespiratory fitness.Med Sci Sports Exerc,1994,26(1):112-116.
[21]Roberts SB,Dallal GE.Energy requirements and aging.Public Health Nutr,2005,8(7A):1028-1036.
[22]Chun MY.Validity and reliability of korean version of international physical activity questionnaire short form in the elderly.Korean J Fam Med,2012,33(3):144-151.
[23]Ainsworth BE,Haskell WL,Whitt MC,et al.Compendium of Physical Activities:an update of activity codes and MET intensities.Med Sci Sports Exerc,2000,32 (9 Suppl):S498-504.
[24]Starling RD,Toth MJ,Matthews DE,et al.Energy requirements and physical activity of older free-living African-Americans:a doubly labeled water study.J Clin Endocrinol Metab,1998,83(5):1529-1534.
[25]NIH consensus development panel on osteoporosis prevention,diagnosis,and therapy. JAMA,2001,285:785-795.
[26]Nguyen ND,Pongchaiyakul C,Center JR,Identification of high -risk individuals for hip fracture:a 14 -year prospective study.J Bone Miner Res,2005,20 (11):1921-1928.
[27]Johnell O,Kanis JA,Oden A,et al.Predictive value of BMD for hip and other fractures.J Bone Miner Res,2005,20(7):1185-1194.
[28]Brach JS,Simonsick EM,Kritchevsky S,et al. The association between physical function and lifestyle activity and exercise in the health,aging and body composition study.J Am Geriatr Soc,2004,52 (4):502-509.
[29]Roghani T,Torkaman G,Movasseghe S,et al.Effects of short-term aerobic exercise with and without external loading on bone metabolism and balance in postmenopausal women with osteoporosis.Rheumatol Int,2012,Mar 24.[Epub ahead of print]
[30]Gómez-Cabello A,Ara I,González-Agüero A,et al.Effects of training on bone mass in older adults:a systematic review.Sports Med,2012,42(4):301-325.
[31]Wolff I,van Croonenborg JJ,Kemper HC,et al.The effect of exercise training programs on bone mass:a meta-analysis of published controlled trials in pre- and postmenopausal women.Osteoporos Int,1999,9(1):1-12.
[32]Egan E,Reilly T,Giacomoni M,et al.Bone mineral density among female sports participants.Bone,2006,38 (2):227-233.
[33]Taaffe DR,Robinson TL,Snow CM,et al.High-impact exercise promotes bone gain in well-trained female athletes.J Bone Miner Res,1997,12(2):255-260.
[34]Sugiyama T,Yamaguchi A,and Kawai S.Effects of skeletal loading on bone mass and compensation mechanism in bone:a new insight into the “mechanostat” theory.J Bone Miner Metab,2002,20(4):196-200.
[35]Orsatti FL,Nahas EA,Nahas-Neto J,et al.Low appendicular muscle mass is correlated with femoral neck bone mineral density loss in postmenopausal women.BMC Musculoskelet Disord,2011,12:225.
[36]Nguyen TV,Kelly PJ,Sambrook PN.Lifestyle factors and bone density in the elderly:implications for osteoporosis prevention.J Bone Miner Res,1994,9(9):1339-1346.
[37]Afghani A,Barrett-Connor E,Wooten WJ.Resting energy expenditure:a better marker than BMI for BMD in African-American women.Med Sci Sports Exerc,2005,37(7):1203-1210.
[38]Nguyen TV,Center JR,Eisman JA.Osteoporosis in elderly men and women:effects of dietary calcium,physical activity,and body mass index.J Bone Miner Res,2000,15(2):322-331.
[39]Liu JM,Zhao HY,Ning G,et al.Relationship between body composition and bone mineral density in healthy young and premenopausal Chinese women.Osteoporos Int,2004,15(3):238-242.
[40]Taaffe DR,Cauley JA,Danielson M,et al.Race and sex effects on the association between muscle strength,soft tissue,and bone mineral density in healthy elders:the health,aging,and body composition study.J Bone Miner Res,2001,16(7):1343-1352.
[41]Gnudi S,Sitta E,Fiumi N.Relationship between body composition and bone mineral density in women with and without osteoporosis:relative contribution of lean and fat mass.J Bone Miner Metab,2007,25(5):326-332.
[42]Frost HM.A 2003 update of bone physiology and Wolff’s Law for clinicians.Angle Orthod,2004,74(1):3-15.
[43]Schiessl H,Frost HM,Jee WS.Estrogen and bone-muscle strength and mass relationships.Bone,1998,22(1):1-6.

