Nrf2基因敲除对肝脏氧化应激及胰岛素抵抗的影响
倪 阵,闻勤生,赵曙光,张 哲,王旭霞,王景杰,刘震雄(第四军医大学唐都医院消化内科,西安 710038;通讯作者,E-mail:liuzx816@yahoo.com.cn)
非酒精性脂肪性肝炎(NASH)是全球范围内最常见的慢性肝脏疾病之一,被认为是代谢综合征在肝脏的表现[1]。胰岛素抵抗(IR)和NASH关系密切,并能通过促进肝脏脂肪变性、细胞损伤和炎症反应,最终导致非酒精性单纯性脂肪肝(NAFL)向非酒精性脂肪性肝炎(NASH)的发展[2],而氧化应激是诱导IR的重要危险因素,其可以直接或间接活化多种应激通路,进一步增加胰岛素受体底物-1(IRS-1)不连续的丝氨酸或苏氨酸磷酸化,从而抑制IRS-1酪氨酸磷酸化,最终导致IR的发生[3]。核转录因子NF-E2相关因子2(Nrf2)是体内调节氧化应激的关键靶点,其可以通过促进多种Ⅱ相抗氧化酶和解毒酶的表达[4],发挥重要的抗氧化作用,但Nrf2在肝脏IR中的作用尚未见明确报道。本实验将Nrf2基因敲除小鼠作为研究对象,通过给予4周高脂饮食,观察肝脏氧化应激及IR相关指标的变化,直接探讨Nrf2在肝脏IR发生中的作用。
1 试剂和方法
1.1 试剂
牛胆盐、胆固醇均购自西安昕泰生物技术责任有限公司;血糖、丙二醛(MDA)与谷胱甘肽(GSH)检测试剂盒,BCA蛋白定量试剂盒均购自南京建成生物有限公司;兔抗鼠JNK多克隆抗体、兔抗鼠p-JNK多克隆抗体、兔抗鼠IRS-1多克隆抗体、兔抗鼠p-IRS-1多克隆抗体、β-actin均购自英国Abcam公司;羊抗兔IgG抗体、β-actin二抗均购自北京博奥森生物有限公司。
1.2 动物来源及分组
清洁级ICR雄性野生型(WT)和Nrf2基因敲除(Nrf2-/-)小鼠各10只,6-8周龄,体重18-22 g,购自南京军区总医院比较医学科。所有小鼠适应性喂养1周后,按照随机数字法分为WT对照组(control)、Nrf2-/-对照组(KO)、WT 高脂饮食组(HFD)和Nrf2-/-高脂饮食组(KOHFD),各5只。对照组给予普通饲料,由第四军医大学实验动物中心提供,高脂饮食组给予高脂饲料(在普通饲料基础上添加10%猪油、2%胆固醇和0.5%胆盐),由西安迪乐普生物有限公司生产加工,每周记录小鼠体重变化。4周末,空腹12 h,行腹腔注射葡萄糖耐量实验,之后4%戊巴比妥钠腹腔注射麻醉,下腔静脉取血,肝脏称重,部分固定于4%多聚甲醛,行组织学检测,其余冻存于液氮中,留待检测。
1.3 检测指标及方法
1.3.1 空腹血糖检测 下腔静脉采血,室温静置2 h,2 000 r/min离心10 min,吸取上清,按照血糖检测试剂盒说明书检测空腹血糖变化。
1.3.2 葡萄糖耐量实验(iPGTT)所有小鼠空腹12 h后,称体重,腹腔注射20%葡萄糖溶液(2 g/kg),分别在 0 min,15 min,30 min,60 min 和 120 min,尾静脉采血,检测血糖变化并进一步计算时间-血糖曲线下面积(AUC),公式为:

1.3.3 肝脏MDA和GSH检测 精确称取肝脏组织0.5 g,加入 4.5 ml预冷 PBS,手动匀浆 8 min,2 500 r/min离心10 min,取上清,按照试剂盒说明书检测MDA和GSH水平。
1.3.4 Western-Blot检测肝脏 JNK、p-JNK、IRS-1、p-IRS-1水平 取肝组织,研磨,裂解,提取蛋白并定量,进行聚丙烯酰胺凝胶电泳90 min,按照湿转法将电泳产物转移至NC膜上,5%脱脂奶粉封闭,4℃过夜,滴加一抗(1∶400),室温 4 h,PBST 洗膜 3 次,10 min/次,然后滴加二抗(1∶2 000),室温下孵育1 h,PBST洗膜3次,10 min/次。滴加 NBT/BCIP显色液,避光显色10 min,双蒸水洗膜终止显色,GelDoc凝胶成像仪采集图像。
1.3.5 肝脏组织学检测 取肝右叶部分组织,4%多聚甲醛固定24 h,石蜡包埋,切片,行苏木精-伊红染色,光镜下观察肝脏组织学改变。
1.4 统计学分析
2 结果
2.1 生理指标变化
HFD组和KOHFD组小鼠体重增加均高于control组和KO组,但差异均无统计学意义(P>0.05);与control组和KO组相比,KOHFD组小鼠肝脏质量显著升高(P<0.05),而HFD组小鼠肝脏质量与control组之间差异无统计学意义(P>0.05,见表1)。
2.2 肝脏光镜下改变
HE染色显示,control组和KO组小鼠肝脏肝小叶结构正常,肝细胞排列成条索状,围绕在中央静脉周围,呈放射状分布;HFD组小鼠肝脏组织结构较对照组明显紊乱,肝细胞内可见少量脂肪沉积,无明显炎症细胞浸润;而KOHFD组小鼠肝脏,脂肪沉积明显加重,部分细胞出现空泡变性,并可见少量炎症细胞浸润,主要位于静脉周围(见图1)。
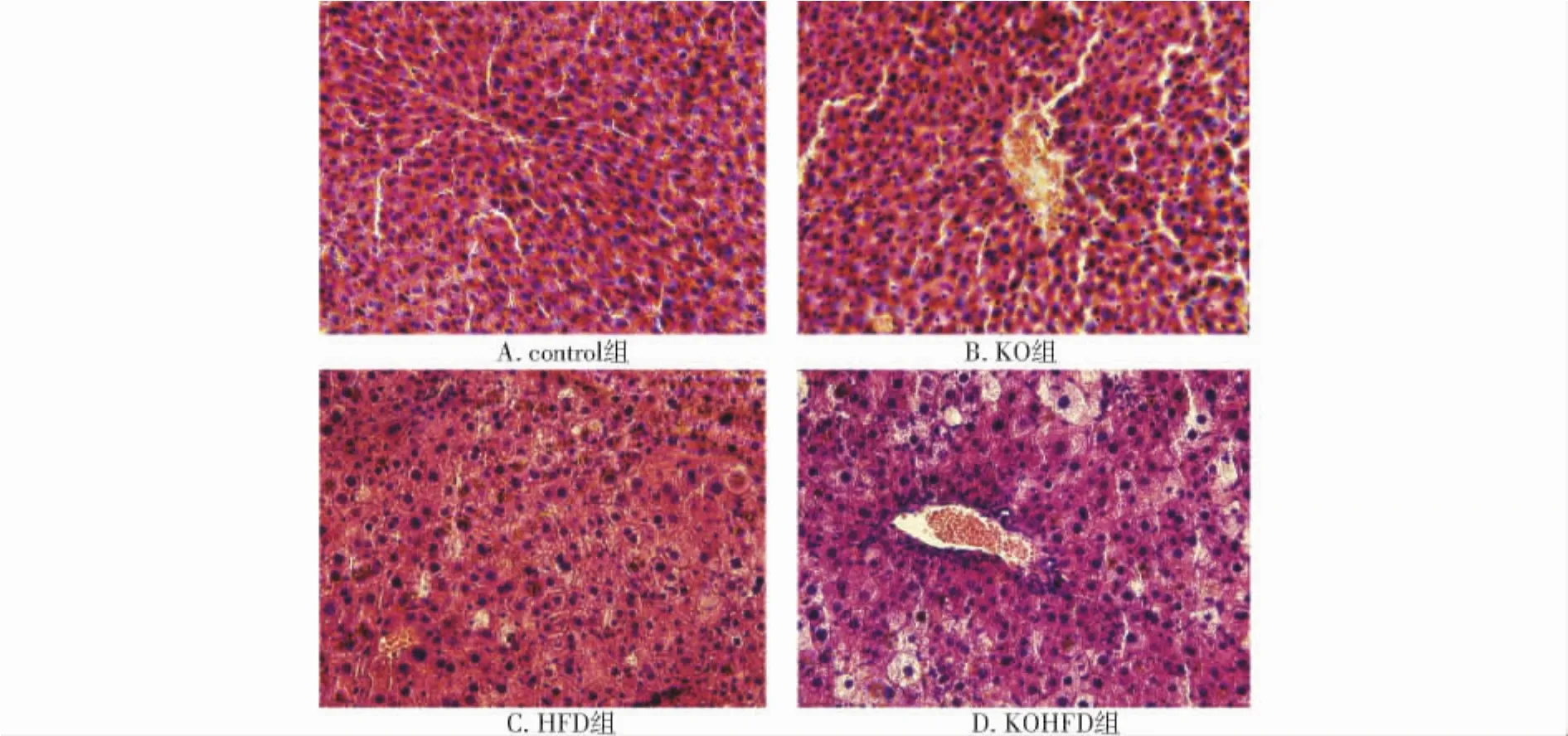
图1 各组小鼠肝脏组织学改变 (×40)Fig 1 Changes of pathology of liver in four groups (×40)
2.3 肝脏氧化应激水平变化
HFD组和KOHFD组小鼠肝脏丙二醛水平均显著高于control组和KO组(P<0.05),且KOHFD组明显高于HFD组(P<0.05);相反,与control组和KO组相比,HFD和KOHFD组小鼠肝脏谷胱甘肽水平均显著降低(P<0.05),且 KOHFD组明显低于HFD 组(P<0.05,见表1)。

表1各组小鼠体重、肝脏重量、空腹血糖、肝脏GSH和MDA变化(x¯±s)Tab 1The changes of weight gain,liver weight,blood glucose,hepatic GSH and MDA in mice(x¯±s)
2.4 空腹血糖变化
KOHFD组和HFD组小鼠空腹血糖均高于control组和KO组,但差异均无统计学意义(P>0.05,见表1)。
2.5 葡萄糖耐量实验变化
腹腔注射葡萄糖后,HFD和KOHFD组小鼠血糖水平在15 min,30 min和60 min均高于control组和KO组,且KOHFD组小鼠15 min血糖水平显著升高(P<0.05),而HFD组和control组之间差异无统计学意义(P>0.05);KOHFD组小鼠时间-血糖曲线下面积(AUC)显著高于control组(P<0.05),而HFD组与control组之间差异无统计学意义(P>0.05,见图2)。
2.6 肝脏JNK/p-JNK、IRS-1/p-IRS-1表达变化
各组小鼠肝脏JNK和IRS-1蛋白表达水平均无明显差异;p-JNK表达水平在KOHFD组小鼠肝脏明显升高,灰度值显著高于 KO组(P<0.05),而在HFD组小鼠肝脏表达轻度升高,灰度值与control组相比无显著差异(P>0.05);KOHFD组小鼠肝脏p-IRS-1表达显著减少,灰度值明显低于KO组(P<0.05),而HFD组小鼠肝脏p-IRS-1表达轻度下降,灰度值与control组之间无明显差异(P>0.05,见表2、图 3)。
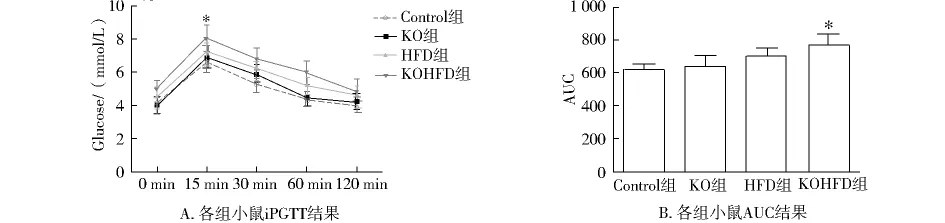
图2 各组小鼠葡萄糖耐量实验(iPGTT)和时间-血糖曲线下面积(AUC)Fig 2 The iPGTT and AUC results in four groups
表2肝脏JNK/p-JNK、IRS-1/p-IRS-1表达灰度值变化(±s)Tab 2The changes of grey value density of liver JNK/p-JNK,IRS-1/p-IRS-1 expression in mice(±s)

表2肝脏JNK/p-JNK、IRS-1/p-IRS-1表达灰度值变化(±s)Tab 2The changes of grey value density of liver JNK/p-JNK,IRS-1/p-IRS-1 expression in mice(±s)
与 control组比较,﹡ P <0.05;与 KO 组比较,△P <0.05
组别JNK p-JNK IRS-1 p-IRS-1 control组 1.573 ±0.132 1.436 ±0.096 1.689 ±0.087 1.613 ±0.167 KO 组 1.493 ±0.142 1.412 ±0.098 1.703 ±0.127 1.598 ±0.150 HFD 组 1.524 ±0.145 1.699 ±0.128 1.673 ±0.148 1.382 ±0.089 KOHFD 组 1.508 ±0.161 2.076 ±0.162﹡△ 1.681 ±0.189 1.003 ±0.079﹡△
3 讨论

图3 Western blot检测肝脏 JNK/p-JNK、IRS-1/p-IRS-1表达变化Fig 3 Expression of JNK/p-JNK,IRS-1/p-IRS-1 in livers by Western blot
非酒精性脂肪性肝病(NAFLD)是一种在病理学上与酒精性肝病相似,但患者无过量饮酒史的代谢性疾病,其疾病谱包括单纯性脂肪肝和脂肪性肝炎(NASH)。流行病学调查显示,其在全世界成人范围内的发病率约为17%-30%[5,6]。目前观点认为,单纯性脂肪肝属于良性病变,而NASH则可以进展至肝硬化、终末期肝病和肝癌。
本实验肝脏组织学检测显示,control与KO小鼠肝脏小叶结构清晰,肝细胞排列成条索状。给予4周高脂饮食后,HFD小鼠表现为轻度的肝脏脂肪变性,无明显炎症细胞浸润,而KOHFD小鼠肝脏脂质沉积较HFD小鼠明显加重,并显示出少量的炎症细胞浸润。这些结果说明,单纯敲除Nrf2对小鼠肝脏组织学无明显影响,而敲除Nrf2可以明显加重高脂饮食诱导下小鼠肝脏脂肪沉积和炎症变化。
氧化应激是促使单纯性脂肪肝向NASH进展的关键因素,当过量的活性氧(ROS)作用于生物膜上的多聚不饱和脂肪酸(PUFAs)时,引发脂质过氧化反应,从而使细胞内生物膜的通透性和流动性发生改变,导致细胞结构改变和功能障碍[7]。但是,机体只有在抗氧化能力下降的状态下,氧化应激才能产生负面作用。丙二醛(MDA)是细胞毒性较强的脂质过氧化产物,它半衰期较长,并能够弥散到细胞内其他靶位,加重氧化应激损伤。核转录因子NFE2相关因子2(Nrf2)是体内调节氧化应激的中枢环节,正常情况下,其与Keap1结合,主要位于细胞质内,处于相对抑制状态,当受到外源性或内源性刺激后,Nrf2从Keap1中释放,转位进入细胞核,与抗氧化反应元件(ARE)结合,从而调节靶基因的转录[8],表达具有抗氧化作用的Ⅱ相解毒酶。谷胱甘肽(GSH)是一种重要的内源性抗氧化产物,可以对抗自由基对细胞和器官的伤害[9]。Nrf2可以通过调节谷氨酸半胱氨酸合成酶(GCLC)和谷氨酸半胱氨酸合成酶调节亚单位(GCLM),调控GSH的合成[10]。我们前期的研究证实[11-13],通过诱导 Nrf2核转位,可以明显降低肝细胞和高脂饮食诱导的氧化应激水平。本实验结果显示,与control小鼠相比,KO小鼠肝脏MDA及GSH水平均无明显变化,而4周高脂饮食后,HFD小鼠肝脏MDA水平显著升高,而GSH水平显著下降,说明HFD小鼠肝脏已经产生氧化应激,而KOHFD小鼠MDA明显高于HFD小鼠,GSH水平明显低于HFD小鼠。说明单纯敲除Nrf2对小鼠肝脏氧化应激水平无明显影响,4周高脂饮食可以导致小鼠肝脏氧化应激的发生,而敲除Nrf2后,小鼠肝脏氧化应激水平进一步加重。
NASH患者往往存在胰岛素抵抗,大量实验也发现,高脂饮食诱导的NASH动物模型,伴有不同程度的高血糖、高胰岛素血症和胰岛素敏感性下降[14]。肝脏是胰岛素作用的靶器官,当存在高胰岛素血症时,肝脏葡萄糖输出持续存在而加重高血糖,反之,高血糖则可以进一步刺激胰岛素分泌,从而加重胰岛素抵抗,形成恶性循环。胰岛素抵抗可以促进外周脂肪的水解,导致游离脂肪酸(FFA)向肝脏运输增加,同时,高胰岛素血症可以刺激肝脏的脂肪合成,从而导致脂质在肝脏大量沉积[15]。
最近有研究提示,高脂饮食诱导的NASH小鼠,肝脏是首要受损器官,肝脏胰岛素抵抗先于外周胰岛素抵抗的发生[16],因此,肝脏IR是NASH进展的启动环节,而肝脏局部氧化应激的产生可能是诱发肝脏胰岛素抵抗的关键环节。其可以激活一系列信号通路,如JNK,而磷酸化的JNK则可以作用于胰岛素受体底物(IRS-1),促进其丝氨酸磷酸化、抑制其酪氨酸磷酸化,从而抑制胰岛素信号的转导[17]。本实验结果显示,control组和KO组小鼠空腹血糖、iPGTT和AUC均无明显差异,4周高脂饮食后,虽然HFD小鼠空腹血糖、时间-血糖曲线下面积(AUC)均高于control组,但差异无统计学意义。Western blot检测发现,control组和KO组小鼠p-JNK与p-IRS-1无明显差异,HFD小鼠肝脏p-JNK与p-IRS-1水平和control组相比轻度升高,但灰度值差异无统计学意义,这些结果说明,HFD小鼠没有出现明显的肝脏和外周胰岛素抵抗。而在KOHFD小鼠,虽然空腹血糖与control与KO小鼠相比无统计学意义,但是葡萄糖耐量实验结果显示,15 min血糖水平和AUC显著高于control组,说明KOHFD小鼠虽没有发生高血糖,但是已经存在轻度外周胰岛素抵抗。进一步Western blot检测提示,JNK和IRS-1水平在各组间无明显差异,而KOHFD小鼠肝脏p-JNK显著升高,p-IRS-1水平显著降低,说明KOHFD小鼠已经出现了显著的肝脏胰岛素抵抗。这些结果证实,单纯敲除Nrf2对小鼠葡萄糖代谢及肝脏胰岛素信号通路无明显影响,而给予敲除Nrf2小鼠高脂饮食可以通过加重肝脏氧化应激水平,进一步作用于胰岛素信号通路,明显加速肝脏胰岛素抵抗的发生。
本实验采用Nrf2基因敲除小鼠作为研究对象,通过给予高脂饮食,发现敲除Nrf2可以促进肝脏脂质沉积和炎症细胞浸润,加重肝脏氧化应激水平,进而增加JNK磷酸化水平、降低IRS-1酪氨酸磷酸化水平而显著加速小鼠肝脏胰岛素抵抗的发生。本实验的研究结果为以Nrf2为靶点治疗NASH相关胰岛素抵抗提供了新的实验依据。
[1] Farrell GC,Larter CZ.Nonalcoholic fatty liver disease:from steatosis to cirrhosis[J].Hepatology,2006,43(2 Suppl 1):p.S99-S112.
[2] Lyn PA.Nonalcoholic fatty liver disease:relationship to insulin sensitivity and oxidative stress[J].Altern Med Rev,2002,7(4):276-291.
[3] Beyer TA,Xu W,Teupser D,et al.Impaired liver regeneration in Nrf2 kockout mice-role of ROS-mediated insulin/IGF-1 resistance[J].EMBO J,2008,27(1):212-223.
[4] Zhang Q,Pi JB,Courtney G.Woodset al.A systems biology perspective on Nrf2-mediated antioxidant response[J].Toxicol Appl Pharmacol,2010,244:84-97.
[5] Raj VU,Naga CH.Non-alcoholic fatty liver disease and non-alcoholic steatohepatitis:Selected practical issues in their evaluation and management[J].Hepatology,2009,49(1):306-317.
[6] Cheung O,Sanyal AJ.Recent advances in nonalcoholic fatty liver disease[J].Curr Opin Gastroenterol,2010,26:202-208.
[7] Giovanni MU,Roberto GA,Maurizio CA.Recent insights into hepatic lipid metabolism in non-alcoholic fatty liver[J].Prog Lipid Res,2009,48:1-26.
[8] Roberto GA,Giovanni MU,Maurizio CA.Redox balance in the pathogenesis of nonalcoholic fatty liver disease:mechanisms and therapeutic opportunities[J].Antioxid Redox Signal,2011,15(5):1325-1352.
[9] Li WG,Kong AN.Molecular mechanisms of Nrf2-mediated antioxidant response[J].Mol Carcinog,2009,48(2):91-104.
[10] Hirokazu SU,Kosuke OK,Junichi SH,et al.Deletion of nuclear factor-e2-related factor-2 leads to rapid onset and progression of nutritional dteatohepatitis in mice[J].Am J Physiol Gastrointest Liver Physiol,2009,19.
[11] 赵丽,赵曙光,李慧艳,等.Nrf2对高脂饮食诱导的大鼠胰岛素抵抗的保护作用[J].山西医科大学学报,2011,42(9):723-726.
[12] 张晓兰,王旭霞,冯国华,等.网络抗氧化剂对大鼠非酒精性脂肪肝炎模型的防治作用[J].肝脏,2008,1(3):130-132.
[13] 李强,赵曙光,闻勤生,等.姜黄素激活转录因子Nrf2对人肝细胞氧化应激的影响[J].胃肠病学和肝病学杂志,2011,l9(2):154-156.
[14] Chavez-Tapia NC,Rosso1 N,Tiribelli C.In vitro models for the study of nonalcoholic fatty liver disease[J].Curr Med Chem,2011,18,1079-1084.
[15] Postic CA,Girard JE.Contribution of de novo fatty acid synthesis to hepatic steatosis and insulin resistance:lessons from genetically engineered mice[J].J Clin Invest,2008(118):829-838.
[16] Patrice DC,Jacques AM,Miguel AIet al.Metabolic endotoxemia initiates obesity and insulin resistance[J].Diabetes,2007,56:1761-1772.
[17] Samuel VT,Liu ZX,Qu XQ,et al.Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease[J].J Biol Chem,2004,279(31):32345-32353.

