全氟戊烷微滴乳剂增强HIFU疗效的研究
朱媚莉,张爱丽,向昱,白景峰,Fabiilli Mario,Fowlkes Brian
1 上海交通大学生物医学工程学院,上海市,200030
2 上海交通大学Med-X研究院,上海市,200030
3 Department of Radiology,University of Michigan Health System,ann arbor,MI,USA
0 引言
高强度聚焦超声(high intensity focused ultrasound,HIFU)作为一种无创治疗肿瘤的技术,已广泛应用于肿瘤的临床治疗中[1-2]。在临床治疗中发现,对于体积较大的肿瘤,HIFU治疗所需时间较长,有些甚至需长达几个小时[3],患者在长时间的治疗过程中难以保持不移动,这就增加了HIFU治疗的风险[4]。有研究表明,造影剂微泡的存在可降低HIFU空化效应的阈值,对于HIFU损伤有一定的加强作用,能在短时间内能形成更大的损伤病灶[5]。但由于造影剂本身在体内循环时间短,需多次灌注才能在治疗时提供充足的微泡,而它的大量灌注可能会导致毛细血管出血,存在安全隐患[6]。
全氟戊烷微滴乳剂,在常温下用蛋白质或脂质包裹,它会以液态形式存在,在体内可较长时间稳定循环,在一定频率和强度的超声作用下,可被激发成微气泡[7],从而增强对超声波的吸收,增加热效应[8]。液态的全氟戊烷微滴乳剂,比气态的微泡更为稳定,可减少注射后微滴或微泡由于血液循环等造成的损失;此外,仅在聚焦超声焦域内的微滴才转化为微泡,可避免微泡对焦域外血管的损伤;焦域内微滴在超声作用下迅速转换为直径增大数倍的微泡时也会造成焦域内血管的阻塞,减少血流带走热量。为将该微滴用于临床治疗,必须先进行在体动物的实验研究。而目前已有研究采用的HIFU系统均为大型设备,不便于对小动物模型进行在体研究,其定位及操作控制等方面都存在着一定的局限性。上海市Med-X研究院教育部数字医学工程中心研制的小型高强度聚焦超声(HIFU)系统,因其聚焦超声换能器组成的探头小,操作方便,适用于本文的小动物的试验研究。同时结合制备的全氟戊烷微滴乳剂,对它的相变在体转化与增强HIFU治疗的热效应之间的关系进行研究,探索该协同治疗方法的可行性。
1 材料与方法
实验所用的相变全氟戊烷微滴乳剂(本文以下简称微滴乳剂)制备与文献[9]所用方法相同。图1所示为稀释1000倍后的该微滴乳剂在400倍显微镜下的照片,可见微滴形态良好、稳定。实验前采用库尔特粒度仪(Multisizer 3,Beckman Coulter,Inc)对稀释一万倍后的微滴乳剂数目随微滴直径的分布进行测量,测量结果如图 2所示,所测微滴乳剂的平均粒径为1.037 μm,其中99%的粒径小于3 μm。

图1 显微镜下全氟戊烷微滴乳剂照片Fig.1 Microscopic image of droplets
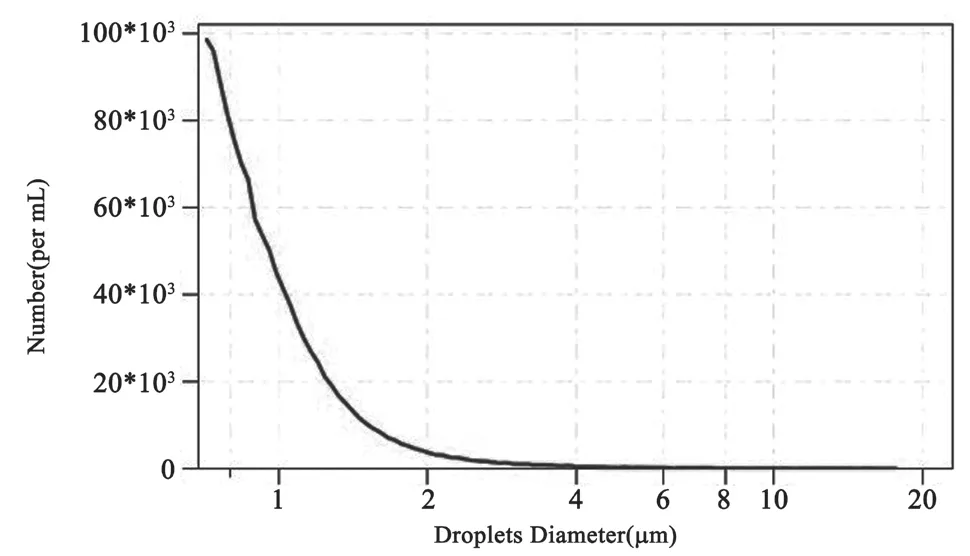
图2 稀释104倍后全氟戊烷微滴乳剂的数目随微滴直径分布曲线Fig.2 Droplets number distribution with size after being diluted to 104 times
实验所用的仿生物组织的胶体采用鸡蛋清、聚丙烯酰胺等按照文献[8]中方法制备。实验组胶溶液在凝结之前加入相应剂量的微滴乳剂,并用搅拌子缓慢搅拌,使微滴均匀分散于胶体中。加入致凝试剂并搅拌之后,倒入直径为4.5 cm、高为5 cm的圆柱形模具之内,置入4oC冰箱内使其凝结,次日取出进行实验。
实验采用的小型HIFU系统由17阵元组成,通过自带高精度定时功能的HIFU相位信号发生器可产生连续波或脉冲波治疗模式[10]。HIFU系统发射的超声波频率为2 MHz,声强可调节。探头浸没于4.8 cm直径的水槽中,实验设置的焦点距水槽底部5 cm。水槽高度为4 cm,表面覆盖一层导声性能良好的圆形高分子薄膜,通过带螺纹的1 cm高左右的环形水槽盖旋紧的方式将薄膜固定,并将水槽密封。实验时,直径为螺纹盖内径尺寸的胶体可直接置于封膜上方,封膜表面加入一定的去气去离子水,使封膜与胶体形成良好的耦合,如图3所示。

图3 小型HIFU 系统探头及胶体实验示意图Fig.3 The transducer of the small HIFU system and setup of the phantom
实验所用动物为8周鼠龄的健康裸鼠,中科院上海动物实验中心提供,饲养于人工12 h昼夜交替控制,且温度和湿度适宜的动物房内经过消毒的独立鼠笼中,并提供充足的60钴辐射灭菌饲料及高温灭菌水。
2 实验结果及讨论
将实验制备的仿生物组织的胶体分为三组,分别为不含微滴乳剂,含有浓度为1.2×105U/mL以及1.2×106U/mL的微滴乳剂的胶体。实验前三组胶体通过肉眼及B超观察,胶体内蛋白均匀分布,透明度较高,一致性良好。
三组胶体均采用相同的HIFU参数,最大声强为1900 W、连续波持续时间为30 s进行辐照。辐照后,对胶体进行B超成像,并用相机拍照。从与HIFU入射方向相同角度拍摄胶体横切面内蛋白凝固变性形成的损伤,依次为不加微滴乳剂、加入微滴乳剂浓度为1.2×105U/mL以及1.2×106U/mL浓度的胶体图像,如图4所示。

图4 相同连续波模式下HIFU辐照对添加不同浓度全氟戊烷微滴乳剂胶体横向切面损伤情况Fig.4 Optical images of gel in horizontal plane with different concentration of droplets after HIFU exposure of the same continuous wave
胶体内蛋白经辐照发生凝固的区域变成白色不透明,肉眼易分辨。从图4中明显可见,凝固性坏死的区域随着微滴乳剂的浓度增大而增强。结合图5可看出,加入微滴乳剂浓度为1.2×105U/mL时图4(b),HIFU形成的凝固性损伤的区域明显大于不加入微滴乳剂的损伤图4(a)。胶体损伤从垂直入射方向用相机拍摄及B超成像的纵切面结果分别如图5(a)、5(b)所示,从图5(b)可所见,不添加微滴乳剂时蛋白凝固区域分成焦区及焦前区封膜与胶体接触面两部分,焦区损伤形状较规则,而焦前区损伤表明胶-水-封膜界面存在热量累积;添加低浓度(1.2×105U/mL)微滴乳剂的胶体,由于焦前区域的热量积累使该区域的微滴转化为气泡,从而加重了焦前区的损伤程度,胶体从与封膜接触面到焦点区域形成大量凝固性坏死,证明该浓度下微滴乳剂对HIFU热效应的加强效果显著;而当加入微滴乳剂的浓度为1.2×106U/mL时,热量更多集中在焦前区域,由于微滴浓度过高,超声从探头穿过封膜进入胶体时存在较强的反射,使胶前区微滴大量转化为气泡,导致声波能量传输受到严重阻碍,无法再聚集于预期的焦点位置,胶体与HIFU探头封膜接触面反而形成严重损伤。见图4(c)。

图5 相同连续波模式下HIFU辐照对胶体损伤纵向切面图像Fig.5 In the axial-elevational plane with different concentration after HIFU exposure of the same continuous wave
以上的实验结果证明,适宜浓度的微滴乳剂能加强HIFU的热效应,但当微滴乳剂浓度过高时,则会对焦点处热量的积累形成反作用。此外,小型HIFU系统采用封膜包裹探头内的去气去离子水,虽易于操作,但会使胶体-水-封膜界面形成较强的超声反射,不利于超声的传输以及聚焦,寻找导声性能更好的高分子薄膜是进一步要研究的工作。
为了进一步研究小型HIFU系统在体内血管内相变的全氟戊烷微滴乳剂激发情况,将裸鼠采用腹腔注射100 μL的戊巴比妥钠(1.6%)麻醉后,尾静脉注射100 μL即时稀释到浓度为1.2×107U/mL的微滴乳剂。约30 s后,从背部拉出一块皮肤采用耦合胶耦合至HIFU探头水槽封膜上方焦点处固定,并作好标记。启动小型HIFU系统,发射30 s连续波作用于拉出的皮肤上。1 min后,腹腔注射300 μL戊巴比妥钠(1.6%)使裸鼠安乐死,随机剪取辐照后的几处皮肤,剪成小片置于玻片上,采用正置荧光显微镜观察并拍摄图像。小型HIFU系统激发微滴乳剂后产生的微泡如图6所示,放大倍数为100。微泡最大直径约为58 μm左右,是原先微滴粒径的数倍,形状较规则。

图6 显微镜下裸鼠血管内小型HIFU系统激发产生的微泡Fig.6 Microscopic image of bubbles vaporized by small HIFU system in blood vessel of nude mice
该实验结果证明,小型HIFU系统发射的超声能够将在体血管内的全氟戊烷微滴乳剂激发变成微泡。粒径大小有一定差异,与微滴乳剂原有微泡粒径存在差异有一定关系,也与不同部位的超声强度分布不一致相关。而在体微滴转化为微泡的动态过程及其对血管的损伤、对肿瘤的治疗效果等,仍需要进一步的研究。
3 结论
实验表明,适宜浓度的全氟戊烷微滴乳剂能够加强小型HIFU系统焦域内仿生物组织胶体对HIFU热量的吸收,使在相同的HIFU参数下形成的热凝固损伤范围更大;但当全氟戊烷微滴乳剂的浓度过高时,将导致焦前区出现损伤,而焦域内损伤反而受到抑制。此外,小型HIFU系统能够在体内激发微滴转化为体积增大数十倍的气泡,为后续在体动物实验研究HIFU结合相变全氟戊烷微滴乳剂的治疗肿瘤打下了基础。
[1] Al-Bataineh O,Jenne J,Huber P.Clinical and future applications of high intensity focused ultrasound in cancer[J].Cancer Treat Rev,2012.38(5):346-53.
[2]陈红坚,甘娜,文勇,等.高强度聚焦超声治疗子宫肌瘤和子宫腺肌瘤的临床应用[J].临床超声医学杂志,2012.14(2):127-129.
[3]Zhang L,Chen WZ,Liu YJ,et al.Feasibility of magnetic resonance imaging-guided high intensity focused ultrasound therapy for ablating uterine fibroids in patients with bowel lies anterior to uterus[J].Eur J Radiol,2010.73(2):396-403.
[4]Kratzik C,Schatzl G,Lackner J,et al.Transcutaneous high-intensity focused ultrasonography can cure testicular cancer in solitary testis[J].Urology,2006.67(6): 1269-1273.
[5]Zhou CW,Li FQ,Qin Y,et al,Non-thermal ablation of rabbit liver VX2 tumor by pulsed high intensity focused ultrasound with ultrasound contrast agent:Pathological characteristics[J].World J Gastroenterol,2008.14(43): 6743-6747.
[6]Tran BC,Seo J,Hall TL,et al.Effects of contrast agent infusion rates on thresholds for tissue damage produced by single exposures of high-intensity ultrasound[J].IEEE Trans Ultrason Ferroelectr Freq Control,2005.52(7):1121-1130.
[7]Kripfgans OD,Fowlkes JB,Miller DL,et al.Acoustic droplet vaporization for therapeutic and diagnostic applications[J].Ultrasound Med Biol,2000.26(7): 1177-1189.
[8]Zhang M,Fabiilli ML,Haworth KJ,et al.Acoustic droplet vaporization for enhancement of thermal ablation by high intensity focused ultrasound[J].Acad Radiol,2011.18(9): 1123-1132.
[9]Fabiilli ML,Haworth KJ,Fakhri NH,et al.The role of inertial cavitation in acoustic droplet vaporization[J].IEEE Trans Ultrason Ferroelectr Freq Control,2009.56(5): 1006-1017.
[10]向昱,白景峰.自带高精度定时功能的HIFU相位信号发生器[J].中国医疗器械杂志,2012.36(4):256-258.

