法舒地尔对高糖诱导人肾小管上皮细胞转分化的影响
倪连松,顾玲佳,高 倩
(1.温州医学院附属第一医院内分泌科,浙江 温州 325000;2.台州市第一人民医院内分泌科,浙江 台州318020;3.绍兴市第六人民医院内分科,浙江 绍兴 312000)
糖尿病性肾病(diabetic nephropathy,DN)是糖尿病常见的并发症之一,也是引起糖尿病患者死亡的主要原因之一。DN的发病机制目前尚未完全阐明。越来越多的研究表明,与糖尿病性肾小球病变相比,肾小管间质病变的严重程度与蛋白尿排泄量和肾功能的进行性下降有着更为紧密的联系[1-2]。研究表明,肾间质纤维化在DN的发生发展中占有重要地位,而肾小管上皮细胞-肌成纤维细胞转分化(epithelial-myofibroblast transdifferentiation,EMT)是肾间质纤维化的重要机制[3]。
近年来,随着对Rho A/Rho相关卷曲螺旋形成蛋白丝氨酸/苏氨酸激酶(Rho A/Rho-associated coiledcoil for ming protein serine/threonine kinase,Rho A/ROCK)信号通路研究的加深,该信号通路在EMT中的作用引起了人们的高度重视[4-5]。Rho A是Ras超家族中小分子G蛋白的成员之一,在GTP结合激活态和与GDP结合失活态之间相互转换,发挥其生理功能。ROCK,又称Rho激酶,是Rho A下游的主要效应因子。肾中Rho A/ROCK信号通路具有重要的功能,介导了肾小管细胞、系膜细胞和足细胞的细胞支架的重构;促成了上皮细胞间质转分化,因而在肾纤维化中起着重要的作用[6]。
目前已发现的ROCK抑制剂有十余种,其中以法舒地尔(fasudil)和Y27632的使用最广泛,可以扩张血管,降低内皮细胞的张力,改善脑组织微循环,同时可拮抗炎性因子、保护神经、抗细胞凋亡并促进神经再生等[7]。法舒地尔是唯一用于临床的ROCK选择性抑制剂,目前主要用于多种原因引起的缺血性脑血管疾病的防治。法舒地尔对DN的治疗作用已经在多种糖尿病动物模型中得到证实,可以减少尿蛋白,减少肾小球系膜外基质堆积,减轻肾小球硬化和肾间质纤维化等[8-11]。但是有关法舒地尔对高糖诱导的肾小管EMT影响的研究还鲜见报道。
为进一步探究法舒地尔对DN的治疗作用机制,本研究以高糖培养HK-2细胞观察高糖培养所诱导的EMT现象,并用不同浓度法舒地尔进行干预,探讨法舒地尔对高糖培养肾小管EMT的影响,同时检测其对结缔组织生长因子(connective tissue growth factor,CTGF)的影响,初步探讨其作用机制。
1 材料与方法
1.1 细胞、试剂和仪器
HK-2细胞购自武汉大学中国典型培养物保藏中心,编号:GDC152。盐酸法舒地尔注射液购自天津红日药业股份有限公司(产品批号:091114);DMEM培养液和胎牛血清购自美国Gibco公司;鼠抗人E-钙黏素、波形蛋白、CTGF、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、ROCK 抗体及羊抗人磷酸化-肌球蛋白磷酸酶目标亚单位1-苏氨酸696(p-MYPT1-Thr696)购自美国 Santa Cruz公司;兔抗人p-MYPT1-Thr853购自美国Cell Signaling公司;FITC标记羊抗大鼠Ig G抗体购于联科生物公司;免疫共沉淀试剂盒、辣根过氧化物酶标记二抗购自江苏省碧云天生物技术研究所。酶标仪:美国Ther mo公司;Imaglab凝胶成像系统:美国Bio-Rad公司。
1.2 HK-2细胞培养和分组
HK-2细胞常规培养在含10%胎牛血清、青霉素100 k U·L-1和链霉素100 k U·L-1的低糖(5.5 mmol·L-1D-葡萄糖)DMEM 培养液中,置于37℃,5%CO2培养箱中培养,2~3 d换液1次。为了诱导EMT,HK-2细胞在高糖(60 mmol·L-1)条件下培养72 h,该葡萄糖浓度选择参考预实验结果,时间选择参考文献[12-13]。
将HK-2细胞分为6组:正常对照组(葡萄糖5.5 mmol·L-1),高张组(葡萄糖5.5 mmol·L-1+甘露醇54.5 mmol·L-1),高糖组(葡萄糖60 mmol·L-1),高糖+法舒地尔5,10和20μmol·L-1组。
1.3 免疫共沉淀法检测HK-2细胞ROCK活性
HK-2细胞接种在10 c m细胞培养皿中,细胞培养贴壁生长至100%融合,更换为无血清培养液同步培养24 h,用含葡萄糖60 mmol·L-1的高糖培养液干预,分别于0,30 min和1,3,7,12和24 h收集细 胞[12],裂解细胞后,收集裂解液于4℃,17 949×g离心30 min,收集上清,取50μl上清用于检测总ROCK的表达并作为内参照,余上清加入10μl p-MYPT1-Thr696或10μl p-MYPT1-Thr853一抗,4℃摇床过夜,再加入充分混匀的蛋白A+G琼脂糖4℃摇床2 h以沉淀免疫复合物,用预冷的PBS洗涤沉淀3次,完成最后一次洗涤后,去除上清,加入1×SDS-PAGE电泳上样缓冲液。变性后取50μl进行10%SDS-PAGE电泳,Western蛋白质 印 迹 法 检 测 p-MYPT1-Thr696 和 p-MYPT1-Thr853的表达,用I magelab软件分析结果,以所测得的各条带的积分吸光度(integrated absor bance,IA)与相应总ROCK的IA的比值表示ROCK活性。
1.4 免疫荧光细胞化学法检测α-SMA的表达
HK-2细胞以每孔5×104细胞接种在置有爬片的24孔板内,细胞培养贴壁生长至70%融合后,更换为无血清培养液同步培养24 h,按实验分组换为不同培养液(1 ml),于72 h收集细胞爬片,4%多聚甲醛溶液固定和0.1%Triton X-100溶液穿孔细胞后用10%正常羊血清37℃封闭1 h,滴加一抗(1∶100大鼠抗人α-SMA 抗体),4℃孵育过夜,次日清洗后滴加FITC标记的二抗(1∶200羊抗大鼠Ig G抗体)避光37℃孵育30 min,用碘化丙啶溶液染色30 min,清洗后用抗荧光淬灭封片剂封片,立即用激光共聚焦显微镜观察并拍片,FITC经490 n m波长激发光激发后显示绿色荧光,PI经530 n m波长的激发光激发后显示红色。
1.5 Wester n蛋白质印迹法检测HK-2细胞E-钙黏素、波形蛋白和CTGF的表达
HK-2细胞接种于10 c m细胞培养皿中,细胞培养贴壁生长至70%融合后,更换为无血清培养液同步培养24 h,按实验分组换为不同的培养液。72 h后终止培养,裂解细胞后,收集裂解液于4℃,17 949×g离心30 min,取上清用BCA蛋白浓度测定法测定蛋白质浓度,操作按说明书进行。用5×上样缓冲液变性蛋白,取总蛋白60μg上样,用10%SDS-PAGE凝胶进行电泳后,将蛋白转印至PVDF膜。用含5%脱脂牛奶的TBST室温摇床封闭2 h,分别加入一抗即小鼠抗人E-钙黏素(1∶200),波形蛋白(1∶200),CTGF(1∶200)和β肌动蛋白(1∶2000),4℃孵育过夜。TBST洗膜后分别加入相应的辣根过氧化物酶标记的二抗(1∶1000),室温摇床孵育1 h,TBST洗膜后分别取等量ECL试剂盒溶液A和B液,混合后加于PVDF膜,避光反应 1 min,Bio-Rad 公 司 Molecular Imager Chemi DocTMXRS成像系统自动曝光扫描并用I magelab软件对条带进行分析,以所测得的各条带的IA与内参照β肌动蛋白的IA的比值表示目的蛋白的相对表达水平。
1.6 统计学分析
2 结果
2.1 高糖对HK-2细胞ROCK活性的影响
图1结果显示,与未加高糖刺激前(0 min)比较,高糖60 mmol·L-1培养3 ~24 h后 HK-2细胞p-MYPT1-Thr696和p-MYPT 1-Thr 8 5 3蛋白表达明显增加(P<0.01),即ROCK活性明显升高,提示在一定时间范围内,高糖可以刺激HK-2细胞ROCK分子活化。
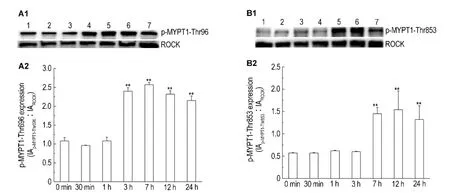
Fig.1 Effect of glucose 60 mmol·L-1 on activity of Rho-associated coiled-coil for ming pr otein serine/threonine kinase(ROCK)of HK-2 cells detected by co-immunoprecipitation assay.Lanes 1-7:HK-2 cells cultivated with glucose for 0,30 min,1,3,7,12 and 24 h,respectively.A2 and B2 were the semiquantitative results of A1 and B1,respectively.±s,n=3.**P<0.01,compared with 0 min group.
2.2 法舒地尔对高糖培养的HK-2细胞α-SMA表达的影响
如图2结果显示,与正常对照组比较(图2 A),高糖60 mmol·L-1培养 72 h 后 HK-2 细 胞 内α-SMA蛋白表达明显增多(图2C),高张组 HK-2细胞α-SMA蛋白表达无明显变化(图2B),提示高糖可成功诱导HK-2细胞表型转换。与高糖组比较,高糖+法舒地尔20μmol·L-1组α-SMA蛋白表达减少(图2D)。
2.3 法舒地尔对高糖培养的HK-2细胞E-钙黏素和波形蛋白表达的影响
如图3和图4结果显示,与正常对照组比较,高糖60 mmol·L-1培养 HK-2细胞72 h后,细胞E-钙黏素表达明显减少(P<0.01),波形蛋白表达明显增多(P<0.01),高张组无明显变化,提示高糖可以诱导HK-2细胞向肌成纤维细胞转化。与高糖组比较,法舒地尔同步干预72 h后E-钙黏素表达增多(P<0.01),波形蛋白表达减少(P<0.01),且法舒地尔20μmol·L-1组改变更为明显,法舒地尔3个浓度组组间比较差异有显著性(P<0.05),提示法舒地尔可抑制高糖诱导的HK-2细胞转分化。
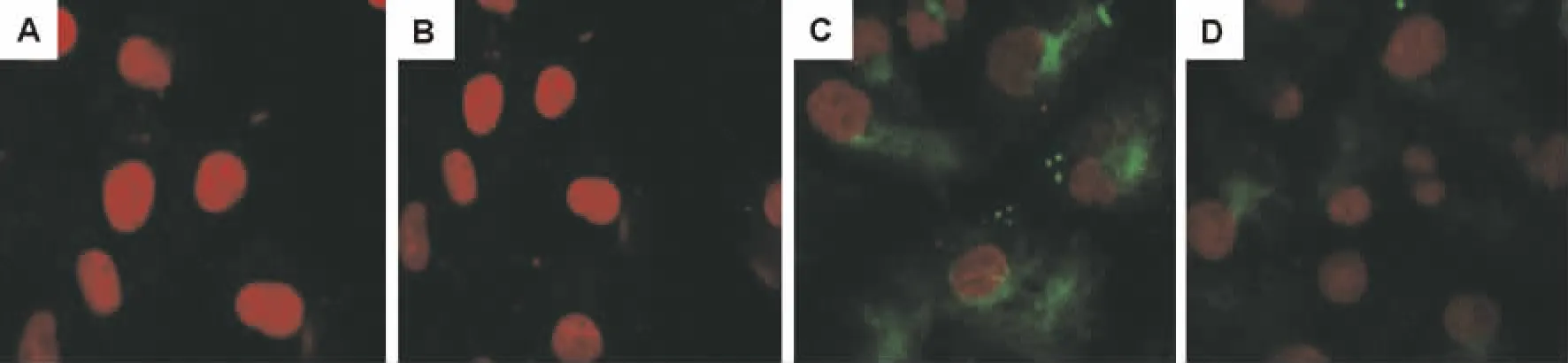
Fig.2 Effect of f asudil onα-smooth muscle actin(α-SMA)expression of HK-2 cells cultivated in glucose 60 mmol·L-1 for 72 h detected by i mmunocytochemistry(PI×400).A:nor mal control group(glucose 5.5 mmol·L-1);B:glucose 5.5 mmol·L-1+mannitol 54.5 mmol·L-1(hight tension);C:glucose 60 mmol·L-1;D:gl ucose 60 mmol·L-1+fasudil 20μmol·L-1 group.Red color showsα-SMA positive expression.
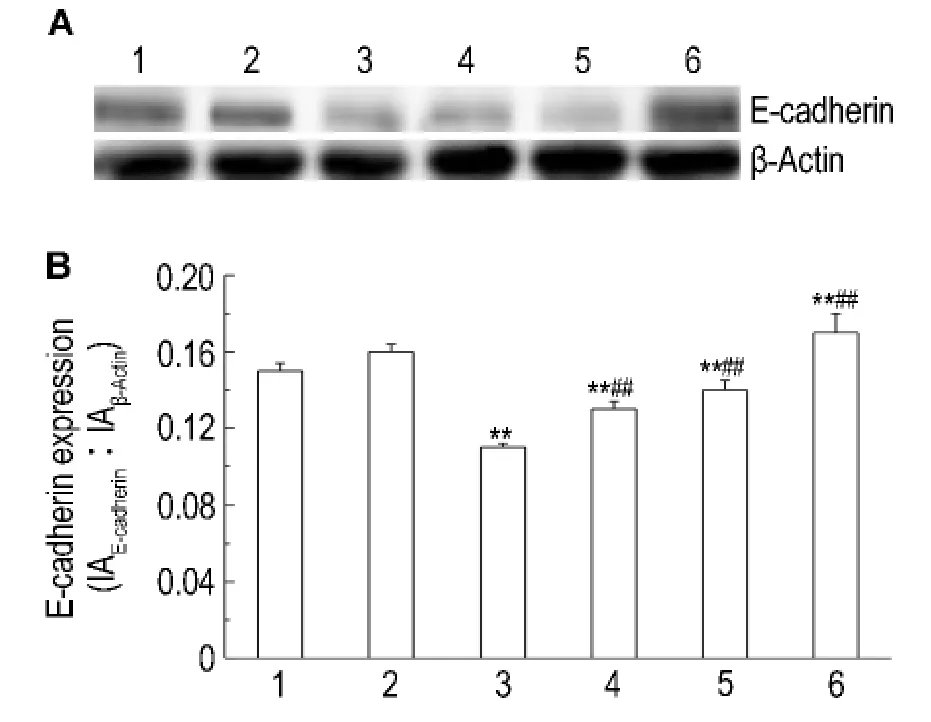
Fig.3 Effect of fasudil on E-cadherin expression of HK-2 cells cultivated in glucose 60 mmol·L-1 f or 72 h detected by Wester n blotting.B was the semiquantitative result of A.1:normal contr ol gr oup;2:high tension group;3:gl ucose 60 mmol·L-1 group;4,5 and 6:gl ucose 60 mmol·L-1+fasudil 5,10 and 20 μmol·L-1 gr oups,respectively.±s,n=3.**P<0.01,co mpared wit h nor mal contr ol gr oup;##P<0.01,co mpared wit h glucose 60 mmol·L-1 group.

Fig.4 Effect of f asudil on vi mentin expression of HK-2 cells cultivated in glucose 60 mmol·L-1 for 72 h detected by Wester n blotting.See Fig.3 f or t he legend.B was t he se miquantitative result of A.1:nor mal control group;2:high tension gr oup;3:glucose 60 mmol·L-1 group;4,5 and 6:high glucose 60 mmol·L-1+fasudil 5,10 and 20μmol·L-1 gr oup,respectively.±s,n=3.*P<0.05,**P<0.01,co mpared wit h nor mal contr ol gr oup;##P<0.01,compared with gl ucose 60 mmol·L-1 group.
2.4 法舒地尔对高糖培养的HK-2细胞CTGF表达的影响
如图5结果显示,与正常对照组比较,高糖60 mmol·L-1培养 HK-2细胞72 h后,细胞CTGF表达明显增多(P<0.01),高张组无明显变化。与高糖组比较,法舒地尔同步干预72 h后CTGF表达减少(P<0.01),且法舒地尔20μmol·L-1组减少更为明显,法舒地尔3个浓度组组间比较差异有显著性(P<0.05)。
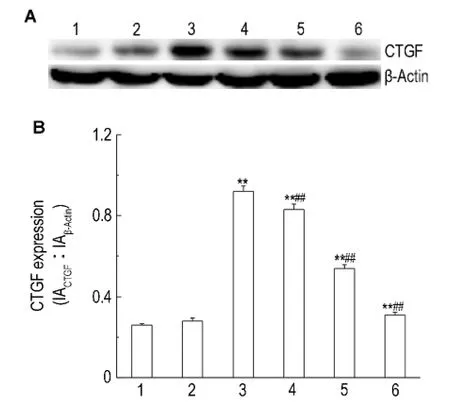
Fig.5 Effect of fasudil on connective tissue growth factor(CTGF)expression of HK-2 cells cultivated in glucose 60 mmol·L-1 for 72 h detected by Wester n blotting.See Fig.3 for t he legend.B was t he semiquantitative result of A.1:nor mal control group;2:high tension group;3:glucose 60 mmol·L-1 group;4,5 and 6:gl ucose 60 mmol·L-1+fasudil 5,10 and 20μmol·L-1 gr oups,respectively.±s,n=3.**P<0.01,co mpared wit h normal control group;##P<0.01,compared with glucose 60 mmol·L-1 group.
3 讨论
EMT是指上皮细胞在某些条件下转分化为肌成纤维细胞,表现为失去上皮细胞的标志物E-钙黏素而获得肌成纤维细胞的标志物α-SMA和波形蛋白。EMT在DN的发生发展中起重要作用[14]。本研究结果表明,HK-2细胞在高糖60 mmol·L-1条件下培养72 h后,E-钙黏素的表达减少,α-SMA和波形蛋白的表达增多,表明HK-2细胞在高糖诱导下发生EMT。因此,寻找新的干预措施逆转EMT将是治疗DN的新策略。
EMT的分子机制尚未完全阐明。Rho A/ROCK是TGF-β1的下游信号通路之一[15],是近年的研究热点。Masszi等[4]研究表明,Rho在 TGF-β1诱导的EMT中起核心作用。Patel等[5]也报道,Rho GTP酶的激活是EMT的关键步骤。本研究发现高糖60 mmol·L-1能使HK-2细胞ROCK信号通路激活,表明该通路参与了高糖诱导的EMT。因此推测,抑制ROCK信号通路可以抑制EMT。
法舒地尔是ROCK选择性抑制剂,通过与ATP竞争ROCK催化区的ATP结合位点抑制ROCK的活性[16]。一些体外实验也证实了法舒地尔在 DN 中的作用。Rodrigues-Díez等[13]报道,法舒地尔可以通过阻断Rho A/ROCK信号通路抑制血管紧张素Ⅱ引起的HK-2细胞EMT。Ma等[17]研究发现,法舒地尔通过抑制高糖所激活的人系膜细胞Rho A/ROCK信号通路减轻高糖培养的系膜细胞炎症和纤维化程度。本研究结果表明,高糖60 mmol·L-1诱导 HK-2细胞发生EMT,经法舒地尔同步干预后,细胞E-钙黏素的表达增多,α-SMA和波形蛋白的表达减少,表明法舒地尔能够抑制高糖诱导的肾小管EMT,提示法舒地尔对糖尿病性肾小管间质病变的治疗作用,也进一步阐明法舒地尔对DN的治疗作用机制。
CTGF是近年来发现与纤维化密切相关的细胞因子,它通过促进基质金属蛋白酶合成、抑制基质金属蛋白酶降解从而引起纤维化的发生[18]。有研究报道,CTGF可以导致肾小管发生EMT[19]。本研究发现,HK-2细胞在高糖60 mmol·L-1培养条件下培养72 h,CTGF的表达明显增多,提示高糖诱导HK-2细胞发生EMT可能与CTGF介导有关。本研究还发现,高糖培养的HK-2细胞经法舒地尔同步干预后,CTGF的表达减少,且随着法舒地尔浓度的增加作用更加明显,表明法舒地尔抑制EMT可能部分是通过抑制CTGF的表达而介导的。
综上所述,高糖可诱导HK-2细胞发生EMT,并能激活ROCK分子;法舒地尔能明显抑制该EMT过程;法舒地尔抑制EMT的作用可能部分是通过抑制CTGF的表达而介导的。本研究为法舒地尔的肾保护作用提供了理论依据,并进一步明确了法舒地尔在DN治疗中的应用价值。其作用机制尚需进一步探讨。
[1]Gil bert RE,Cooper ME.The tubulointerstitiu m in progressive diabetic kidney disease:more than an after math of glomer ular injur y?[J].Kidney Int,1999,56(5):1627-1637.
[2]Nangaku M.Mechanis ms of tubulointerstitial injury in t he kidney:final co mmon pat h ways to end-stage renal failure[J].Inter n Med,2004,43(1):9-17.
[3]Zeisberg M,Kalluri R.The role of epit helial-to-mesenchy mal transition in renal fibr osis[J].J Mol Med(Berl),2004,82(3):175-181.
[4]Masszi A,Di Ciano C,Sir ok mány G,Art hur WT,Rotstein OD,Wang J,et al.Central role for Rho in TGF-beta1-induced alpha-smoot h muscle actin expression during epit helialmesenchy mal transition[J].Am J Physiol Renal Physiol,2003,284(5):F911-F924.
[5]Patel S, Takagi KI, Suzuki J,Imaizu mi A,Ki mura T,Mason RM,et al.Rho GTPase activation is a key step in renal epithelial mesenchy mal transdifferentiation[J].J Am Soc Nephrol,2005,16(7):1977-1984.
[6]Hayashi K,Wakino S,Kanda T,Homma K,Sugano N,Sar uta T.Molecular mechanisms and t herapeutic strategies of chr onic renal injury:role of r ho-kinase in t he develop ment of renal injury[J].J Phar macol Sci,2006,100(1):29-33.
[7]Ta mura M,Nakao H,Yoshizaki H,Shiratsuchi M,Shigyo H,Yamada H,et al.Develop ment of specific Rho-kinase inhibitors and t heir clinical application[J].Biochi m Biophys Acta,2005,1754(1-2):245-252.
[8]Gojo A,Utsuno miya K,Taniguchi K,Yokota T,Ishizawa S,Kanazawa Y,et al.The Rho-kinase inhibitor,fasudil,attenuates diabetic nephr opat hy in streptozotocin-induced diabetic rats[J].Eur J Phar macol,2007,568(1-3):242-247.
[9]Wu G,Tu Y,Jia R.The infl uence of fasudil on t he epit helial-mesenchy mal transdifferentiation of renal tubular epit helial cells fr o m diabetic rats[J].Bio med Phar macot her,2010,64(2):124-129.
[10]Ko mers R,Oyama TT,Beard DR,Tikellis C,Xu B,Lotspeich DF,et al.Rho kinase inhibition pr otects kidneys fro m diabetic nephr opathy wit hout reducing blood pressure[J].Kidney Int,2011,79(4):432-442.
[11]Kolavennu V, Zeng L, Peng H, Wang Y,Danesh FR.Targeting of Rho A/ROCK signaling a meliorates pr ogression of diabetic nephr opat hy independent of gl ucose control[J].Diabetes,2008,57(3):714-723.
[12]Peng F,Wu D,Gao B,Ingram AJ,Zhang B,Chor neyko K,et al.Rho A/Rho-kinase contribute to t he pat hogenesis of diabetic renal disease[J].Diabetes,2008,57(6):1683-1692.
[13]Rodrigues-Díez R,Carvajal-González G,Sánchez-López E,Rodríguez-Vita J,Rodrigues Díez R,Selgas R,et al.Pharmacological modulation of epithelial mesenchy mal transition caused by angiotensinⅡ.Role of ROCK and MAPK pathways[J].Phar m Res,2008,25(10):2447-2461.
[14]Zhang W,Miao J,Ma C,Han D,Zhang Y.β-Casomorphin-7 attenuates the develop ment of nephropathy in typeⅠdiabetes via inhibition of epit helial-mesenchy mal transition of renal t ubular epit helial cells[J].Peptides,2012,36(2):186-191.
[15]Liu Y.Epit helial to mesenchy mal transition in renal fibr ogen-esis:pat hologic significance,molecular mechanis m,and t herapeutic inter vention[J].J Am Soc Nephrol,2004,15(1):1-12.
[16]Wettschureck N,Offer manns S.Rho/Rho-kinase mediated signaling in physiology and pat hophysiology[J].J Mol Med(Berl),2002,80(10):629-638.
[17]Ma DW,Wang QY,Ma XY,Li J,Guan QH,Fu Y.The effect of fasudil via Rho/ROCK signaling pat h way on t he infla mmation and fibr osis in hu man mesangial cells in high glucose mediu m[J].Chin J Inter n Med(中华内科杂志),2011,50(7):580-584.
[18]Okada H, Kikuta T, Kobayashi T,Inoue T,Kanno Y,Takigawa M,et al.Connective tissue growth factor expressed in t ubular epitheliu m plays a pivotal role in renal fibr ogenesis[J].J Am Soc Nephr ol,2005,16(1):133-143.
[19]Burns WC,Tho mas MC.The molecular mediators of type 2 epithelial to mesenchy mal transition(EMT)and their role in renal pat hophysiology[J].Expert Rev Mol Med,2010,12:e17.

