食品中苏丹红I酶联免疫检测方法的建立及酶学性质研究
匡 华, 勇倩倩, 刘丽强, 胡拥明, 宋珊珊, 胥传来
(江南大学 食品学院,江苏 无锡214122)
苏丹红类染料已被国际癌症研究机构将归为三类致癌物,即动物致癌物。肝脏是苏丹红作用的主要靶器官,此外苏丹红类物质还可引发膀胱、脾脏等脏器的肿瘤,同时苏丹红还具有遗传毒性。1995年欧盟等国家禁止苏丹红作为食品添加剂[1],频频发生的苏丹红事件,给食品安全敲响了警钟。我国也在1996年的《食品添加剂卫生标准》中明令禁止在食品工业中使用苏丹红[2]。然而,但由于苏丹红染料价廉易得,色泽鲜亮持久等特点,印度等一些国家在加工辣椒粉的过程中还容许添加苏丹红I。我国2005年在对全国18个省、市、区可能含有苏丹红的食品展开专项检查后发现,在30多家生产企业的88种食品及食品添加剂含有违禁添加物苏丹红[3-8]。关于苏丹红的检测方法,国内外常用的是高效液相色谱法,高效液相-质谱联用法、气相色谱-质谱联用法等[9-16]。做为一种快速检测技术,酶免疫检测方法具有廉价、高通量、灵敏的优点。作者通过对苏丹红Ⅰ的结构改造,制备了抗原和兔源多克隆抗体。在此基础上,建立了辣椒粉中苏丹红Ⅰ的ELISA测定方法。
1 材料与方法
1.1 材料与试剂
苏丹红Ⅰ,苏丹红Ⅱ,苏丹红Ⅲ,苏丹红Ⅳ,2-萘酚,对氨基苯丁酸,N,N-二环己基碳二亚胺(dicyclohexylcarboimide,DCC), 福氏完全佐剂和不完全佐剂等均:购自Sigma公司;苏丹红G,对位红和聚乙烯醇(PVA):购自上海晶纯试剂有限公司;聚乙二醇(PEG):购自国药集团化学试剂有限公司;聚乙烯吡咯烷酮(PVP),酪蛋白:购自北京拜尔迪生物技术有限公司;牛血清蛋白(Bovine serum albumin,BSA),卵清白蛋白(Ovalbumine,OVA):购自上海伯奥生物科技公司;辣根过氧化物酶标记的羊抗兔IgG(HRP-IgG):购自康成生物工程公司;四甲基联苯胺(TMB):购自华美生物工程公司。
1.2 仪器与设备
石英自动双重纯水蒸馏器:金坛市荣华仪器制造有限公司产品;ZD-9556水平摇床:太仓科教器材厂产品;Costar96孔8×12可拆酶标板:购自上海吉泰生物科技有限公司;Multiska Mks酶标仪以及可调试移液器为:Thermo Labsystems公司产品;电子天平AB104-N:购自上海Metller Toledo Group;U-3000紫外扫描仪:购自日本岛津公司;DHG-9070A型电热恒温鼓风干燥箱:购自上海精宏实验设备有限公司;RJ-LD-IIB低速离心机:购自无锡市瑞江分析仪器有限公司;液相色谱-质谱仪(WATERS MALDI SYNAPT Q-TOF MS):购自美国waters公司,采用电喷雾(ESI)离子源。
1.3 半抗原合成
取对氨基苯丁酸(PAPA)179.2 mg,加入4 mL 1 mol/L的盐酸,再加入NaNO2,至淀粉试纸变蓝,4℃反应30 min,得到A液。 取2-奈酚144.2 mg,溶解在无水乙醇中,得到B液。把A液缓慢滴加入B液中,溶液立即变红色,用NaOH调pH 8~9左右,产生大量絮状沉淀,室温反应1 h,离心取沉淀,烘干,备用,即得苏丹红衍生物H-1,另外,用对氨基苯甲酸(PABA)代替对氨基苯丁酸,按照上述合成途径,制备苏丹红衍生物H-2。将产物进行液相色谱-质谱鉴定。
1.4 完全抗原合成
以BSA载体蛋白为例,首先活化载体蛋白。取无水乙二胺67 mL,加双蒸水,再加入6mol/L HCL 50 mL,冰浴冷却至25℃,调pH至4.7,加入BSA 5 g,溶于25 mL纯水中,加入EDC 1.8 g,维持原温度和pH,搅拌反应2 h,加入4 mol/L醋酸缓冲液30 mL,终止反应,在4℃纯水中透析,冻干,保存备用。
称取半抗原34.2 mg,溶解在2 mL二甲基甲酰胺(DMF)中,调 pH 在 8~9,加入 DCC 25 mg,NHS 21 mg,室温反应12 h,离心取上清。将活化后的蛋白30 mg溶解在2 mL 0.05 mol/L的碳酸盐缓冲液[16]中。将半抗原溶液上清缓慢滴加到蛋白溶液中,缓慢搅拌,过夜反应。然后,将将反应液装入透析袋,4℃下用0.01 mol/L的NaHCO3溶液中透析3 d。透析后溶液经离心取上清液,分装后,在-20℃下保存。按照上述方法,制备OVA的络合物。
1.5 抗体制备和鉴定
将制备的完全抗原(BSA偶联物)做为免疫原免疫新西兰大白兔,动物免疫的方法参考文献。在第5次免疫后10天,心脏采血,分离血清,用间接酶联免疫方法(ELISA)测试血清。将OVA偶联物做为包被抗原,用方阵法测定抗原抗体的最佳稀释比[17]。采用以下的ELISA操作过程[18]:
1.5.1 包被 将包被抗原用包被缓冲液 (0.05 mol/L,pH 9.6的碳酸盐缓冲液)作系列稀释后,按列包被96孔酶标板,100 μL/孔,于4℃冰箱放置过夜。
1.5.2 封闭 取出过夜包被的酶标板回升至室温,每孔加入200 μL PBST洗涤液(含有0.05%tween-20,0.01 mol/L,pH 7.4磷酸盐缓冲液),水平摇床上振荡3 min,用力甩掉洗液并在吸水纸上拍干,继续洗涤3次。用封闭缓冲液(含有0.5%BSA的PBST溶液)封闭酶标板,200 μL/孔,于 37℃温育箱内温育2 h后取出酶标板,洗涤4次,37℃烘干待用。
1.5.3 ELISA测定 取封闭好的酶标板,对照孔中添加测定液(含有体积分数20%甲醇的磷酸盐缓冲液)50 μL/孔,测试孔中添加用样本测定液系列稀释的 苏 丹 红 标 准 溶 液 (0.1,0.2,0.5,1,2,5,10,20,50 ng/mL),50 μL/孔;每个浓度设置 5 个重复。 然后每孔添加抗体溶液,50 μL/孔,放置于37℃ 30min孵育。之后,弃去微孔板中的溶液,采取上述洗涤方法洗涤微孔板,拍干。加入酶标记抗体HRP-IgG溶液(1∶3 000 稀释),100 μL/孔,37 ℃ 30min 孵育。 反应结束后,弃去微孔中溶液,洗涤微孔板4次,拍干。加入底物液100 μL/孔[60 mg TMB溶于100 mL乙二醇;底物缓冲液(0.933 g柠檬酸+3.68 g Na2HPO4·12H2O+18 μL体积分数30%H2O2,用超纯水定容至100 mL;将两种溶液在使用前按照1∶5的体积比混匀)。将酶标板放置于暗处反应15 min,之后,加终止液(2 mol/L 硫酸溶液),50 μL/孔。 用酶标仪测定各个孔在450 nm波长下的吸光值A450,求出各浓度的B/B0值[B校正值为A实测值(均值)-A空白值(均值);B0为标准溶液为0 ng/mL时,即阴性对照孔的校正值];建立以B/B0为纵坐标,苏丹红质量浓度为横坐标的抑制曲线。半数抑制率 (IC50)为达到50%最大吸光值(Amax)所需的苏丹红浓度。
1.6 ELISA检测方法的优化 对包被液 (分别用pH 7.4的PBS缓冲液、pH 8.0的Tris-HCL缓冲液、pH 9.6的CBS缓冲液)、封闭液 (在0.05 mol/L的CBS溶液中分别加入质量分数0.1%,0.2%,0.5%的明胶、酪蛋白,聚乙烯吡咯烷酮PVP、聚乙二醇PEG等)、抗体稀释液 (在PBST溶液中加入质量分数0.1%,0.2%,0.5%的明胶,BSA)、 样品稀释液(PBS、PBST、10%甲醇 PBS、PBST+2%PVP、PBST+2%PEG、PBST+2%OVA)、反应时间(30 min、45 min、60 min)进行优化,选择Amax吸光值在1.5~1.8之间,IC50最低的条件作为最佳操作条件。
1.7 交叉反应测定
在最佳操作条件下,测定ELISA体系对苏丹红Ⅰ,苏丹红Ⅱ,苏丹红Ⅲ,苏丹红Ⅳ,对位红等类似物的IC50值,按照以下公式:交叉反应率(CR%)=苏丹红ⅠIC50值/类似物IC50值 ×100% 计算交叉反应率。
1.8 辣椒粉中苏丹红的ELISA测定
分别称取阴性辣椒粉1 g,按照5、20 ng/g两个水平进行样本添加试验,同时设定空白对照。加入甲醇5 mL萃取,混匀,超声10 min,离心去上清,收集清液。然后在剩余物中再加入5 mL甲醇重复提取一次,离心去上清,合并两次提取液,用氮气吹干,然后用ELISA样品稀释液溶解残渣,采用上述建立的ELISA方法进行检测,并计算回收率。
2 材料与方法
2.1 半抗原的鉴定
2.1.1 半抗原H-1的鉴定 图1是提纯后的1-[(4-丁酸苯)偶氮]-2-萘酚(即 H-1,相对分子质量为324)的色谱-质谱表征图。在总离子图,即图1(a)中能看到分别在6.15 min和5.26 min有2个吸收峰,苏丹红特征吸收485 nm下有特征紫外吸收。经过质谱图比较,5.26 min处为苏丹红母体物质,6.15 min 处为目标物质(H-1)。如图 1(b)中所示,在正离子检测模式下,在6.15 min处,得到分子离子峰m/z 325(M+1)的碎片,分析分子碎片符合衍生物的结构特征,液相图、质谱图相互应证表明半抗原衍生化成功。
2.1.2 半抗原H-2的鉴定 图2是提纯后的1-[(4-甲酸苯)偶氮]-2-萘酚 (H-2, 相对分子质量292)的质谱图,在总离子图,图2(a)中能看到分别在4.2 min和2.45 min有2个吸收峰,其中4.2 min处峰为目标物质H-2的色谱峰;2.45 min处的色谱峰为母体物质。在负离子检测模式下,如图2(b)所示,得到m/z 291(M-1)的分子离子峰碎片,分析分子碎片符合衍生物的结构特征,液相图、质谱图相互应证表明半抗原衍生化成功。
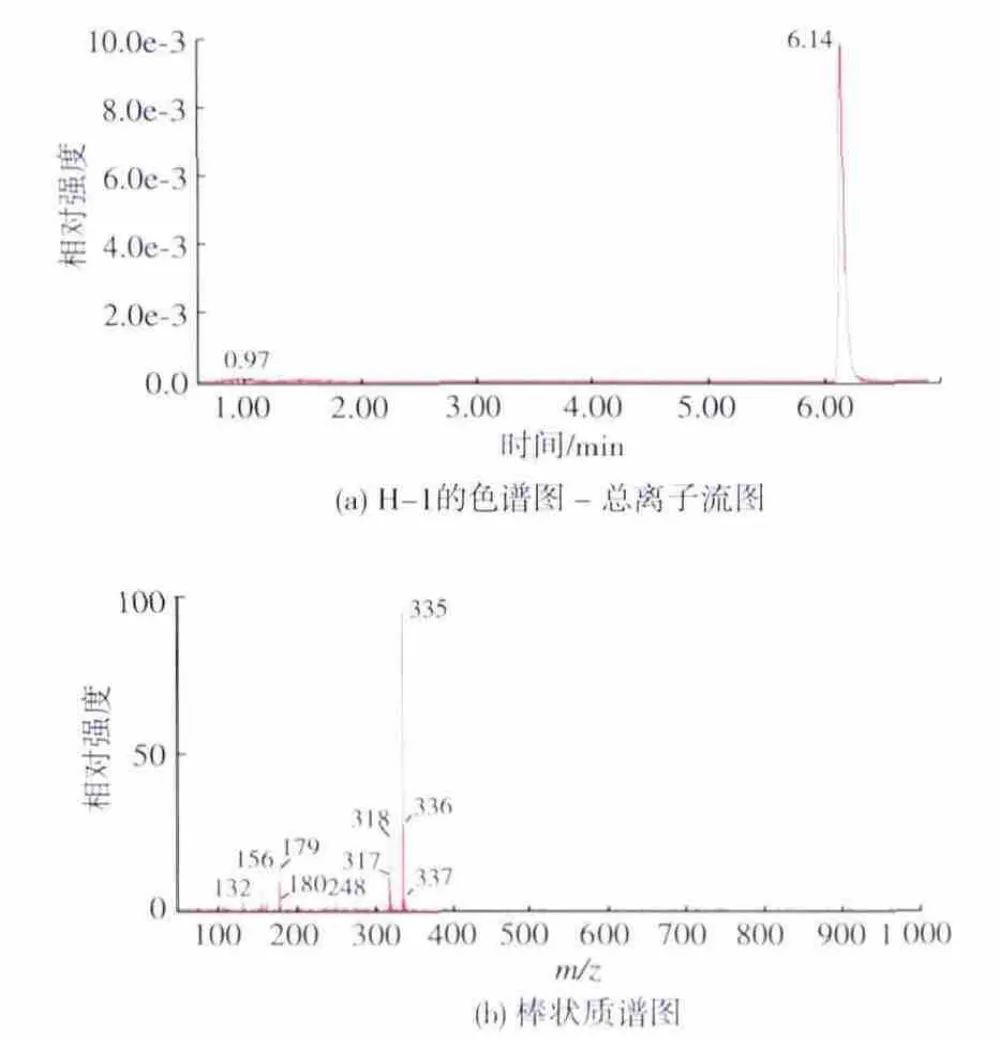
图1 半抗原H-1的质谱鉴定结果Fig.1 Identification of the H-1by LC/MS
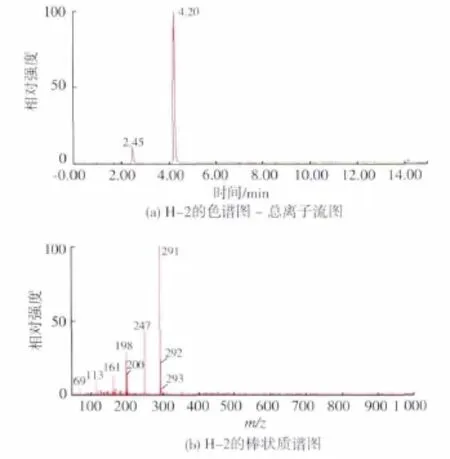
图2 半抗原H-2的色谱-质谱鉴定Fig.2 Identification of the hapten H-2 by LC/MS
2.2 完全抗原的合成和鉴定
2.2.1 紫外鉴定 以半抗原H-1(SUDAN-PABA)的偶联物鉴定为例,从图3可见,苏丹红衍生物的特征吸收波长在485 nm,BSA活化物(CBSA)的特征吸收波长为278 nm,偶联产物SUDAN-PAPACBSA分别在278 nm和485 nm都有特征吸收峰,在紫外扫描图中表现出各自光谱迭加的性质,证明偶联结合实验的成功。计算得抗原溶液的蛋白浓度为6.05 mg/mL,根据苏丹红的特征吸收峰,计算出苏丹红半抗原的摩尔数量,因而得到偶联率15.6。同样地,从图4可见-OVA偶联产物分别在278 nm和485 nm都有特征吸收峰,证明偶联成功。计算偶联率为10.4。采用上述方法同样测定了H-2衍生物(H-2-BSA,H-2-OVA的偶联率分别为 17.3和11.2)
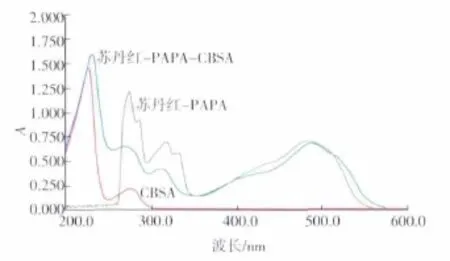
图3 完全抗原SUDAN-PAPA-CBSA的紫外扫描图谱Fig.3 Identification of the SUDAN-PAPA-CBSA by UV
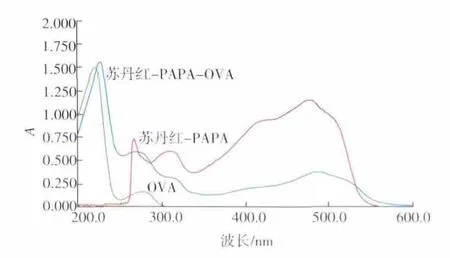
图4 完全抗原SUDAN-PABA-OVA的紫外扫描图谱Fig.4 Identification of the SUDAN-PABA-OVA by UV
2.2.2 电泳表征 以 H-1(SUDAN-PABA)的 BSA偶联物鉴定为例,如图5所示,分别将BSA和偶联物进行SDS-PAGE电泳,电泳方向是由上至下。从图中可以看出免疫原的迁移速度相比CBSA的速度要慢,进一步证明偶联成功。
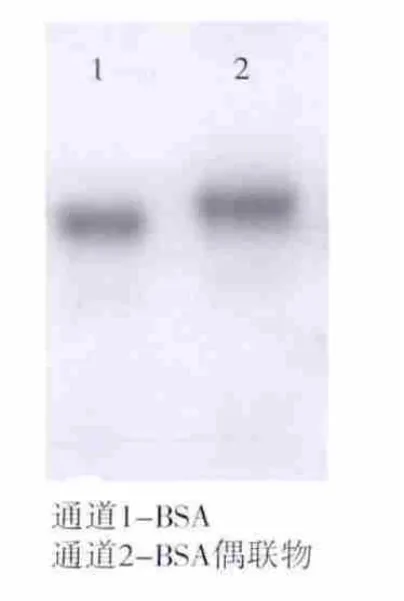
图5 免疫原电泳图Fig.5 SDS-PAGE of BSA conjugates
2.3 抗体的鉴定
以OVA偶联物做包被原,用包被缓冲液系列稀释成 1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000,兔抗血清系列稀释成 1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000 和 1∶64 000,进行方阵测试,以阳性血清的A450nm≥阴性血清的2.1倍作为抗血清的效价,测定结果可知H-1-BSA和H-2-BSA兔血清的效价为64 000。
根据ELISA检测的要求,选择吸光值在1.5~1.8,同时阳性血清的A450nm≥阴性对照孔的2.1倍做为最适工作浓度,则兔血清最佳稀释比例为1∶16 000;包被抗原稀释度为 1∶4 000。
2.4 ELISA参数的优化
2.4.1 包被液的选择 试验中比较了3种常用包被 液 :0.01 mol/L CBS、0.01 mol/L PBS 以 及 0.01 mol/L Tris-HCl对ELISA关键指标IC50和最大吸光度值(Amax)的影响,Amax/IC50愈高愈佳。从表 1可以看出,就Amax而言,碳酸盐缓冲液包被时最高,其次为PBS溶液和生理盐水。3种包被液对IC50的影响变化很大。采用Tris-HCl缓冲液时,Amax/IC50值远大于另外两者。因此,TRIS-HCl缓冲液做为本试验后续用包被溶液。
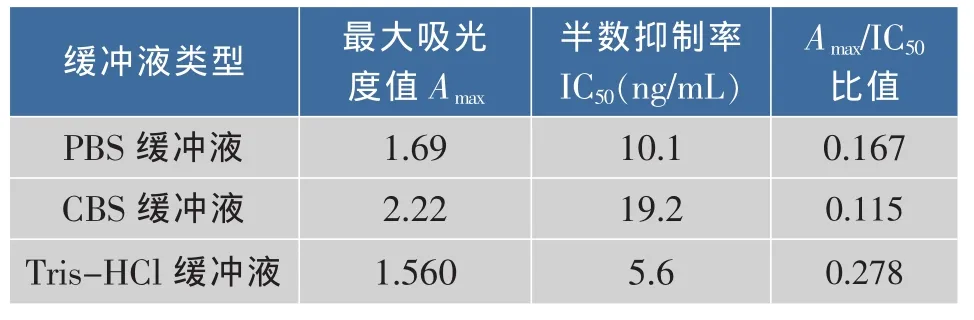
表1 包被溶液的优化Table 1 Optimization of coating buffer
2.4.2 封闭液的选择 在0.05 mol/L的CBS溶液中分别加入质量分数0.1%,0.2%,0.5%的明胶、酪蛋白、PVP、PEG。从表2看到,当使用质量分数0.5%明胶进行封闭时,所测定的IC50最低,且Amax/IC50最高,所以选择含有质量分数0.5%明胶的CBS溶液做为封闭液。
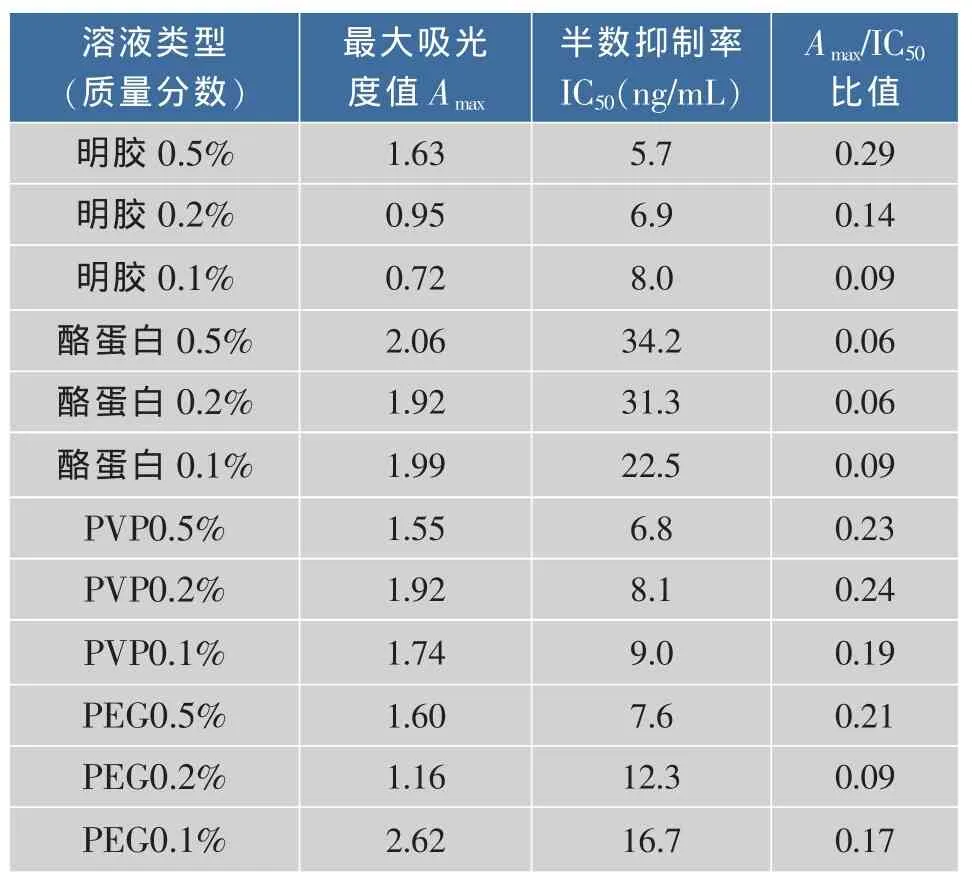
表2 封闭液的优化Table 2 Optimization of blocking solution
2.4.3 样品稀释液的选择 分别选择PBS、PBST、质量分数10%甲醇PBS、PBST+质量分数2%PVP、PBST+质量分数2%PEG、PBST+质量分数2%PVA做为样品稀释液,从表3看出,总体来讲采用PBST溶液体系的比PBS体系的效果好。当采用PBST+质量分数2%PVP的做为样品稀释液时IC50最低,Amax/IC50最高,所以选择PBST+质量分数2%PVP的做为样品稀释液。
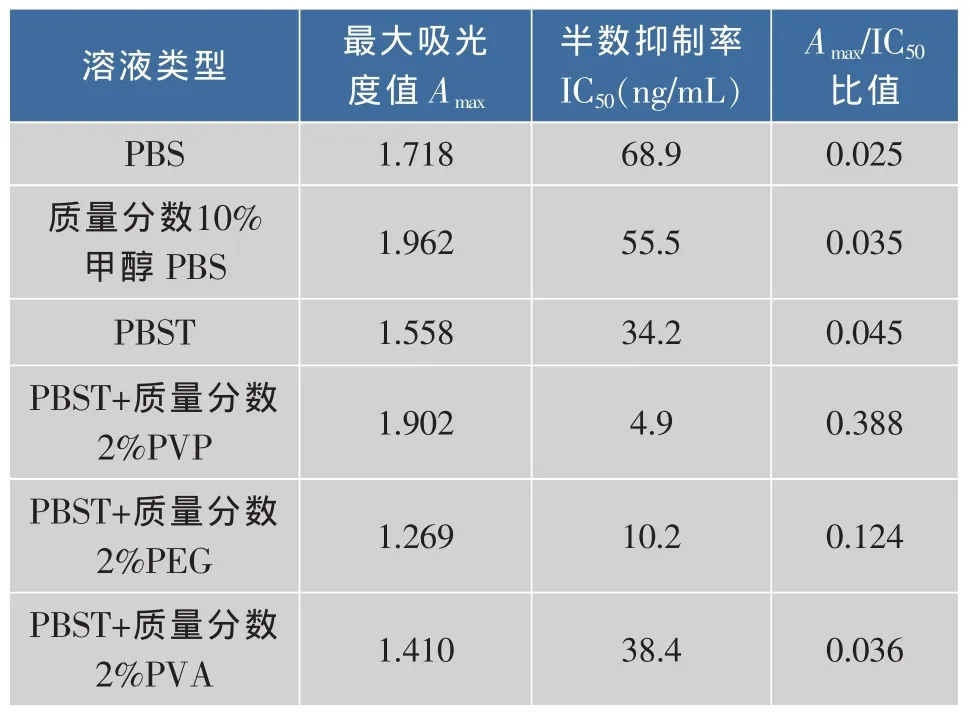
表3 样品稀释液的优化Table 3 Optimization of sample solution
2.4.4 抗体稀释液的选择 在PBST溶液中加入质量分数0.1%,0.2%,0.5%的明胶,BSA,从表4可知,抗体稀释液用PBST+0.2%BSA的条件下,IC50最低,Amax/IC50最高,所以选择PBST+质量分数0.2%BSA作为抗体稀释液。
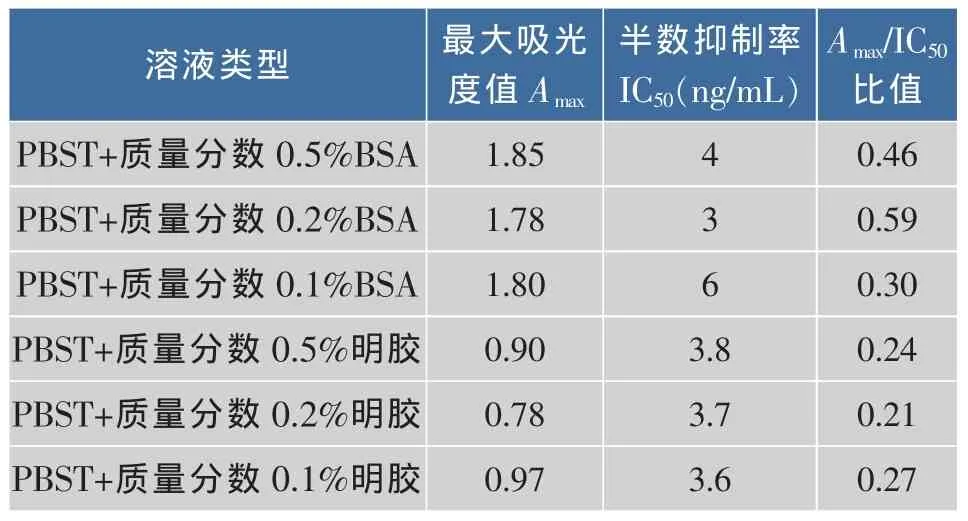
表4 抗体稀释液的优化
2.4.5 反应时间优化 加入抗血清后,设置在37℃分别选择孵育时间30,45,60 min,结果表明,随着时间的增加,最大吸光度值Amax随之增加,然而半数抑制率IC50(ng/mL)并无改善。因此将30 min做为抗血清捕获抗原的最佳孵育时间。同样地,加入酶标记抗体后,优化孵育时间(30、45、60 min),结果表明,无论是最大吸光度值Amax还是增半数抑制率IC50(ng/mL)均无无改善,因此酶标记抗体识别抗血清的反应时间亦优化为30 min。
2.5 标准抑制曲线
以B/B0为纵坐标,以苏丹红Ⅰ标准溶液浓度的对数值为横坐标作图,得到苏丹红Ⅰ的标准抑制曲线,如图6所示,IC50为3.0 ng/mL,线性范围为0.3~32.4 ng/mL,以产生20%的抑制时的苏丹红Ⅰ质量浓度x为检测限,计算为0.1 ng/mL。
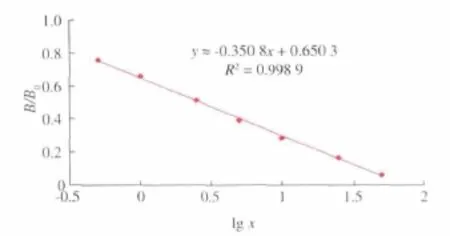
图6 ELISA标准曲线Fig.6 Standard curve of ELISA
2.6 交叉反应
在最优化的条件下,分别测定该方法对苏丹红Ⅱ、苏丹红Ⅲ、苏丹红Ⅳ、苏丹红G和对位红5个物质的半数抑制率,结果如表5所示。从表5可知,该抗体对苏丹红Ⅰ的特异性较好,对苏丹红Ⅱ、Ⅲ、G有一定的识别能力,但交叉率均小于10%。与苏丹红Ⅳ几乎没有交叉反应(<0.1%),可能的原因在于苏丹红Ⅳ在苯环对位还有一个苯环,邻位还有甲基,影响了与抗体的结合能力。由于对位红和苏丹红Ⅰ有共同的苯环偶氮结构,该抗体表现出对对位红较好的识别能力,交叉反应率达到了140%。
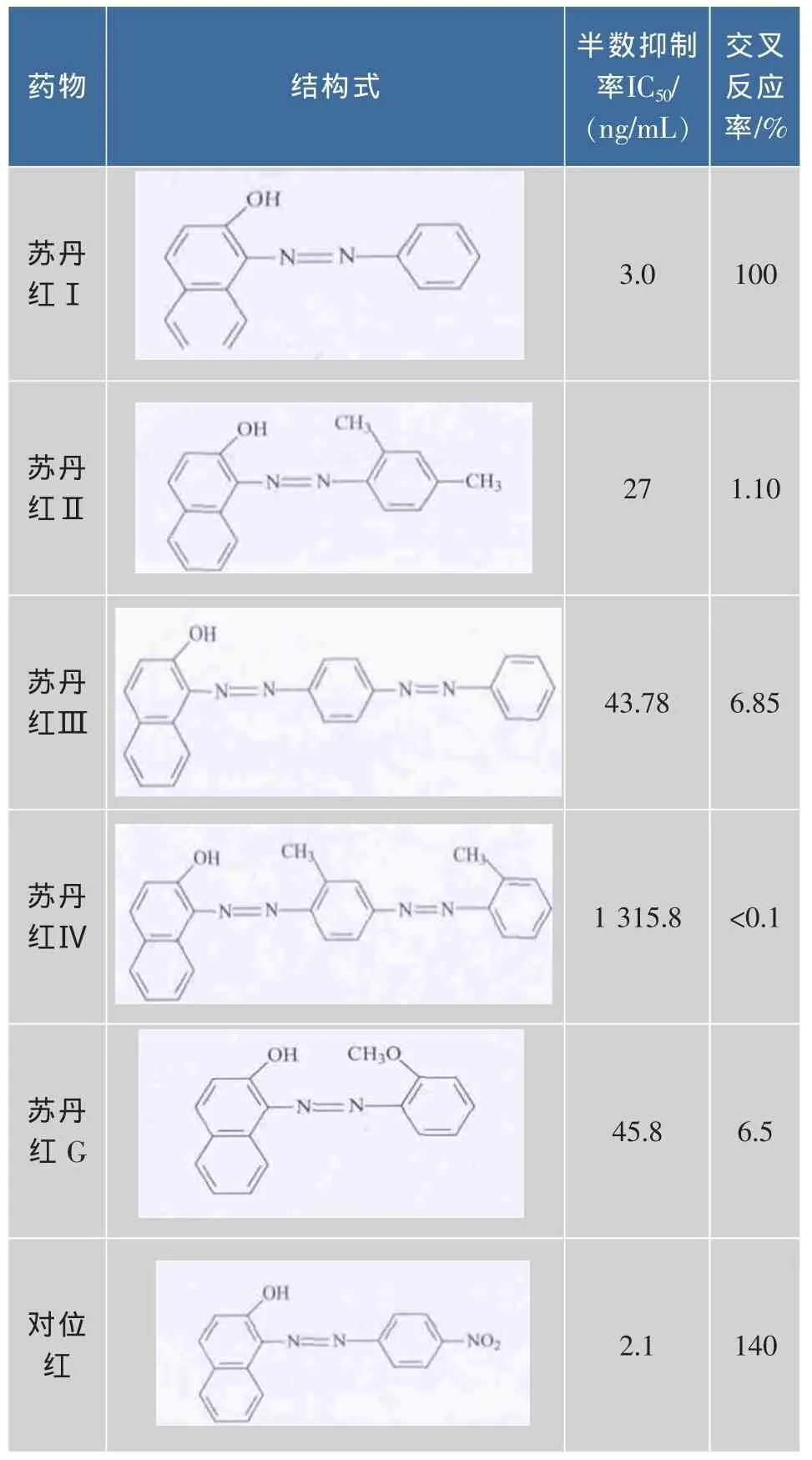
表5 交叉反应率测定Table 5 Determination of the cross-reactivity
2.7 实际样品添加回收率
由表6可见,采用本方法,辣椒粉中苏丹红Ⅰ的回收率在5 ng/g的添加水平下为90.4%,变异系数为1.80%。在20 ng/g的添加水平下为96%,变异系数为4.9%;回收率分别为和变异系数均满足残留检测要求。
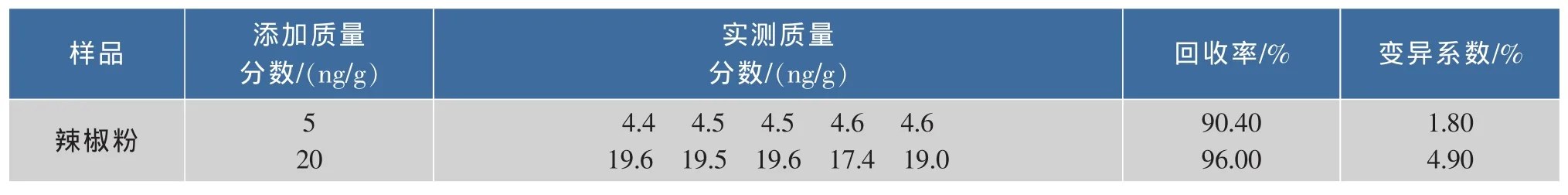
表6 辣椒粉样本添加回收率结果Table 6 Recovery results of in chili powder samples
3 结语
通过对苏丹红Ⅰ结构进行改造,制备了两个苏丹红衍生物,将其做为半抗原,分别制备了免疫原和包被抗原。通过免疫大白兔获得了兔源多克隆抗体,抗体的效价为1∶16 000。通过对影响ELISA测定的因素包括包被溶液、封闭溶液、样品稀释液以及抗体稀释液等进行优化,建立了苏丹红的ELISA测定方法,线性范围为0.3~23.4 ng/mL。交叉反应表明,作者所制备的抗体除了对苏丹红Ⅰ和对位红染料具有较好的亲和性之外,对其他苏丹红染料的识别性较差,交叉反应率均在10%以下。通过测试辣椒粉的添加样本,表明该方法适用于食品中苏丹红Ⅰ的快速筛查。
[1]Stiborovam,Martinek V,Rydlova H,et al.Sudan I is a potential carcinogen for humans:evidence for its metabolic activation and detoxication by human recombinant cytochrome P450 1A1 and liver microsomes[J].Cancer Research,2002,62(20):56,78-84.
[2]王炫,沈骎.偶氮染料-苏丹红[J].化学教育,2005,5:1-3.WANG Xuan,SHEN Jin.Azo dyestuff:sudan red[J].Chinese Journal of Chemical Education,2005,5:1-3.(in Chinese)
[3]张颖,毛华明.食品安全我们共同的期待[J].中国动物检疫,2005,22(6):20-21.ZHANG Ying,MAO Hua-ming[J].Chinese Journal of Animal Quarantine,2005,22(6):20-21.(in Chinese)
[4]主桅.国内外主要食品安全事件[J].中国动物保健,2001,11:28-29.ZHU Gui.China Animal Health,2001,11:28-29.(in Chinese)
[5]肖秀英.食用色素与食品安全[J].生活与健康,2005,9:6-7.XIAO Xiu-ying.Edible pigment and food safety[J].China Animal Health,2005,9:6-7.(in Chinese)
[6]陈兆波.农产品质量安全分子生物检测的研究现状和发展趋势[J].食品生物技术学报,2009,28(4):444-450.CHEN Zhao-bo.Molecular detection of the quality and safety of agricultural produces:advances and trends[J].Journal of Food Science and Biotechnology,2009,28(4):444-450.(in Chinese)
[7]ZHANG Yan-tu,ZHANG Zhu-jun.Development and optimization of an analytical method for the determination of Sudan dyes in hot chili pepper by high-performance liquid chromatography with on-line electro generated BrO-luminol chemiluminescence detection[J].Journal of chromatography A,2006,1192(1):34-40.
[8]Calbiani F,Careri M,Elviri L,et al.Accurate mass measurements for the confirmation of Sudan azo-dyes in hot chili products by capillary liquid chromatography-electrospray tandem quadruple orthogonal-acceleration time of flight mass spectrometry[J].Journal of Chromatography A(2004),1058(1-2),127-135.
[9]彭科怀,向仕学,汤晓勤,等.辣椒制品中苏丹红l的极谱法快速测定[J].预防医学情报杂志,2005,21(3):286-288.PENG Ke-luai,XIANG Shi-ming,TANG Xiao-qin,et al.Determination of Sudan I in chilli products by rapid polarographic Analysis[J].Journal of Preventive Medicine Information,2005,21(3):286-288.(in Chinese)
[10]Johns S M,Jickells S M,Read W A,et al.Studies on functional barriers to migration.3.Migration of benzophenone and model ink components from cartonboard to food during frozen storage and microwave heating[J].Packaging Technology and Science,2000,13(3):99-104.
[11]Sagratini G,Caprioli G,Cristalli G,et al.Determination of ink photoinitiators in packaged beverages by gas chromatography-mass spectrometry and liquid chromatography-mass spectrometry[J].Journal of Chromatography A,2008,1194(2):213-220.
[12]Rhodes M C,Bucher J R,Peckham J C,et al.Carcinogenesis studies of benzophenone in rats and mice[J].Food and Chemical Toxicology,2007,45(5):843-851.
[13]Cook N,Freeman S.Photosensitive dermatitis due to sunscreen allergy in a child[J].Australasian Journal of Dermatology,2002,43(2):133-135.
[14]Horton J K,Swinburne S,Sullivan M J.A novel rapid,single-step immunochromatographic procedure for the detection of mouse immunoglobulin[J].Journal of Immunological Methods,1991,140:131-134.
[15]McEwen S C,W D Black.Antibiotic residue prevention methods,farmmanagement,and occurrence of antibiotic residues in milk[J].Journal of Dairy Science,1991,74:2128-2137.
[16]Abraham G E.Solid-phase radioimmunoassay of estradiol-17 beta[J].The Journal of Clinical Endocrinology&Metabolism,1969,29:866-870.
[17]甘金华,邓薇,李进平,等.级强力霉素人工抗原的合成和抗体的制备[J].食品与生物技术学报,2011,30(2):316-320.GAN Jin-hual,DENG Weil,LI Jin-pin,et al.Artificial antigen synthesis and antibody preparation of doxycycline[J].Journal of Food Science and Biotechnology,2011,30(2):316-320.(in Chinese)
[18]孙海新,凌红丽,张玉兰,等.特布他林人工抗原的合成和抗体的制备[J].食品与生物技术学报,2009,28(3):371-376.SUN Hai-xinl,LING Hong-li,ZHANG Yu-lan,et al.Synthesis of terbutalin artificial antigen and preparation of anti-terbutalin antibody[J].Journal of Food Science and Biotechnology,2009,28(3):371-376.(in Chinese)

