细胞穿膜肽TAT与小鼠干细胞转录因子Oct4融合表达及纯化
王 军, 雷楗勇, 陈 蕴, 金 坚
(江南大学 药学院,江苏 无锡 214122)
Oct4是维持胚胎干细胞自我更新和多潜能性 的重要的转录因子之一,被广泛应用于细胞重编程,形成了具有类似胚胎干细胞性质的诱导多功能干细胞 IPS(induced pluripotent stem cells)[1-3]。目前,由不同量组合的Oct4、Sox2、Klf4和c-Myc等转录因子形成的细胞重编程技术,主要采用病毒包装转染的方式将转录因子整合入细胞中[4-5]。由于病毒载体转染效率和整合位点的差异,导致转录因子无法准确定量干预。作者利用细胞穿膜肽TAT可高效介导蛋白进入细胞的特征[6-7],设计和生物制备TATOct4融合蛋白,并评价其穿透细胞的能力。加入终浓度为1 mmol/L的IPTG,30℃诱导表达8 h。8 000 r/min冷冻离心收集菌体,超声破碎,离心分离上清与沉淀,进行SDS-PAGE分析。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒及细胞 TAT-Oct4基因、pET28a表达载体、BL21(DE3)原核表达菌株、NIH 3T3细胞,均由作者所在实验室保存。
1.1.2 主要试剂 Pfu DNA聚、Nco I、Xho I限制性内切酶,T4连接酶,均购自Fermentas公司;胶回收试剂盒、IPTG、卡那霉素,购于上海生工生物工程股份有限公司;Anti-6*His一抗,购自Abcam公司;Alexa Fluor 488荧光标记的二抗,购于碧云天生物技术研究所。
1.2 方法
1.2.1 TAT-Oct4目的基因的克隆 设计含Nco I和Xho I上下游引物,引物序列如下:
上游引物:5'-CATGCCATGGCAATGCATCATC ATCATCATCATTCTTC-3'
下游引物:5'-CCGCTCGAGCGGTCAGTTTGAA TGCATGGGAGAGC-3'
以TAT-Oct4基因为模板,经PCR扩增目的基因,反应条件如下:95℃预变性 5 min;95℃变性45 s,60℃退火 45 s,72℃延伸 2 min, 循环 30次;72℃延伸 10 min;最后4℃保存。
1.2.2 pET28a-TAT-Oct4表达载体的构建 将PCR扩增获得TAT-Oct4基因与pET28a空载体分别用Nco I与Xho I双酶切,经胶回收后,在T4连接酶作用下连接转化入DH5α菌株,挑取单菌落,经双酶切验证后,送至上海“生工”进一步测序验证。pET28a-TAT-Oct4重组表达载体如图1所示。1.2.3 融合蛋白TAT-Oct4的表达鉴定 将测序正确重组表达质粒转入表达菌株BL21(DE3)获得重组表达菌株,挑取单菌落接种到含50 μg/mL卡那霉素的LB培养基中,37℃培养,当OD值达到0.6,

图1 重组表达载体pET28a-TAT-Oct4图谱Fig. 1 Schematic description of recombinant expression plasmid pET28a-TAT-Oct4
1.2.4 包涵体洗涤、纯化及复性 表达产物分别经洗涤液缓冲 I(50 mmol/L的 Tris-HCl,300 mmol/L的Nacl,质量分数1%的TritonX-100,2 mmol/L的尿素,pH 8.0)和洗涤缓冲液 II(50 mmol/L的 Tris-HCl,300 mmol/L 的 Nacl,2 mol/L 的尿素,pH 8.0)洗涤后,在变性缓冲液(50 mmol/L的Tris-HCl,8 mol/L的尿素,300 mmol/L的 NaCl,25 mmol/L的咪唑,pH 8.0)中溶解TAT-Oct4包涵体。在变性条件下,利用Ni-NTA sepharose纯化,纯化条件为:上样缓冲液 A(50 mmol/L 的 Tris HCl,8 mol/L 的尿素,300 mmol/L 的 NaCl,25 mmol/L 的咪唑,pH 8.0)和洗脱缓冲液B (50 mmol/L的Tris HCl,8 mol/L的尿素,300 mmol/L 的 NaCl,250 mmol/L 的咪唑,pH 8.0)分段洗脱收集各洗脱峰进行SDS-PAGE分析。将纯化获得TAT-Oct4重组蛋白经尿素梯度透析(4,2,1,0.5,0 mol/L 的 尿 素 ,50 mmol/L 的 Tris-HCl,100 mmol/L的NaCl,质量分数 10%的甘油,300 mmol/L的精氨酸,2 mmol/L的GSH/0.2 mmol/L的 GSSG,1 mmol/L 的 EDTA,0.2 mmol/L 的 PMSF,pH 8.0)复性,最后用PBS透析3次除去其它小分子,获得具有活性的TAT-Oct4目的蛋白质。
1.2.5 细胞免疫荧光 NIH 3T3细胞培养于含质量分数10%的FBS的DMEM培养液,待细胞贴壁24 h后,加入TAT-Oct4目的蛋白共培养6h。细胞经预冷的细胞固定液(体积分数95%的乙醇和质量分数5%的乙酸)固定10 min后,用含质量分数0.2%的TritonX-100的PBS室温下穿透细胞膜15 min。经PBS漂洗及封闭处理后,加入Anti-6*His一抗(稀释比例1∶250),4℃过夜孵育。PBS洗涤后,加入相应的Alexa Fluor 488荧光标记的二抗(稀释比例1∶500)室温处理1 h。细胞核经DAPI复染定位后,在Nikon TE 2000型荧光显微镜下观察拍照。
2 结果与讨论
2.1 目的基因TAT-Oct4扩增及构建
PCR扩增TAT-Oct4目的基因经质量分数1.5%DNA琼脂糖凝胶电泳分析,可见其相对分子质量大小与理论值1 158 bp接近,如图2所示。获得的重组表达质粒pET28a-TAT-Oct4经Nco I和Xho I双酶切,可形成约有5 300 bp的载体片段和1 158 bp的TAT-Oct4目的基因片段(见图3),结果与理论值相符。重组质粒送至上海“生工”测序,其测序结果与理论序列完全一致。

图2 TAT-Oct4基因的扩增结果Fig.2 Result of TAT-Oct4 amplification

图3 重组质粒pET28a-TAT-Oct4双酶切验证Fig.3 Double digestion result of recombinant plasmid pET28a-TAT-Oct4
2.2 融合蛋白TAT-Oct4表达产物鉴定
含有pET28a-TAT-Oct4宿主菌经IPTG诱导表达后,经质量分数15%SDS-PAGE分析,在相对分子质量约45 kDa处有特异性蛋白条带,与理论值相符(见图4)。超声破碎后,分离收集上清与沉淀分别进行SDS-PAGE分析,可以看到沉淀中含有大量目的蛋白质(见图5),由此可见目的蛋白质主要以包涵体形式表达。
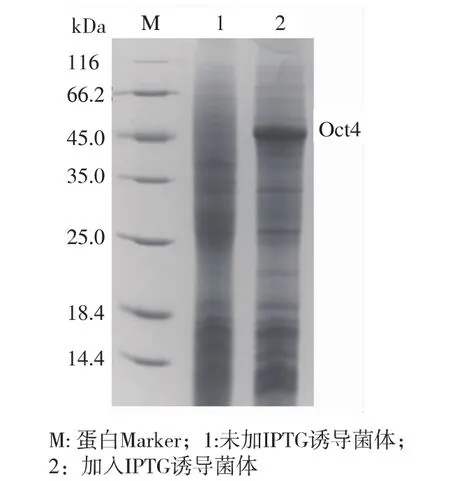
图4 融合蛋白TAT-Oct4表达SDS-PAGE分析Fig.4 SDS-PAGE analysis of TAT-Oct4 fusion protein expression in E.coli

图5 TAT-Oct4破碎上清与沉淀SDS-PAGE分析Fig.5 SDS-PAGE analysis of TAT-Oct4 supernatant and pellets after lysis
2.3 TAT-Oct4纯化及复性收率
在分子设计时,上游引物引入His标签,方便目的蛋白质使用镍离子亲和柱进行分离纯化。TATOct4重组蛋白质在变性条件下,经镍柱分段洗脱后,洗脱收集峰进行质量分数15%SDS-PAGE分析,如图6所示,在100 mmol/L咪唑洗脱条件下(泳道6与7),可获得纯度90%以上的目的蛋白质。同时也可观察到,整个纯化过程中杂蛋白相对较少,说明包涵体经洗涤后,其纯度已经相对较高。研究表明,在包涵体复性过程中,降低蛋白质初始浓度和化学添加剂如甘油,可有效减少蛋白质分子之间的聚集,从而提高复性收率[8]。同时对于含有二硫键的蛋白质,引入氧化还原体系GSH/GSSG能促进蛋白质在复性过程中正确折叠[9]。作者采用尿素梯度透析复性,同时加入促进复性的化学添加物,最终TAT-Oct4平均收率8.8%,同时可观察到复性蛋白初始浓度越高,其收率越低,见表1。

图6 TAT-Oct4纯化产物SDS-PAGE分析Fig.6 SDS-PAGE analysis of TAT-Oct4 after purification

表1 TAT-Oct4复性收率Table 1 Refolding filed of TAT-Oct4 using urea gradient dialysis
2.4 TAT介导Oct4穿透细胞能力
细胞穿膜肽(cell penetrating peptides)是一类富含精氨酸或赖氨酸[10],并且能将大分子物质携带到细胞胞浆甚至细胞核内部的一类短肽[11]。常用的有TAT(YGRKKRRQRRR)和人工合成的多聚精氨酸或赖氨酸。作者在Oct4的N端引入细胞穿膜肽TAT介导其快速进入细胞。NIH 3T3与重组蛋白TAT-Oct4(终质量浓度 6 μg/mL)共培养 6 h 后,在荧光显微镜下观察,近100%的细胞含有TAT-Oct4融合蛋白,并集中分布于细胞核内(如图7(b))。对照组(图 7(a))加入相应的荧光标记二抗。

图7 TAT-Oct4穿透细胞免疫荧光分析Fig.7 ImmunocytochemistryanalysisofTAT-Oct4 penetrating cells
3 结语
诱导多功能干细胞的产生,避开了干细胞伦理和免疫排斥两大难题[12],然而利用病毒技术获得的诱导多功能干细胞具有致瘤的风险,因此限制其临床应用[13-14]。作者成功构建并制备了TAT-Oct4融合蛋白,镍柱纯化后,其纯度高达90%。通过尿素梯度透析复性的方法,TAT-Oct4的平均收率为8.8%。同时验证了细胞穿膜肽TAT能高效地将Oct4转导进细胞内,为建立蛋白质诱导IPS奠定了基础。然而TAT-Oct4在大肠杆菌中的表达主要以包涵体形式存在,其可溶性表达有待进一步摸索与改造。
[1]郑彭生,曹浩泽.Oct4基因的研究进展[J].西安交通大学学报,2010,31(5):521-526.ZHENG PENG-sheng,CAO Hao-zhe.Advances of Oct4 gene research[J].Journal of Xi'an Jiao tong University:Medical Sciences,2010,31(5):521-526.(in Chinese)
[2]Pan G J,Chang Z Y,Scholer H R,et al.Stem cell pluripotency and transcription factor Oct4[J].Cell Research,2002,12(5):321-329.
[3]Shi G,Jin Y.Role of Oct4 in maintaining and regaining stem cell pluripotency[J].Stem Cell Research,2010,1(5):39-47.
[4]Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.
[5]Yu J,Vodyanik M A.Induced pluripotent stem cell lines derived from human somatic cells[J].Science,2007,318(58):1917-1920.
[6]罗海兰,毋辉玲,路君.TAT-Mafa融合蛋白诱导小肠细胞系IEC-6表达胰岛素[J].生物技术通报,2008(5):141-144.LUO Hai-lan,WU Hui-ling,LU Jun.TAT-Mafa inducing intestinal epithelial cells IEC-6 into insulin positive cells[J].Biotechnology Bulletin,2008(5):141-144.(in Chinese)
[7]Ziegler A,Seelig J.High affinity of the cell-penetrating peptide HIV-1 Tat-PTD for DNA[J].Biochemistry,2007,46(27):8138-8145.
[8]Guise A D,Chaudhuri J B.Initial protein concentration and residual denaturant concentration strongly affect the batch refolding of hen egg white lysozyme[J].Biotechnology and Bioprocess Engineering,2001(6):410-418.
[9]Alibolandi M,Mirzahoseini H.Chemical assistance in refolding of bacterial inclusion bodies[J].Biochemistry Research International,2011(1):631607-631612.
[10]吴永红,张成岗.HIV-1 TAT蛋白转导肽的研究进展[J].中国生物工程杂志,2002,30(10):66-73.WU Yong-hong,ZHANG Cheng-gang.Current progress on the HIV-1 TAT protein transduction peptide [J].China Biotechnology,2010,30(10):66-73.(in Chinese)
[11]El-Sayed A,Futaki S,Harashima H.Delivery of macromolecules using arginine-rich cell-penetrating peptides:ways to overcome endosomal entrapment[J].Aaps Journals,2009,11(1):13-22.
[12]Lee H,Park J,Forget B G,et al.Induced pluripotent stem cells in regenerative medicine:an argument for continued research on human embryonic stem cells[J].Regenerative Medicine,2009,4(5):759-769.
[13]Zhang G,Shang B,Yang P,et al.Induced pluripotent stem cell consensus genes:implication for the risk of tumorigenesis and cancers in induced pluripotent stem cell therapy[J].Stem Cells Development,2012,21(6):955-964.
[14]Sipp D.Challenges in the clinical application of induced pluripotent stem cells[J].Stem Cell Research and Therapy,2010,1(1):9.

