细胞间粘附因子-1与肿瘤侵袭转移的关系
许 燕 冷 静
(1. 泰州职业技术学院 医学技术学院,江苏 泰州 225300;
2. 南京医科大学肿瘤中心 病理学系,江苏 南京 210029)
肿瘤的侵袭和转移是癌症患者常见的死亡原因之一,也是决定肿瘤患者预后的关键因素之一。肿瘤的侵袭和转移涉及到肿瘤细胞从原发部位脱离后向周围和远处组织扩散形成另一肿瘤的过程[1]。
恶性肿瘤侵袭和转移的确切机制迄今尚未明确。在肿瘤侵袭转移的过程中,粘附分子在多个环节中(如肿瘤细胞从母瘤脱离、侵入和穿出血管的过程中),都发挥了重要作用[2]。近十年来,人们逐渐发现一些细胞粘附分子与肿瘤的扩散、 转移有关[3]。
ICAM-1(Intercellular adhesion molecule-1)是一种分布最为广泛的细胞间粘附分子,其介导了细胞之间、胞外基质和细胞之间的相互结合、相互粘附[4],它是免疫球蛋白超家族成员之一[5,6]。生理条件下,ICAM-1在多种细胞中均有表达[7],如淋巴细胞、内皮细胞、单核细胞中都可以检测到ICAM-1[8]。近几年研究表明,ICAM-1在人类多种肿瘤细胞中呈现高表达[9]。
1 ICAM-1的结构和表达
ICAM-1是最早被发现的免疫蛋白超家族粘附分子。ICAM-1 蛋白主要由三个部分组成:胞外区、跨膜区和胞内区。ICAM-1 的胞外区域主要包含了5个免疫球蛋白样结构域(D1-D5)。ICAM-1是分布最为广泛的细胞间粘附分子,可普遍分布在多种细胞表面。但在病理状态下,ICAM-1的表达还会受到一些外在因素如炎症因子的调节,细胞释放各种炎症因子如IFN-γ,IL-1 和TNF-α等,均能够促进白细胞、内皮细胞、上皮细胞和成纤维细胞中ICAM-1的表达。ICAM-1主要是通过与其配体LFA-1或者Mac-1的特异性结合而发挥其生理活性。与配体结合后,ICAM-1在炎症反应的介导,肿瘤的侵袭转移等一些重要的生理和病理过程中发挥着十分关键的作用。
2 ICAM-1与炎症
炎症过程的一个重要特征就是白细胞粘附、穿过血管内皮细胞,向炎症部位渗入。这个过程的一个重要分子基础是白细胞与血管内皮细胞粘附分子的相互作用。ICAM-1是参与这一过程的重要分子之一,促使白细胞向炎症部位聚集。
在炎症反应过程中, 白细胞的迁移主要包括以下几个过程,如图1所示。
(1)白细胞与血管内皮细胞相互识别。(2)白细胞沿着血管内皮细胞表面滚动:白细胞与血管内皮细胞相互识别后,白细胞会向血管内皮细胞运动,与内皮细胞结合从而沿着血管内皮滚动前行。(3)白细胞与血管内皮细胞的紧密粘附并活化。(4)白细胞穿过血管内皮细胞到达炎症部位:在ICAM-1介导白细胞与内皮细胞紧密结合后,白细胞可以穿过血管内皮间隙到达炎症部位,杀灭病原菌和降解坏死组织,发挥生理学效应。
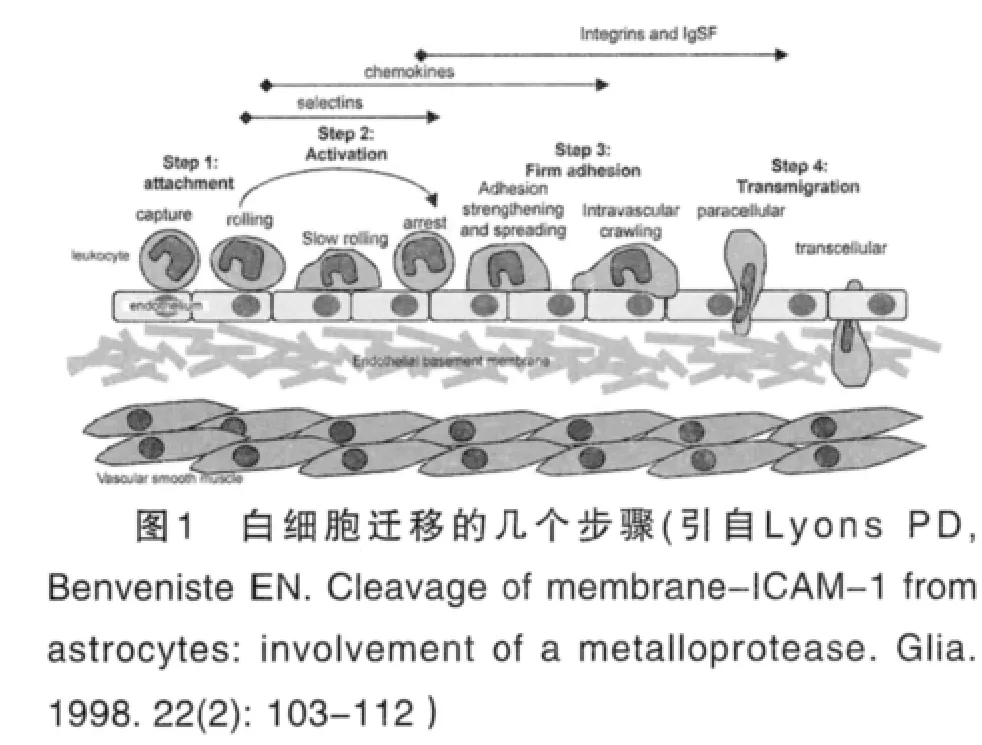
由此可见,炎症的整个过程与血管内皮细胞表面ICAM-1分子的表达是密不可分的。
3 ICAM-1与肿瘤侵袭转移
恶性肿瘤最重要的生物学特征是其对邻近正常组织的浸润及其远处转移。肿瘤转移是恶性肿瘤细胞从原发部位,经过淋巴道、血道继而到达其他部位,继续增生的过程。
肿瘤的转移包括多个步骤,但目前关于肿瘤转移的机制仍然不是十分明确。研究发现,肿瘤转移依次包括以下几个阶段:肿瘤细胞向血管的运动,肿瘤细胞在血管中的滚动,与血管内皮细胞的紧密粘附并活化,穿过血管到达新的器官或者组织,在新的部位继续增生,这个过程与炎症反应中白细胞迁移的过程几乎完全相同。
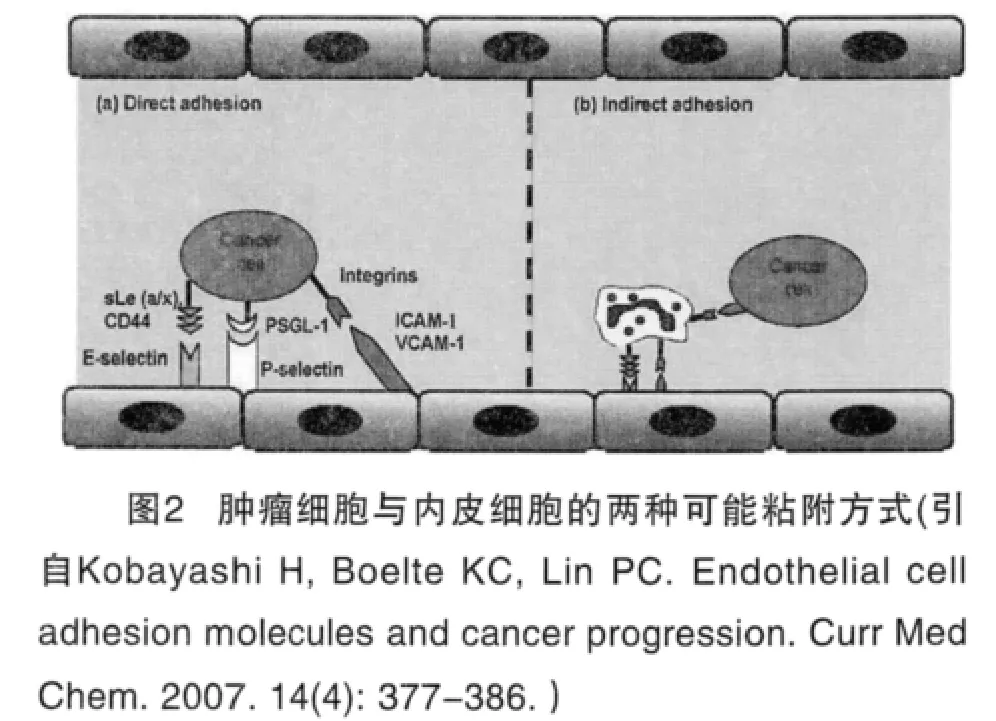
肿瘤细胞在向血管迁移的过程中,依次穿过基底膜和血管内皮细胞进入到血液循环。肿瘤细胞在血液循环过程中到达靶器官时,可以直接或者间接与血管内皮细胞粘附(如图2所示),继而肿瘤细胞穿过血管到达新的部位,形成转移灶。
肿瘤细胞与内皮细胞的粘附有两种方式:
一是通过内皮细胞表面的粘附分子ICAM-1与肿瘤细胞表面的整合素蛋白(Integrins)发生特异性识别和结合,促进了肿瘤细胞与基底膜和细胞外间质的粘附,促使肿瘤细胞突破基底膜向间质浸润,形成转移。
二是肿瘤细胞可以借助中性粒细胞的介导而与内皮细胞间接粘附,这种间接粘附是通过肿瘤细胞表达的ICAM-1与中性粒细胞表面的整合素蛋白发生特异性识别结合,而整合素蛋白又与内皮细胞表面的ICAM-1分子识别结合后实现的。
总之,不管是肿瘤细胞与内皮细胞的哪一种粘附过程,细胞间粘附分子ICAM-1的作用都是举足轻重的。
除此之外,也有学者认为,在肿瘤经血道转移的过程中,由于恶性肿瘤组织的肿瘤浸润性淋巴细胞LFA-1的表达为阳性,高表达1CAM-1的肿瘤细胞可以通过与LFA-1的结合,从而使肿瘤细胞与肿瘤浸润性淋巴细胞紧密结合,这可能导致肿瘤细胞之间粘附力下降,从而易于随淋巴细胞的迁移发生远处转移。
另外,还有推测认为ICAM-1表达阳性的肿瘤细胞在血液循环中通过ICAM-1与LFA-1的相互作用,使肿瘤细胞与外周血淋巴细胞形成栓子,使其易于在循环中逃避机体的免疫排斥作用,使细胞毒性的T细胞不能有效的杀死肿瘤细胞。
总而言之,ICAM-1与肿瘤侵袭转移的关系十分密切,而ICAM-1与多种肿瘤的侵袭转移也是近年来研究的热点。
Finzel[10]等人报道细胞间粘附分子ICAM-1具有介导肺癌细胞转移的作用。研究证实血液中ICAM-1蛋白的含量可能与非小细胞肺癌的浸润、转移及复发相关[11]。有学者发现ICAM-I siRNA可抑制人纤维肉瘤细胞中ICAM-1的表达,从而抑制人纤维肉瘤细胞向血管内皮细胞粘附,从而减少肿瘤转移的发生[12]。在研究黑色素瘤时,人们注意到ICAM-1虽然有助于单核细胞与肿瘤细胞在癌巢中粘附、结合,但这种结合削弱了肿瘤细胞间的连接,使肿瘤细胞易于从癌巢上脱落,发生远处转移[13]。除此之外,ICAM-1蛋白的表达增高与胃癌[14]、子宫颈癌[15]等的浸润和转移情况密切相关。在大肠癌的研究中发现,大肠癌中ICAM-l表达逐渐降低可促进癌细胞从肿瘤组织中脱落下来,而其表达上升则促使癌细胞粘附于淋巴管内皮细胞,进而侵袭到了淋巴管而实现淋巴道的转移[16]。
大量研究也表明,ICAM-1与肝癌转移的关系甚为密切。有报道在肝癌组织中,ICAM-1的表达水平比癌旁组织显著升高。在人肝癌细胞转移的裸鼠模型中,在癌转移形成前后,癌组织ICAM-1的表达水平差异显著,转移建立后ICAM-1的表达水平明显上调[17],干预肝癌细胞ICAM-1的表达,可抑制转移的形成[18]。
4 展望
恶性肿瘤的转移复发是恶性肿瘤研究的难题。ICAM一1与其配体相互结合,在癌细胞脱离原发灶向远端转移过程中起重要作用,其异常表达与肿瘤的侵袭转移密切相关,检测ICAM-1表达水平有助于评价肿瘤的侵袭转移,同时也为筛选新的抗肿瘤靶点带来重要实用价值。
[1]Arvelo F, Cotte C. Metalloproteinases in tumor progression.Review[J]. Invest Clin,2006, 47(2): 185-205.
[2]Manten-Horst E, Danen EH, Smit L, et al. Expression of CD44 splice variants in human cutaneous melanoma and melanoma cell lines is related to tumor progression and metastatic potential[J].Int J Cancer,1995,64(3): 182-188.
[3]Jiang WG, Puntis MC, Hallett MB. Molecular and cellular basis of cancer invasion and metastasis: implications for treatment.Br J Surg,1994,81(11): 1576-1590.
[4]Hood JD, Cheresh DA. Role of integrins in cell invasion and migration[J]. Nat Rev Cancer,2002,2(2): 91-100.
[5]Diamond MS, Staunton DE, de Fougerolles AR, et al. ICAM-1(CD54): a counter-receptor for Mac-1 (CD11b/CD18)[J].J Cell Biol,1990,111(6 Pt 2): 3129-3139.
[6]Pietruczuk M, Pietruczuk A, Pancewicz S, Hermanowska-Szpakowicz T.ICAM-1:structure,biological role and clinical significance[J].Pol Merkur Lekarski,2004,17(101): 507-511.
[7]De Stolpe A v, der Saag PT v. Intercellular adhesion molecule-1[J].J Mol Med (Berl),1996,74(1): 13-33.
[8]Burt AD, Le BB, Balabaud C, Bioulac-Sage P. Morphologic investigation of sinusoidal cells[J].Semin Liver Dis,1993,13(1): 21-38.
[9]O'Hanlon DM, Fitzsimons H, Lynch J, Tormey S, Malone C, Given HF.Soluble adhesion molecules (E-selectin, ICAM-1 and VCAM-1)in breast carcinoma[J].Eur J Cancer,2002,38(17): 2252-2257.
[10]Finzel AH, Reininger AJ, Bode PA, Wurzinger LJ. ICAM-1 supports adhesion of human small-cell lung carcinoma to endothelialcells[J].Clin Exp Metastasis,2004,21(3): 185-189.
[11]王凤玲,黄佳滨.外周血LFA-1和ICAM-1在非小细胞肺癌中的临床意义及表达[J].黑龙江医药科学,2010,(02):8-9.
[12]Park JS, Kim KM, Kim MH, et al. Resveratrol inhibits tumor cell adhesion to endothelial cells by blocking ICAM-1 expression[J]. Anticancer Res,2009,29(1): 355-362.
[13]Santarosa M, Favaro D, Quaia M, et al. Expression and release of intercellular adhesion molecule-1 in renalcancer patients[J]. Int J Cancer,1995,62(3): 271-275.
[14]Kaihara A, Iwagaki H, Gouchi A,et al.Soluble intercellular adhesion molecule-1 and natural killer cell activity in astric cancer patients[J].Res Commun Mol Pathol Pharmacol,1998,100(3): 283-300.
[15]GUO J,Si L,Wang Y.An in-situ study on immunostimulatory molecules in cancer cells within the cervical carcinoma tissues[J].Zhong Hua Yi Xue ZaZhi,2000, 80(5):342-345.
[16]徐胜美,马红梅,郭东.ICAM-1蛋白的表达与大肠癌侵袭转移的相关性[J].中国组织化学与细胞化学杂志,2010,19(2) :172-175.
[17]Verly RM, Rodrigues MA, Daghastanli KR, et al. Effect of cholesterol on the interaction of the amphibian antimicrobial peptide DD K with liposomes[J].Peptides,2008,29(1): 15-24.
[18]Arteta B, Lasuen N, Lopategi A, Sveinbjornsson B, Smedsrod B, Vidal-Vanaclocha F. Colon carcinoma cell interaction with liver sinusoidal endothelium inhibits organ-specific antitumor immunity through interleukin-1-induced mannose receptor in mice[J]. Hepatology,2010,51(6): 2172-2182.

