PPARα、PPARγ 在左卡尼汀改善结肠癌小鼠恶病质中的作用*
张 祎 易苏红 蒋 芳 仇月华 陈汉章 刘 苏& 朱 樑
第二军医大学附属长征医院消化科1 (200003) 上海市闸北区中心医院消化科2 病理科3
恶病质是晚期恶性肿瘤患者的常见并发症,病死率高达80%,目前认为全身慢性炎症和代谢紊乱在恶病质的发生、发展中起重要作用。左卡尼汀(LC)是人体细胞的一种基本成分,是脂肪酸代谢必需的辅助因子。有研究[1,2]结果显示,肿瘤恶病质患者体内血清LC 含量严重不足,补充外源性LC 可改善恶病质状态。过氧化物酶体增殖物激活受体(PPAR)具有调节机体脂质代谢等的生物学功能。本研究通过补充外源性LC 干预结肠癌小鼠恶病质模型,并观察肝脏PPARα、PPARγ 表达,旨在探讨PPARα、PPARγ 在LC 改善结肠癌小鼠恶病质中的作用。
材料与方法
一、实验动物和主要试剂
36 只SPF 级健康雄性BALB/c 小鼠由上海第二军医大学动物中心提供,体质量22~26 g,常规喂养。
LC(东北制药总厂);左卡尼汀棕榈酸酰基转移酶(CPT)抑制剂(ICL)乙莫克舍(上海洽姆仪器科技有限公司);小鼠结肠腺癌Colon26 实体肿瘤(上海医药工业研究院);肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6 ELISA 试剂盒(R&D 公司);TRIzol(Invitrogen 公司);一步法SYBR Green Ⅰ实时荧光定量PCR 试剂盒(Takara);PPARα 上游引物为5'-CTG TGG GCT CAC TGT TCT-3’,下游为5'-AGG GCT CAT CCT GTC TTT-3’,片度长度164 bp,PPARγ 上游引物为5'-GCC CAA GTT CGA GTT TGC-3’,下游为5'-CTG GCT GTC AGG GTG GTT-3’,片段长度193 bp,GAPDH 上游引物为5'-TGG TGG ACC TCA TGG CCT AC-3’,下游为5'-GCA ACT GAG GGC CTC TCT-3’,片段长度203 bp,均由生工生物工程(上海)股份有限公司合成;PPARα、PPARγ和β-actin 抗体(美国Abcam 公司)。
二、实验方法
1.结肠癌小鼠恶病质模型建立:将36 只小鼠随机分为恶病质模型组(TB)(n=24)、正常对照组(NTB)(n=12),小鼠分笼饲养,每笼1 只。取新鲜Colon26 实体肿瘤组织,每50 mg 肿瘤组织中加入0.1 mL 0.9% NaCl 溶液,制成浓度约1 ×107/mL 的细胞悬液。TB组小鼠皮下注射Colon26 结肠腺癌细胞悬液0.1 mL,NTB组小鼠常规饲养,不予任何处理。接种后第11 d,两组各取6 只小鼠处死,测定生存状态、体质量、摄食量(固定每天上午10 时给予500 g 饲料,次日上午11 时测定盒内剩余饲料,每日摄食量=500 g -次日剩余饲料重量)、去瘤体质量、左侧腓肠肌质量(自肌肉起点至终点全部取出)、双侧附睾脂肪质量(用剪刀剥离全部分离取出),同时检测血清TNF-α、IL-6 含量,以此判断是否成功制备恶病质模型[3,4]。
2.药物干预和标本采集:建立恶病质模型后,18 只TB组小鼠随机分为LC组、ILC组、阴性对照组(NST),每组各6 只,并以剩余6 只NTB组小鼠作为正常对照。LC组小鼠给予LC 9 mg/kg 灌胃;ILC组给予乙莫克舍20 mg/kg 腹腔注射;NST组给予0.9% NaCl 溶液9 mg/kg 灌胃;NTB组不予任何处理,连续干预7 d。实验第19 d 断颈处死小鼠,眼眶取血并分离血清-20 ℃保存待用;取肝脏组织置液氮冻存。测定小鼠摄食量、去瘤体质量和瘤体质量;取小鼠左侧腓肠肌、双侧附睾脂肪称重。
3.血清营养指标测定:血清白蛋白、血糖、胆固醇水平采用全自动生化仪AU400(Olympus)检测。
4.ELISA 法:将标准品倍比稀释后配成梯度标准液,取10 μL 待测样本和40 μL 样本稀释液加入样本孔,37 ℃温育30 min 后弃孔中液体,洗涤后加入辣根过氧化物酶(HRP)标记的二抗,37 ℃温育30 min,显色液显色,使用酶联免疫检测仪在450 nm波长处测定吸光度(A)值,根据样品A 值在标准曲线图上查出相应TNF-α、IL-6 含量。
5.实时定量PCR 法:TRIzol 试剂提取总RNA,逆转录成cDNA,行PCR 扩增。实时定量PCR 反应体系20 μL,包含总RNA 2 μL,10 μmol/L 上下游引物各0.8 μL,50×荧光定量PCR 参比燃料0.4 μL,一步法酶混合液0.8 μL,2×一步法扩增缓冲液10 μL,加ddH2O 补足至20 μL。反应条件为95 ℃10 min;95 ℃5 s,54 ℃30 s,72 ℃45 s,共40个循环。连续监测荧光信号变化进行熔解曲线分析,以GAPDH 作为内参照行相对定量分析,采用2-△△Ct法计算样本PPARα、PPARγ 基因表达量。
6.蛋白质印迹法:肝脏标本常规匀浆、离心制备组织蛋白抽提液,BCA 法蛋白定量。变性后上样,经电转、转膜、5% 脱脂奶粉温室封闭,加入PPARα(1∶1000),PPARγ(1∶400)4 ℃摇床过夜;加入二抗(1∶5000)温室孵育1 h,显色、显影、定影。同时检测β-actin 表达量作为内参照。每份样本单独分析,重复3 次。采用BandScan 5.0 软件,目的蛋白的表达以目的条带积分光密度值与内参照的比值表示。
三、统计学分析
采用SPSS 13.0 统计软件,每组资料分别进行正态性检验,服从正态分布的资料以¯x ±s 表示,两组间比较采用独立样本t 检验,多组间比较采用单因素方差分析,P <0.05 为差异有统计学意义。
结 果
一、结肠癌小鼠恶病质模型建立
接种6~7 d 后,成瘤率100%。NTB组小鼠摄食量、活动度、毛色持续正常状态,体型略胖;TB组小鼠接种后活动度减少、迟缓,毛色逐渐灰暗,摄食量逐渐减少。实验第11 d,TB组体质量、去瘤体质量、摄食量、左侧腓肠肌质量、附睾脂肪质量均显著低于NTB组(P <0.01),其中去瘤体质量较NTB组小鼠减轻20%以上,血清TNF-α和IL-6 水平显著高于NTB组(P <0.01)(见表1),说明TB组小鼠达恶病质标准,模型制备成功。
二、LC 改善荷瘤小鼠恶病质的作用
1.恶病质指标变化:以药物干预7 d 后,LC组小鼠摄食量和活动度明显高于干预前以及干预后NST组和ILC组,毛色晦暗和体型瘦弱程度亦明显好转。NST组、ILC组、LC组小鼠体质量、去瘤体质量、左侧腓肠肌质量和附睾脂肪质量均显著低于NTB组(P <0.05,P <0.01),LC组又显著高于NST组、ILC组(P <0.05,P <0.01);NST组、ILC组摄食量显著低于NTB组(P <0.01),LC组与NTB组之间无明显差异(P >0.05),但显著高于NST组、ILC组(P <0.01,P <0.05);NST组、ILC组、LC组瘤体质量差异无统计学意义(P >0.05)(见表2)。
2.血清学指标变化:NST组、ILC组血清白蛋白含量均显著低于NTB组和LC组(P <0.05,P <0.01),而LC组与NTB组无明显差异(P >0.05);NST组、ILC组胆固醇含量均显著高于NTB组和LC组(P <0.05,P <0.01),而LC组与NTB组无明显差异(P >0.05);NST组、ILC组、LC组血糖含量显著低于NTB组(P <0.01,P <0.05),LC组显著高于NST组、ILC组(P <0.05);NST组、ILC组、LC组血清TNF-α、IL-6 含量均显著高于NTB组(P <0.01),LC组显著低于NST组、ILC组(P <0.01)(见表3)。
三、LC 对肝脏PPARα、PPARγ 表达的影响
1.PPARα、PPARγ mRNA 表达:LC组小鼠肝脏组织PPARα mRNA 表达显著高于NTB组、NST组、ILC组(P <0.05),NST组、ILC组又显著低于NTB组(P <0.05)。NST组、LC组、ILC组肝脏组织PPARγ mRNA 表达显著低于NTB组(P <0.05),LC组又显著高于NST组、ILC组(P <0.05)(见图1)。
2.PPARα、PPARγ 蛋白表达:LC组肝脏组织PPARα 蛋白表达显著高于NTB组、NST组、ILC组(P <0.05),NST组、ILC组又显著低于NTB组(P <0.05)。NST组、LC组、ILC组肝脏组织PPARγ 蛋白表达显著低于NTB组(P <0.05),LC组又显著高于NST组、ILC组(P <0.05)(见图2、3)。
表1 NTB组和TB组小鼠恶病质指标的比较()

表1 NTB组和TB组小鼠恶病质指标的比较()
**与NTB组比较,P <0.01
表2 各组小鼠恶病质指标变化(,g)

表2 各组小鼠恶病质指标变化(,g)
与NTB组比较,* P <0.05,**P <0.01;与NST组比较,#P <0.05,##P <0.01;与ILC组比较,△P <0.05,△△P <0.01
表3 小鼠血清学指标的变化()
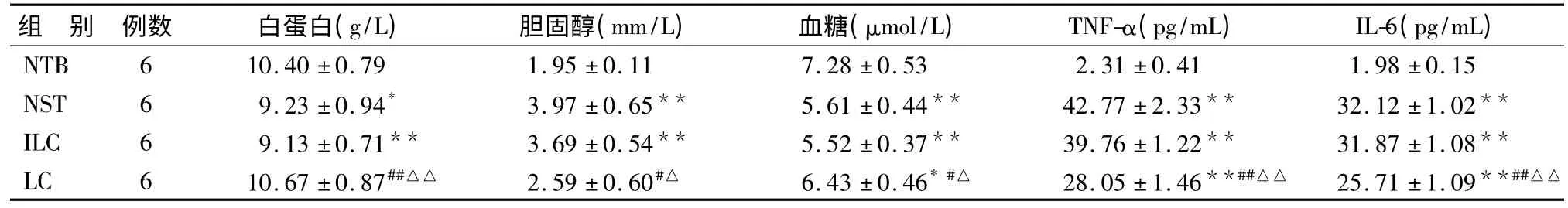
表3 小鼠血清学指标的变化()
与NTB组比较,* P <0.05,**P <0.01;与NST组比较,#P <0.05,##P <0.01;与ILC组比较,△P <0.05,△△P <0.01
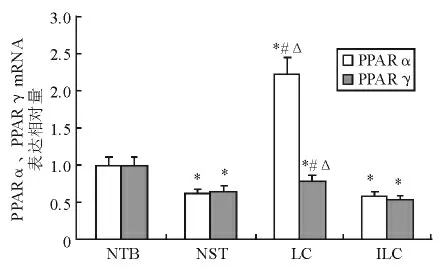
图1 小鼠肝脏组织PPARα、PPARγ mRNA 表达
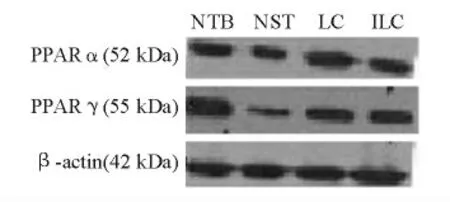
图2 小鼠肝脏组织PPARα、PPARγ 蛋白表达(蛋白质电泳图)
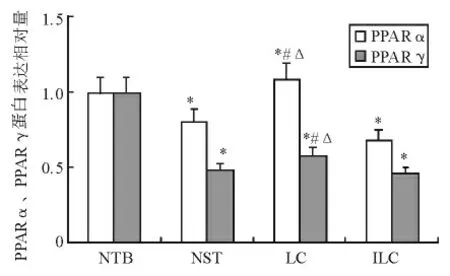
图3 小鼠肝脏组织PPARα、PPARγ 蛋白的平均灰度值
讨 论
肿瘤恶病质致死率高达80%,有效治疗恶病质成为临床难点。恶病质的发生机制复杂,可能与代谢异常、致炎细胞因子、全身炎症反应、氧化应激、瘦素和神经肽等诸多因素有关[5,6]。其中脂质代谢异常在恶病质发生中起重要作用[7]。恶病质状态下机体表现为脂质分解增加,合成减少,游离脂肪酸、胆固醇和三酰甘油增高。同时,TNF-α、IL-1、IL-6、IL-8 等内源性细胞因子表达亦增高[8]。目前恶病质的治疗主要为缓解症状的经验性治疗,但疗效不稳定,且存在一些不良反应。如最早使用的孕激素类药物能有效增加患者体重,改善食欲,减轻癌痛等恶病质表现,但易诱发血栓形成、子宫出血、外周水肿、高血压、肾上腺功能减退(突然停药时)等不良反应[9]。新近LC 治疗肿瘤恶病质的疗效日渐受到关注,LC 是脂肪酸代谢必需辅助因子,通过CPT 发挥生物学效应。LC 为水溶性营养素,不良反应少见。近年LC 已应用于慢性心衰、肾衰竭血液透析、脂质沉积等疾病的治疗,能明显改善患者心衰症状以及心功能,改善急性肾功能衰竭患者的肾功能,改善慢性肾衰竭血液透析患者低蛋白血症和贫血[10~13]。有研究发现,恶病质患者因进食不足、代谢异常以及抗肿瘤药物干扰等因素,体内LC 含量严重不足[6]。程晴等[14]的研究发现,42例肝癌晚期伴有恶病质患者的血清游离LC、乙酰基LC和丙酰基LC 均显著降低,且血清游离LC 与前白蛋白、白蛋白、BMI、KPS 功能状态评分和QOL 评分均呈正相关。说明血清LC 水平降低是恶病质的结果,LC 可能在某种程度上反映了恶病质的程度。国外有研究[15,16]给予癌症患者口服LC 1 周后,疲劳症状明显改善,综合评分、躯体评分以及生活质量评分中与氧化应激相关的疲劳指标均显著改善;Mantovani 等[2]对恶病质治疗药物的Ⅲ期临床试验发现,给予LC(4 g/d)治疗的88例恶病质患者的格拉斯哥预后评分(GPS)显著降低。Liu 等[17]的动物实验证实,恶病质小鼠补充外源性LC 后血清卡尼汀含量升高,TNF-α、IL-6 含量降低,CPTⅠ、CPTⅡmRNA 表达增加、肝脏CPTⅠ酶活性升高,从而促进脂肪酸氧化,调节恶病质代谢紊乱。上述研究说明补充外源性LC 可能对预防或治疗肿瘤恶病质有一定作用。本研究发现补充外源性LC 能增加结肠癌恶病质小鼠体质量、去瘤体质量、摄食量、左侧腓肠肌质量和附睾脂肪质量,增加血清白蛋白、血糖含量,降低胆固醇含量,调节恶病质状态下的代谢紊乱,降低血清TNF-α、IL-6 含量,上述指标与NST组和ILC组相比差异均有统计学意义。提示LC 可改善恶病质小鼠的生存状态,增加摄食量,促进体质量恢复,减轻骨骼肌萎缩,调节代谢紊乱等,且证实了LC 发挥生物学效应是通过CPT 来实现的。但LC 改善肿瘤恶病质的机制却仍不清楚。
PPAR 是调节目标基因表达的核内受体转录因子超家族成员,根据结构不同,可分为α、β(或δ)和γ 三种类型。PPAR 与肝脏脂质代谢密切相关,目前的研究热点主要是PPARα和PPARγ。PPARα 主要在肝脏中表达,能增强脂肪酸β 氧化;PPARγ 主要在脂肪组织和肝脏中表达,可促进脂肪酸在脂肪组织中沉积和脂肪细胞分化,从而增加靶组织对胰岛素的敏感性。PPARα 的合成激动剂苯氧乙酸酯通过刺激肝脏中脂肪酸氧化,能显著降低血浆三酰甘油水平,增加高密度脂蛋白水平,已被广泛用于心血管疾病的治疗。PPARγ 的合成激动剂噻唑二酮可降低血糖水平,临床已用于Ⅱ型糖尿病的治疗。有研究[18]显示,PPARγ 激动剂能放大胰岛素信号级联反应,改善恶病质状态下的代谢紊乱,可成为治疗恶病质的新药。
恶病质状态下机体能量需求增加,基础代谢率增高,导致血糖水平降低,骨骼肌蛋白大量消耗,脂肪酸含量增加,外周血胆固醇、三酰甘油含量增加。本实验证实恶病质状态下小鼠脂肪代谢异常,附睾脂肪质量降低,血清胆固醇水平升高,小鼠肝脏中PPARα、PPARγ mRNA和蛋白表达降低;给予LC 干预治疗后,上述指标均明显改善。PPARα、PPARγ主要的生物学效应是刺激β 氧化,降低脂肪酸和三酰甘油合成,纠正脂质代谢,进一步证实了在恶病质状态下脂质代谢紊乱,而LC 可能通过调控PPAR表达来纠正脂质代谢,从而改善肿瘤恶病质状态。
综上所述,恶病质小鼠肝脏PPARα、PPARγ 表达降低,给予外源性LC 后可增强其表达,改善恶病质小鼠的脂质代谢。说明LC和PPAR 激动剂可能在治疗肿瘤恶病质中存在潜在的药学效应,为肿瘤恶病质的防治开发新途径和方法。但目前仍有许多问题亟待深入研究,如PPAR 在肿瘤细胞增殖和分化中的确切作用,LC-PPAR 信号通路是否存在其他关键点,如何选择性控制PPAR 介导的生物学效应等。
1 Vinci E,Rampello E,Zanoli L,et al.Serum carnitine levels in patients with tumoral cachexia[J].Eur J Intern Med,2005,16 (6):419-423.
2 Mantovani G,Macciò A,Madeddu C,et al.Randomized phase Ⅲclinical trial of five different arms of treatment in 332 patients with cancer cachexia[J].Oncologist,2010,15 (2):200-211.
3 赵艳凤,姜达.癌性恶病质发生的分子机制及其逆转[J].实用肿瘤学杂志,2007,21 (2):169-172.
4 周伟,江志伟,姜军,等.一种癌性恶病质动物模型的建立[J].中华实验外科杂志,2004,21 (4):490-491.
5 周浩锋,牟小洋,付文广,等.肿瘤恶病质发病机制及其相关因素的研究进展[J].中国实用医药,2008,3(7):142-144.
6 Silvério R,Laviano A,Rossi Fanelli F,et al.L-carnitine and cancer cachexia:Clinical and experimental aspects[J].J Cachexia Sarcopenia Muscle,2011,2 (1):37-44.
7 吴国豪.癌症恶病质的发生机制与治疗对策[J].外科理论与实践,2008,13 (5):408-411.
8 Kemik O,Sumer A,Kemik AS,et al.The relationship among acute-phase response proteins,cytokines and hormones in cachectic patients with colon cancer[J].World J Surg Oncol,2010,8:85.
9 梁艳,陈充抒.甲孕酮治疗癌症恶病质的疗效[J].中国药师,2007,10 (6):573-574.
10 Ferrari R,Merli E,Cicchitelli G,et al.Therapeutic effects of L-carnitine and propionyl-L-carnitine on cardiovascular diseases:a review[J].Ann N Y Acad Sci,2004,1033:79-91.
11 龙涛.左卡尼汀对急性肾功能衰竭患者肾功能的影响[J].天津医科大学学报,2009,15 (2):291-293.
12 杨合俭.左旋卡尼汀对血液透析患者贫血的影响[J].中华医学研究杂志,2007,7 (9):790-791.
13 薛峥,刘玲春,王雪贞,等.左卡尼汀治疗脂质沉积性肌病2例[J].医药导报,2008,27 (10):1223-1224.
14 程晴,刘苏,唐丹,等.晚期肝癌患者血清左旋卡尼汀水平与恶病质相关性的分析[J].胃肠病学与肝病学杂志,2010,19 (1):78-80.
15 Cruciani RA,Dvorkin E,Homel P,et al.L-carnitine supplementation for the treatment of fatigue and depressed mood in cancer patients with carnitine deficiency:a preliminary analysis[J].Ann N Y Acad Sci,2004,1033:168-176.
16 Graziano F,Bisonni R,Catalano V,et al.Potential role of levocarnitine supplementation for the treatment of chemotherapy-induced fatigue in non-anaemic cancer patients[J].Br J Cancer,2002,86 (12):1854-1857.
17 Liu S,Wu HJ,Zhang ZQ,et al.L-carnitine ameliorates cancer cachexia in mice by regulating the expression and activity of carnitine palmityl transferase[J].Cancer Biol Ther,2011,12 (2):125-130.
18 Trobec K,von Haehling S,Anker SD,et al.Growth hormone,insulin-like growth factor 1,and insulin signaling-a pharmacological target in body wasting and cachexia[J].J Cachexia Sarcopenia Muscle,2011,2(4):191-200.
- 胃肠病学的其它文章
- 2013年美国胃肠病学会年会暨继续教育课程会议通知

