木质素中酚酸物质对于丙酮丁醇发酵的影响
张连华,王 岚,陈洪章*
(1.中国科学院过程工程研究所,生物工程国家重点实验室,北京 100190;2.中国科学院大学,北京 100049)
化石能源日益短缺,生物质能源是一种很有前景的替代能源[1-2]。生物质通过生物转化生成的生物燃料中,丁醇被认为是具有广泛应用前景的新一代生物燃料[3]。丙酮丁醇梭菌具有同时利用木质纤维素酶解产生五、六碳糖及寡糖的优势[4-5]。丙酮丁醇发酵(简称丁醇发酵)成为工业界与学术界共同关注的热点问题。木质纤维素在预处理过程中会产生一定量的副产物,其中包括酚酸、糠醛、稀酸等[6],这些副产物具有一定的毒性,严重降低了发酵效率,甚至可以完全抑制发酵的进行,其中毒性最大的为酚类化合物,主要来源于木质素的降解[7],它们能渗透到细胞膜内,破坏细胞的完整性和活性,影响发酵的正常进行[8]。为了正常发酵,首先要进行脱毒处理或选育抗性发酵菌株,使丙酮丁醇发酵成本增加[9-10],因此以对丙酮丁醇梭菌抑制最大的酚酸物质作为考察对象,系统研究其对丙酮丁醇梭菌生长代谢的影响,以期在此基础上建立不需要脱毒处理的发酵工艺,同时研究酚酸毒性与其物性的关系,为预测其他酚酸物质对于丙酮丁醇梭菌毒性大小建立理论依据。
木质素降解产生的酚酸类物质分为3种结构类型:愈创木基结构(G型)、紫丁香基结构(S型)和对羟苯基结构(H型)。为了研究木质素中酚酸类物质对于丙酮丁醇发酵影响的普遍规律,作者选取了3种类型中具有代表性的4种酚酸物质作为研究对象:阿魏酸(G型)、香草酸(G型)、丁香酸(S型)和对羟基苯甲酸(H型)[11]。丁醇是丙酮丁醇发酵中最主要的产品,因此本文只考察了丁醇产量的变化。
1 实验
1.1 菌种及发酵方法
丙酮丁醇梭菌Clostridium acetobutylicum ATCC824,购自中科院微生物菌种保藏中心。保存培养基为:5% 玉米粉,置于4℃ 冰箱保存。发酵培养基为:60 g/L葡萄糖,3.68 g/L硫酸铵,1.768 g/L磷酸二氢钾,2.938 g/L磷酸氢二钾,10 mg/L对氨基苯甲酸,10 mg/L生物素,0.2% 氢氧化钙,无机盐营养液1 mL(1 L 无机盐溶液含:NaMoO4·2H2O,2.4 g;CoCl2·6H2O,0.24 g;CaCl2·2H2O,1.5 g;FeCl3·6H2O,27 g;H2SO4,28 mL;CuSO4·5H2O,0.25 g;ZnSO4·7H2O,0.29 g;MnSO4·H2O,1.7 g;MgSO4,12 g),pH值为6.5~7.0。所有试剂都为分析纯,购自北京化学试剂公司。
1.2 添加酚酸物质丙酮丁醇发酵实验方法
将阿魏酸、香草酸、丁香酸、对羟基苯甲酸标准品按照 0.05、0.1、0.3、0.5、1.0 g/L 浓度加入葡萄糖培养基,按照10%接种量接入活化24 h后的菌种,37℃ 在厌氧培养箱(YQX-II上海新苗医疗器械制造公司)中静置培养。测定48 h和120 h时丁醇产量及生物量。
1.3 汽爆玉米秸秆酶解液不脱毒直接丁醇发酵实验过程
汽爆玉米秸秆酶解液中含有总酚酸1.21 g/L(采用紫外可见分光光度法,按照王琳等方法进行[12]),补糖至总糖60 g/L,按照1.1节中方法将其他营养物质补全。分别按照体积分数10%、20%、30%、50%接种量接入活化24 h的菌种,37℃ 在厌氧培养箱培养。培养120 h后测定全部实验组丁醇产量。
1.4 丁醇产量及生物量检测方法
丁醇产量采用安捷伦GC-7890A型号气相色谱进行测定,毛细管柱为Innowax 19091N-113,30 m×0.32 mm×0.25 mm,氢火焰检测器,载气为氮气,氮气和氢气的流速比为10∶1,氮气、氢气和空气3种气体总压力为1.2 kg/cm2。测定条件:进样器和检测器温度均为250℃,柱箱初始温度为85℃,维持4.5 min后,以20℃/min的速度升至170℃ 并保持2.5 min,以异丁醇为内标物。生物量采用比色法,按照Wang等[13]的方法使用紫外分光光度计(UVmini-1240日本岛津)进行测定。
1.5 物性计算方法
IC50定义为丁醇产量为对照组一半时所对应的酚酸含量,通过划线法得到[14],logP、pKa由Chemoffice软件计算得到,相关系数由软件SPSS17计算得到。
2 结果与分析
2.1 4种酚酸物质对于丙酮丁醇梭菌生长与代谢的影响
4种酚酸物质对丁醇产量和生物量的影响如图1~图2所示。从图1(a)中可以看出,48 h时实验组丁醇产量均低于对照组(酚酸添加量为0的组),但从图1(b)中可以看出,120 h时随着酚酸浓度的增加,4个实验组丁醇产量均呈现先增加后减少的趋势,其中阿魏酸组丁醇产量最高点为100 mg/L浓度时,为15.43 g/L,比对照13.51 g/L高出14.21%,而大于100 mg/L开始丁醇产量迅速下降,1 000 mg/L时,丁醇产量为1.15 g/L,抑制率达到91.49%;香草酸组最高点为100 mg/L浓度,为14.30 g/L,比对照13.51 g/L高出5.85%,而大于100 mg/L丁醇产量迅速下降,1 000 mg/L时,丁醇产量为0.45 g/L,抑制率达到 96.67%。丁香酸组最高点为 100 mg/L浓度,为 14.63 g/L,比对照 13.51 g/L高出8.29%,而大于100 mg/L丁醇产量迅速下降,1 000 mg/L时,丁醇产量为 1.01 g/L,抑制率达到92.52%。对羟基苯甲酸组与其他3组都不同的是最高点为50 mg/L浓度为16.39 g/L,比对照13.51 g/L高出21.32%,且100 mg/L也要比对照高。而大于100 mg/L丁醇产量迅速下降,1 000 mg/L时,丁醇产量为0.45 g/L,抑制率达到96.08%。

从图2(a)中可以看出在48 h时,实验组生物量低于对照组,这说明丙酮丁醇梭菌生长前期被酚酸物质抑制,但是酚酸物质量少时,抑制较弱。从图2(b)中可以看出,120 h时实验组生物量与丁醇产量趋势一致,呈现先增后减趋势,低剂量的酚酸物质不仅促进了丁醇的产量,也促进了丙酮丁醇梭菌的繁殖,100 mg/L香草酸组其生物量是对照组的4.50倍。但是酚酸物质浓度增大到一定程度,对菌体生长也将产生抑制效果,4个实验组在1 000 mg/L时,生物量都为0,生长被完全抑制。
从上述结果可以看出,低剂量的酚酸物质对于丁醇产量和丙酮丁醇梭菌生物量起到促进作用,加入50 mg/L对羟基苯甲酸的实验组促进作用最明显,丁醇产量比对照组(酚酸添加量为0)高21.32%,但是随着抑制物浓度再次增加时,会呈现明显的抑制作用,如香草酸浓度为1 000 mg/L时,抑制率达到96.67%。这是一种低剂量促进效应[15],高剂量的毒性物质起到抑制作用,而低剂量时会起到一定的促进作用,该效应主要应用于医学及环保毒理评价中[16],未见有国内外文献报道其在发酵抑制物方面的应用。酚酸物质在丁醇发酵中呈现低剂量兴奋效应,推测其原因为:从菌株个体角度看,加入少量酚酸物质时,活力较差的菌株会因为酚酸物质的毒性被淘汰掉,剩下的高活力菌株则能得到更多的营养进行繁殖和代谢,但此时整体来看还是部分被抑制,所以48 h实验组的生物量会低于对照组;接下来高活力菌体大量繁殖后,单个细菌所承受的抑制压力减少,抑制得以解除,而此时的菌体高活性菌株占主体,所以从整体来看,丙酮丁醇梭菌的总体的活性便增强了,即呈现出促进作用;若酚酸浓度过低,其筛选高活力菌株的作用不明显,其促进作用就较弱,所以除去对羟基苯甲酸实验组的其它3组中,50 mg/L组的丁醇产量均比100 mg/L组低;而酚酸浓度过高时,高活力的菌株也会被严重抑制,所以整体菌株的生长和代谢都受到严重影响,浓度足够高时,则完全停止生长[17-18],所以酚酸浓度大于100 mg/L并逐渐增加时,丁醇产量和丙酮丁醇梭菌生物量逐渐减少,直至降至0。据此分析,可以通过增加菌体量降低抑制物浓度,来解除抑制,将酚酸浓度控制到合适浓度时,甚至可以起到促进作用。
2.2 汽爆玉米秸秆酶解液不脱毒直接丁醇发酵工艺

图3 不同接种量对不脱毒直接丁醇发酵丁醇产量的影响Fig.3 Effect of different inoculation rates on butanol yield in butanol fermentation
从图3中可以看出,随着接种量(120 h时)从10% 增加至30%,丁醇产量逐渐增加,这是因为增大接种量时,发酵液被一定程度稀释,而且由于接入的菌体量大,平均每个菌体所受到的抑制降低,整体的抑制也逐渐降低,代谢增强,所以丁醇产量逐渐增加,接种量30% 时,丁醇产量达到9.16 g/L,达到了一般文献中报道的丁醇产量[19];而接种量为50% 时,其丁醇产量低于接种量30% 组,是因为此时稀释浓度过大,酚酸的低剂量促进作用不明显,且培养基中的碳源一定,即产物总量一定,发酵液体积增加,必然丁醇浓度降低。
此结果说明,通过增大接种量实现木质纤维素水解液的不脱毒直接丁醇发酵是可行的,30%接种量是比较合适的条件。
2.3 木质素中酚酸物质对于丙酮丁醇梭菌的毒性与其物性的关系
不同的酚酸物质其影响趋势一致,但其低剂量效应转折点,即其对于丙酮丁醇梭菌的毒性不尽相同,为了考察不同酚酸对与丙酮丁醇梭菌毒性大小的影响因素,考察了IC50值与logP、pKa和分子量之间的相关性。
IC50定义为丁醇产量为对照一半时的酚酸含量,IC50越小,其毒性越强,即较低的浓度就可产生较强的抑制。logP为正辛烷/水分配系数,代表了这种物质的疏水性大小,该数值越大,其疏水性越大。pKa为电离常数项,体现了分子的电子效应,pKa反映分子的释质子能力,pKa越大,释质子能力越弱,表明亲核性越强。相反,pKa越小,释质子能力越大,表明亲电性越强。
由表1可知,IC50与logP相关性为-0.286,不显著负相关;IC50与pKa相关性为0.816,显著正相关;与分子质量相关系数为0.876,显著正相关。由以上数据可以看出酚酸物质其毒性与电离常数和分子质量相关性非常大,都大于0.8,电离常数越小,分子质量越小,IC50越小,即毒性越大,分析原因可能是分子质量越小越容易进入细胞内,且亲核性强,不易被胞内物质反应掉,毒性持久。与疏水性呈现不显著的负相关。根据理论分析,logP越大,即疏水性越强,其对于细菌细胞膜侵害性会越强,IC50会越小,与上述负相关数据一致,但是相关系数较小,说明疏水性大小对于细菌的毒性影响相对较小,文献中报道酚酸对于大型蚤的影响logP大于pKa的影响[20],本研究结果正好相反,分析是因为丙酮丁醇梭菌与大型跳蚤的结构不一样。定量构效关系(quantitative structure activity relationships,QSAR)主要应用于环境毒理学及药物设计[21-22],未见有文献报道将其用于评价酚酸物质对于丙酮丁醇梭菌毒性。
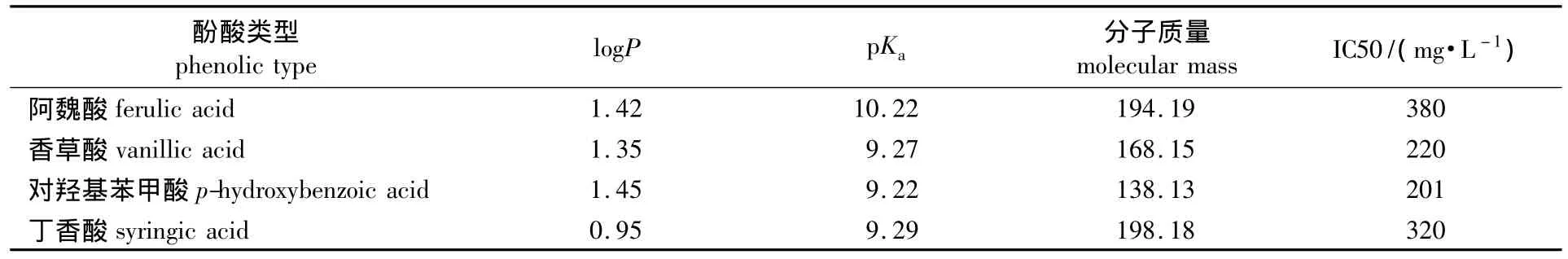
表1 4种酚酸物性参数及其IC50值Table 1 Material parameters and their IC50 values of four kinds of phenolic acids
3 结论
3.1 木质素中酚酸物质在低浓度下对丙酮丁醇梭菌生长与代谢具有促进作用,酚酸浓度达到一定时才有抑制作用;建立了通过加大接种量增强菌体抑制点不必脱毒直接进行发酵的新工艺。
3.2 作者将定量构效关系(QSAR)应用到评价酚酸物质对于丙酮丁醇梭菌毒性大小,为判断不同物质对于丁醇发酵毒性大小提供了理论依据。
[1]蒋剑春.生物质能源应用研究现状与发展前景[J].林产化学与工业,2002,32(2):75-80.
[2]袁振宏,吕鹏梅,孔晓英.生物质能源开发与应用现状和前景[J].生物质化学工程,2006,40(增刊):13-21.
[3]DURRE P.Biobutanol:An attractive biofuel[J].Biotechnology Journal,2007,2(12):1525-1534.
[4]高凯,李云,杨秀山.影响丙酮丁醇发酵的主要因素及解决方案的研究进展[J].生物质化学工程,2011,45(2):45-50.
[5]陈洪章,王岚.生物质能源转化技术与应用 (Ⅷ)——生物质的生物转化技术原理与应用[J].生物质化学工程,2008,42(4):67-72.
[6]陈洪章,刘丽英.蒸汽爆碎技术原理及应用[M]:北京:化学工业出版社,2007.
[7]LARSSON S,PALMQVIST E,HAHN-HAGERDAL B.The generation of fermentation inhibitors during dilute acid hydrolysis of softwood[J].Enzyme and Microbial Technology,1999,24(3):151-159.
[8]PALMQVIST E,HAHN-HAGERDAL B.Fermentation of lignocellulosic hydrolysates(II):Inhibitors and mechanisms of inhibition[J].Bioresource Technology,2000,74(1):25-33.
[9]庄军平,林鹿,庞春生,等.木质纤维素稀水解液脱毒研究进展[J].现代化工,2009(2):19-23.
[10]曾凡洲,蒋剑春,卫民,等.生物质水解发酵生产燃料乙醇的研究进展[J].生物质化学工程,2009,43(2):43-48.
[11]蒋挺大.木质素[M].北京:化学工业出版社,2001.
[12]王琳,郜昭慧,程忠哲,等.紫外可见分光光度法测定马齿苋中总酚酸的含量[J].辽宁中医药大学学报,2012(5):223-225.
[13]WANG L,CHEN H Z.Increased fermentability of enzymatically hydrolyzed steam-exploded corn stover for butanol production by removal of fermentation inhibitors[J].Process Biochemistry,2011,46(2):604-607.
[14]赵斌,葛金芳,朱娟娟.小议在 MTT法测细胞增殖抑制率中IC50的计算方法[J].安徽医药,2007,11(9):834-836.
[15]CALABRESE E,BALDWIN L.Defining hormesis[J].Human and Experimental Toxicology,2002,21(2):91-97.
[16]让欧艳,让蔚清.低剂量兴奋效应及其医学应用[J].实用预防医学,2009,16(1):300-303.
[17]申开丽,俞洁,林广,等.低剂量刺激效应在污染物风险评价中的意义及前景[J].环境与职业医学,2012,29(3):183-186.
[18]陶功华.低剂量兴奋效应作用机制的研究进展[J].中山大学研究生学刊:自然科学,医学版,2007(1):16-21.
[19]郭亭,孙佰军,梁达奉,等.不同C源对丙酮丁醇梭菌产丁醇的影响[J].南京工业大学学报:自然科学版,2011,33(2):20-23.
[20]于瑞莲,赵元慧.酚类对大型蚤的急性毒性及QSAR研究[J].华侨大学学报:自然科学版,2003,24(1):44-47.
[21]柳波,谢惠定,李玉鹏,等.Novobiocin类化合物抑制胰腺癌细胞的2D-QSAR研究[J].昆明医科大学学报,2012(11):8-12.
[22]顾云兰.酚类化合物对蝌蚪急性毒性的定量构效关系研究[J].科技通报,2012,28(1):25-29.

