肝脏局灶性结节性增生12例临床病理观察
陈 鲜,傅 静,吕春燕
(1.三六三医院病理科,四川 成都 610041;2.四川省医学科学院·四川省人民医院病理科,四川 成都 610072;3.成都市第五人民医院病理科,四川 成都 611130)
肝脏局灶性结节性增生(focal nodular hyperplasia,FNH)是较少见的肝脏良性肿瘤样病变,约占肝脏原发性肿瘤的8%[1]。典型的FNH病理诊断一般不太困难,但当病变纤维分隔明显时或中央瘢痕不明显,或镜下纤维分隔纤细,纤维分隔里的胆小管不明显时,就需要与肝硬化、肝细胞腺瘤、高分化肝细胞癌及一些其他肝脏肿瘤或瘤样病变进行鉴别,以免误诊或漏诊。本文总结12例FNH的临床病理特征,旨在提高对FNH的病理诊断认识水平。
1 资料与方法
1.1 一般资料 收集三六三医院及四川省医学科学院·四川省人民医院病理科2004~2012年病理确诊为肝脏FNH病理档案标本12例,12例均为手术切除标本。
1.2 方法 对12例FNH患者的年龄、性别、临床表现、影像学资料及病理学改变进行分析,按照WHO标准[1]对12例FNH的HE切片和免疫组化切片进行重新复习,并补做免疫组化染色;另选5例肝硬化、3例肝腺瘤(HCA)、5例高分化肝细胞癌(HCC)作为对照观察研究。所有标本均经10%中性缓冲福尔马林固定,常规脱水,石蜡包埋,连续切片,厚4 μm,常规HE染色。免疫组化标记采用En-Vision二步法,按试剂盒说明进行操作,采用高温高压抗原修复,DAB显色,苏木精复染及中性树胶封固。PBS代替一抗作为阴性对照,用已知阳性切片作为抗体阳性对照。所用第一抗体CK19、Hepato-cyte(Hep Par1)、磷脂酰肌醇蛋白聚糖3(Glypican-3,GPC3)、CD34、AFP、CD10、HBsAg、HBcAg 及 Ki-67等均购自迈新生物技术开发公司,EnVision试剂盒购自基因生物技术公司。
1.3 结果判定 CK19、Hep Par1、GPC3、AFP、HB-sAg阳性定位在胞质,CD10和CD34在包膜,HBcAg和Ki-67在胞核。
1.4 统计学方法 采用SPSS 13.0统计学软件进行统计学处理。用Fisher精确概率法进行免疫组化表型结果分析。
2 结果
2.1 临床特征 12例FNH中男7例,女5例,年龄21~74岁,平均年龄37岁。临床表现无特异性,7例体检偶然发现肝脏有占位病变而无任何症状,其中4例表现为肝区不适或轻微疼痛、隐痛或不适感,1例因胆囊炎检查偶然发现肝脏占位病变。12例均无慢性肝炎病史,也无血清AFP升高。6例肿块位于肝右叶,5例位于肝左叶,1例位于肝中叶。
2.2 影像学资料 4例有CT结果,1例诊断为腺瘤,2例诊断为FNH,1例诊断为占位病变,疑为肝癌。CT见肝内低密度团块影,边界清楚,增强可见病灶内部血管影,中心可见结节状未强化区域。
2.3 大体观察 12例均为单发病灶,送检为带部分肝组织的肿块或单纯肿块切除标本,肿块最大径为1~8 cm,平均3 cm,肿块边界较清楚,无明显包膜,切面结节状或分叶状,灰白、灰黄色或黄褐色,7例可见典型的放射状星状瘢痕,质地中等,瘢痕处质地较韧,1例肿块向肝脏表面突起,2例可见扩张的血管,2例可见出血灶,1例可见灶性坏死灶。肿块周围均无肝硬化背景。
2.4 镜下观察 肿瘤由增生性肝细胞构成,肝细胞呈结节状分布,细胞无异型性,呈1~2层排列,结节大小不等,结节之间可见杂乱的纤维间隔穿插其中。典型的星状瘢痕由增生的纤维组织、薄壁小静脉、厚壁肝动脉、增生小胆管和数量不等的淋巴细胞构成,中央瘢痕内的动脉壁不规则增厚。3例出现灶性脂肪变性。周围肝组织无肝硬化背景(图1)。
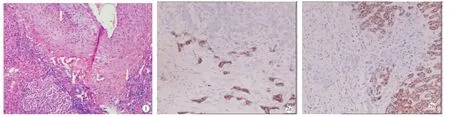
图1 FNH镜下观察(×100);图2 FNH免疫组化表型a:CK19表达(×100);b:Hep Pdrl表达(×100)
2.5 免疫组化表型 ①纤维分隔内增生的胆小管CK19呈阳性表达(图2)。②Hep Par1:12例FNH、5例肝硬化、3例HCA和5例高分化HCC均为肝细胞阳性表达,阳性率100%;纤维分隔内增生的胆小管Hep Par1阴性(图3)。③CD34:CD34显示FNH微血管虽然较丰富,但分布不均匀,主要分布在纤维瘢痕的两侧或其末端;而HCA和肝硬化微血管稀少,分布不均匀。高分化HCC微血管均呈特有的毛细血管化染色模式显示肿瘤新生微血管数量显著增加、均匀分布。④GPC3:12例FNH、5例肝硬化和3例HCA均无阳性表达。5例高分化HCC中4例为阳性(80%)。⑤AFP:12例FNH、5例肝硬化和3例HCA均无阳性表达,5例高分化HCC仅1例阳性(20%)。⑥Ki-67:12例 FNH、5例肝硬化和3例HA肝细胞阳性率均≤5%;5例高分化HCC阳性率平均为10%;高分化HCC增殖指数高于FNH、肝硬化和HCA,差异有统计学意义(P<0.01)。⑦HB-sAg和HBcAg:12例FNH、3例HCA和5例HCC均为阴性;5例肝硬化4例肝细胞HBsAg有阳性表达,3例肝细胞核有HBcAg阳性表达。
3 讨论
FNH是一种肝细胞来源的良性非肿瘤性病变,病因目前仍然不完全清楚。国内外多数学者认为,FNH与肝脏血管先天性畸形所致的局部肝细胞反应性增生有关,是肝细胞对血液循环异常的一种局部增生性反应[1~6]。克隆性分析发现,FNH由多克隆细胞组成,是多克隆疾病,仅少数由单克隆性肿瘤细胞构成,说明FNH是一种非肿瘤性病变,无重要的并发症,也未发现恶变的倾向,少数病灶可自行缩小甚至消失。FNH确切的分子基础尚不清楚,最近的FNH的转录子分析结果显示,FNH中有Wnt/βcatenin通路的活化,而未检测到β-catenin基因突变。尽管这些研究发现的意义尚不明确,尤其是当该肿瘤被当作血管异常时,这些观察结果可能是生长因子依赖性活化基因β-catenin异常活化的结果。其次,在所有检测的FNH中,编码血管生成素1和2蛋白的相关基因水平随ANGPT1/ANGPT2比值的增高而增高,FNH中似乎有一些通路的异常改变,也说明血管异常改变是FNH发生的重要因素[7,8]。
FNH发病率不高,约占成人活检人群的0.8%[1]。在肝脏的良性肿瘤中,其发病率仅次于血管瘤,列第二位,研究发现,20%的FNH伴有肝脏血管瘤。在西方80%~90%的患者好发年龄为30~40岁妇女,75%可能与长期服用避孕药有关[1],但避孕药服用史与结节大小和数量并无相关性。而国内文献是患者男多于女,男女患者比例约1.43~1.6 ∶1[5,6],与服避孕药关系也不大[5]。儿童也可发生。2/3为单发孤立性病灶,1/3为多发病灶[1]。本组病例平均年龄37岁,男、女比例为7∶5,全部为单发病灶。影像学CT示肝内低密度团块影,边界清楚,增强CT可见病灶内部血管影[4]。
3.1 诊断 Wanless等[7]按照不同病理表现将FNH分为经典型和非经典型2型。经典型FNH占80%以上,病理表现为正常肝细胞结节状增生,可见增生的胆管、扩张的血管以及典型的纤维疤痕或者纤维条索,由于含有纤维组织故质地较硬;经典型的FNH手术标本一般病理诊断不是太困难,而活检标本难以诊断FNH,确诊需结合临床、影像学和免疫组化标记进行。诊断FNH需要两个主要标准:与良性肝细胞和汇管区门脉系统的对照。为避免肝硬化等造成诊断上的困扰,建议活检时同时取结节周围肝组织来加以对比。病理学特点:经典型FNH肿瘤大小从数毫米到10 cm以上,边界清楚但无包膜,常具有特征性的中央或偏心性星形瘢痕,但FNH的变异型或早期FNH无星形瘢痕。经典型FNH镜下特点:病灶内肝细胞板不超过2个细胞,中央瘢痕纤维间隔伴随明显的小胆管增生和炎细胞(淋巴细胞或混合性炎细胞)浸润,其内可见1个或多个营养不良性大血管和较多小动脉。放射状瘢痕内可见汇管区样结构,但只见动脉,未见静脉和胆管结构。在间质和实质交界处,常见胆汁淤积和/或胆管反应。局部可出现脂肪变性,周围肝组织正常无肝硬化背景。免疫表型特点:CK19显示中央瘢痕里小胆管(+);CD34主要显示纤维瘢痕的两侧或其末端微血管;GPC3(-),AFP(-)。
关于变异型或非经典型FNH目前还没有统一的诊断标准,其它的本质上为再生的结节现被称为FNH变异型。变异型FNH在纤维化和胆管反应方面都不如经典型明显,而且目前谷氨酰胺合成酶在变异型FNH中的表达情况还不清楚;此外,变异型FNH不同于经典型FNH仅发生于正常肝组织内,部分病例可在异常肝组织(脂肪变性或血管疾病等)的基础上发生[1]。非经典型又分为毛细血管扩张型(telangiectatic focal nodular hyperplasia,TFNH)、混合性增生及腺瘤样型和细胞不典型3个亚型[8],其中最常见的为TFNH,可见正常肝细胞结节增生,增生的胆管以及血管,但不含纤维成分,类似于血管瘤,质较软,有口服避孕药史的FNH患者多属于该类型,有报道TFNH的肝细胞来源于单克隆,不同于FNH的多克隆来源,与HCA似乎有更为相近的分子特征,且血管新生素(Angiopoietin 1,Ang 1;Angiopoietin 2,Ang2)mRNA在二者之间的不同表达,因而提出TFNH可能属于HCA亚型,也可能是独立的一类疾病[8,9]。因此了解不典型FNH特征对于该疾病的鉴别诊断有一定意义。
3.2 鉴别诊断 ①肝硬化:当FNH纤维分隔明显时,尤其是活检标本,难以与肝硬化相鉴别。肝硬化有慢性肝炎等基础疾病,肝脏为弥漫性病变;免疫标记HBsAg和 HbcAg常为阳性,而 FNH阴性。②HCA:当HCA出现纤维化或小管结构时,需要与FNH鉴别。HCA结节一般有包膜,而FNH无包膜;HCA无FNH特征性的星状瘢痕;HCA切面为均质状,常有出血坏死,而FNH为结节状,出血坏死少见;HCA肝细胞富含糖原,呈空泡状,FNH无;HCA无汇管区,无增生的小胆管,FNH有;HCA无大的厚壁血管,FNH常有。免疫表型特点:HCA的CD34(-)或仅灶性阳性表达,血管稀少。谷氨酰胺合成酶免疫标记HCA(-),FNH(+)。③高分化肝细胞癌,特别是纤维板层型肝细胞癌(Fibrolamellar hepatocellular carcinoma,FLC),由于 FLC肝硬化背景少见,大体也可见放射状瘢痕,需与FNH鉴别:FLC镜下有特有的纤维板层结构,癌巢被纤维组织有规则的围绕,胞质强嗜酸性颗粒状,可见苍白小体或毛玻璃样小体,癌组织常有钙化,肿瘤细胞GPC3(+)、AFP 可能(+)[10]。
3.3 治疗和预后 手术切除是治疗FNH的最佳选择,既可去除病灶,又可明确诊断。FNH预后良好,手术切除后亦未见复发。与HCA不同,无潜在恶变之虞,并发症罕见。本组6例随访均无复发。
[1]Bioulac-Sage P,Balabaud C,Wanless I.WHO Classification tumors of the digested system[M].Lyon:IARC Press,2010:198-204.
[2]周玉保,汪慧,周华邦,等.肝脏局灶性结节性增生46例临床分析[J].临床消化病杂志,2009,2(3):146-149.
[3]巩丽,苏勤,张宏图,等.克隆性分析在肝细胞腺瘤与局灶性结节性增生鉴别诊断中的应用[J].临床与实验病理学杂志,2006,22(4):412-416
[4]周成香,刘亚斌,罗渝昆.肝脏局灶性结节性增生的超声影像特征[J].实用医院临床杂志,2011,8(1):34-37.
[5]严茂林,王耀东,田毅峰,等.肝局灶性结节性增生265例诊治分析[J].中华肝胆外科杂志,2011,17(5):423-424.
[6]陈伶俐,纪元,许建芳,等.肝脏局灶结节性增生238例临床病理分析[J].中华病理学杂志,2011,40(1):17-22.
[7]Sadowski DC,Lee SS,Wanless IR,et al.Progressive type of focal nodular hyperplasia characterized by multiple tumors and recurrence[J].Hepatology,1995,21(4):970-975.
[8]Coleman WB.步宏,石毓君,冯莉主译.分子病理学:疾病的分子基础[M].北京:科学出版社,2012.
[9]Gouw AS,Zeng W,Buiskool M,et al.Molecular characterization of the vascular features of focal nodular hyperplasia and hepatocellular adenoma:a role for angiopoietin-1[J].Hepatology,2010,52(2):540-549.
[10]Yao M,Yao DF,Bian YZ,et al.Oncofetal antigen glypican-3 as a promising early diagnostic marker for hepatocellular carcinoma[J].Hepatobiliary Pancreat Dis Int,2011,10(3):289-294.

