两种方法鉴定辣椒疫病抗性研究
马辉刚,何烈干,陈学军,方 荣,周坤华,涂玉琴
(1.江西省农业科学院 植物保护研究所,江西 南昌330200;2.江西省农业科学院 蔬菜花卉研究所,江西 南昌330200)
由辣椒疫霉菌(Phytophthora capsici Leonian)引起的辣椒疫病是辣椒上的一种毁灭性病害[1-3]。目前,该病在我国南北均有发生,以长江流域以及青海、陕西、甘肃、云南和广东等地发生严重[4]。长期以来,防治该病主要采用化学防治,这不仅严重污染环境,而且很容易使疫霉菌产生抗药性,因此培育抗性品种是防治辣椒疫病最行之有效的方法[5-6]。育种材料的抗性鉴定和筛选是培育抗疫病品种的关键,目前,辣椒疫病抗性鉴定的主要方法有灌根法、喷雾法和伤茎法等,关于离体叶接种法的相关报道还比较少[7-8]。本文利用游动孢子灌根法和离体叶接种法鉴定辣椒种质资源的抗病性,筛选出抗疫病的材料,并比较分析两种接种方法的相关性,为准确合理选育抗病材料提供理论基础和方法。
1 材料与方法
1.1 材料
1.1.1 供试菌株 用作灌根法的菌株为JA20,离体叶接种菌株选用来自江西赣州(GZ7)、南昌(NC7)、吉安(JA20)、上犹(SY7)共4 株菌株。菌株保存在15 ℃石蜡油中。试验时将这些菌株转接至胡萝卜琼脂培养基上,在25 ℃下培养5 d 使其活化后备用。
1.1.2 供试品种 试验所用的101 份辣椒材料(灌根法51 份、离体叶法50 份)来自国家种质库、江西、海南、云南、美国、日本、韩国等国家和地区,种类有长椒、灯笼椒、小米椒、簇生椒和朝天椒。
1.2 方法
1.2.1 游动孢子灌根法 对供试辣椒品种的种子进行消毒,营养钵育苗。当长至6 叶时选健壮苗进行灌根法接种。将菌株JA20 转接在胡萝卜琼脂培养基(200 g 胡萝卜榨汁,加入18 g 琼脂溶化,定容到lL)上,置25 ℃条件下培养7 d,获得大量孢子囊后将菌丝刮到无菌水中,用双层尼龙布过滤洗出,放入4 ℃冰箱中预冷30 min,促使游动孢子从孢子囊中释放出来,用血球计数板计算游动孢子的数量,无菌水稀释至每mL 约1 000 个游动孢子[9]。接种前一天将营养钵灌透水,接种用玻璃棒在距幼苗根茎约3 cm处钻一孔,孔深3 cm左右,将3 mL游动孢子悬浮液注入孔内。每个品种接10 株,重复3 次共30 株,接种后保湿12 h,以后适时浇水以保持土壤湿度近饱和状态,温度保持在(25 ±1)℃。从第5 天起开始调查病情,以后隔日调查。
1.2.2 离体叶接种法 试验在江西省农科院温室内进行,材料定植于塑料大棚内,栽培管理按常规进行。在辣椒花期期间,从健壮植株摘取叶片,选取植株上部刚好完全展开、龄期一致的壮叶,用灭菌水冲洗干净后,以无菌纱布吸取表面水分,然后在培养皿内垫上两层消毒湿润纱布,纱布上垫放三根牙签,将叶片正面朝上排放于其上。用直径6 mm 打孔器打取菌饼,菌面朝下置于叶片中间,每品种接种5 叶,之后置于25 ℃、12 h 光暗交替的恒温箱中促使其发病,72 h 后观察并记录发病情况。
1.2.3 分级标准和病情指数计算 灌根接种法分级标准:0 级:无病;1 级:幼苗根茎部轻微变黑,叶片不萎蔫或可恢复性萎蔫;2 级:幼苗根茎部变黑达1 ~2 cm,叶片不可恢复性萎蔫,下部叶片偶有脱落;3级:幼苗根茎部变黑超过2 cm,叶片明显萎蔫或落叶明显;4 级:幼苗根茎部变黑缢缩。除生长点外全部落叶或植株萎蔫;5 级:植株枯死。离体叶接种法病斑分级标准:0 级:无病症;1 级:病斑限于接种菌块边缘外0.5 cm 以内;2 级:病斑扩展到接种菌块边缘外0.5 cm 至病斑占1/3 叶面积;3 级:1/3 <病斑占叶面积≤1/2;4 级:1/2 <病斑占叶面积≤3/4;5 级:病斑占叶面积3/4 以上。
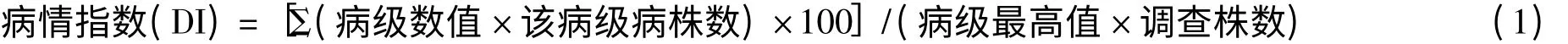
品种群体抗病性划分标准:高抗(HR):病情指数≤10;抗病(R):10 <病情指数≤30;中抗(MR):30<病情指数≤50;感病(S):病情指数>50。
2 结果与分析
2.1 灌根法鉴定结果
2.1.1 辣椒种质资源对疫病的抗感表现 对51 份材料进行抗病性鉴定,鉴定结果见表1。从表1 可以得知,以接种11 d 为评价材料的抗感程度标准,鉴定材料中感病材料有21 个,中抗材料有9 个,抗性材料有9 个,高抗材料有12 个,感病材料所占比例最大,为41.20%。调查发现,V42 -1、V7 -3、V14 -5、V34 -1、B6 等材料高度感病,在接种16 d 后病情指数达到或接近100;而T3 -1、富根、V48 -2、T10 -1 等材料高度抗病,几乎达到免疫级别。
2.1.2 发病速度分析 鉴定材料V34 -1 发病速度极快,接种3 d 开始发病,5 d 病情指数就达到了56。另外感病材料V14 -2(长椒)、B6(长椒)、V27 -1(长椒)、DC -2(长椒)、T20 -2(长椒)、V14 ×T36(长椒)、B10(簇生椒)、V7 -3(灯笼椒)等发病速度较快。调查发现材料T3 -1、富根、V48 -2 在接种16 d 后仍然表现免疫,而其他高抗材料均已发病或病情加重;通过观察发现,感病材料V41、B18 ×吉、V42、V34 -1、V14 -5、V36 -1、V42 -1 在接种16 d 后植株全部枯死。对发病程度趋势进行分析可知,一般情况下,感病材料其发病速度较快,而越抗病的材料发病速度越慢,从图1 中也可看出,越感病的材料其曲线的总体坡度就越陡,越抗病的材料其曲线的总体坡度就越平缓。
2.1.3 材料抗感性与类别的关系 通过分析辣椒材料的抗感性和材料的分类及来源关系可知,6 个灌木材料(V25、B40、B41、五M-1、麻栗坡、涯米)和2 个朝天椒(紫椒、邱北-4)均对疫病表现出不同程度的抗性,这说明在江西省内灌木和朝天椒对疫病有一定的抗性,而来自国家种质库的4 个灯笼椒(V42、V42-1、V7 -3、V7 -7)在接种11 天后均对疫病表现出较高的感病性,灯笼椒V -17 在接种16 d 后也表现出极高的病情指数;通过对来自国家种质库的17 个长椒和来自江西的17 个长椒的感病性分析,表现抗病性有19 份长椒材料,其中7 份(占国家种质库长椒的41.2%)来自国家种质库,12 份(占江西省长椒的72.2%)来自江西省;表现感病性有15 份材料,其中10 份(占国家种质库长椒的58.8%)来自国家种质库,5 份(占江西省长椒的27.8%)来自江西省。另外,来自日本的富根表现出极强的抗疫病能力,V48 -2 也对疫病表现出很强的抗性能力,其原产地为泰国,属长椒类,在生产中表现出很强的抗逆性,来自贵州的簇生椒B10 则表现出感疫病。
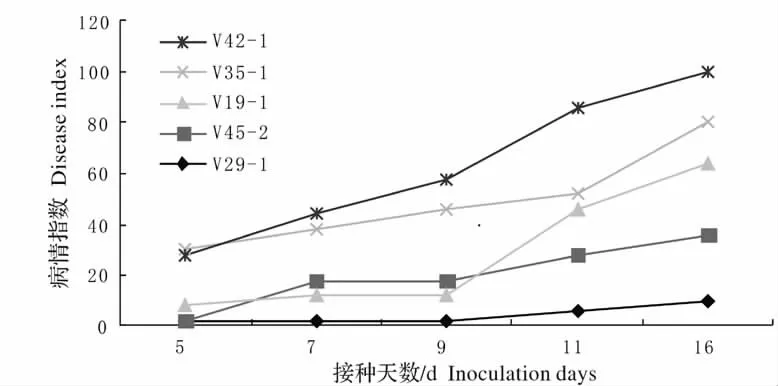
图1 部分材料的发病速度Fig.1 The disease rate of some varieties
2.2 离体叶鉴定结果
2.2.1 辣椒种质资源对疫病的抗感表现 由表2 的鉴定结果可知,50 份辣椒材料对4 个菌株表现的抗感性差异较大,其中V7 -17、CtjH1、CtjH2、XJ -20 -B、T40 -C、T3 -2、V48 -2、T3 -1、T12 -4、T36、T11 -3、T19 -3、T10 -1、XJ26、五M-1 等15 个品种对4 个菌株均表现出不同程度的抗性,15 个品种中T10 -1、T11 -3、T19 -3、T3 -1、T3 -2 表现出极强的抗性,说明对疫病有较好的抗性。而朝天椒FB 簇生、XJ8、DC、DC-8、Ctj-1、DC -3、T5 -1、XJ -1、E102 -5、T28 -4、T28 -3、B41、B40 -2 单、T28 -2、B10、V42 -1、V14 -5、V7 -3、T37 -2 等19 个品种对4 个菌株均表现出不同程度的感病性,这19 个品种中以XJ8、Ctj-1、B41、B40 -2 单等4 份材料的病情指数均超过80,说明它们极易感疫病。
2.2.2 菌株的致病力分化 从表2 中可看出,4 个菌株的致病力存在着较为显著的分化。4 个菌株的致病率(注:致病率=发病辣椒品种数/接种辣椒品种数×100%)大小顺序为:NC1 >GZ7 >SY7 >JA20,致病率分别为68%、64%、50%、46%。不同菌株的致病辣椒品种不同,同一个辣椒材料对不同的菌株表现不同的抗病性。这就存在着一个现象:同一个辣椒材料对致病率大的菌株表现抗病,而对致病率小的菌株却表现为感病。如在表2 中材料D02 对菌株NC1 表现中抗,而对菌株GZ7 却表现感病,材料T20 -2 对菌株GZ7 表现为抗病,而对菌株SY7 却表现为感病。
对4 个菌株的致病力相似性进行分析,抗性评价在4 个菌株中均表现一致的材料有22 份,在3 个菌株中表现一致的材料有18 份,2 个菌株中表现一致的材料有10 份,各不相同的材料有0 份。
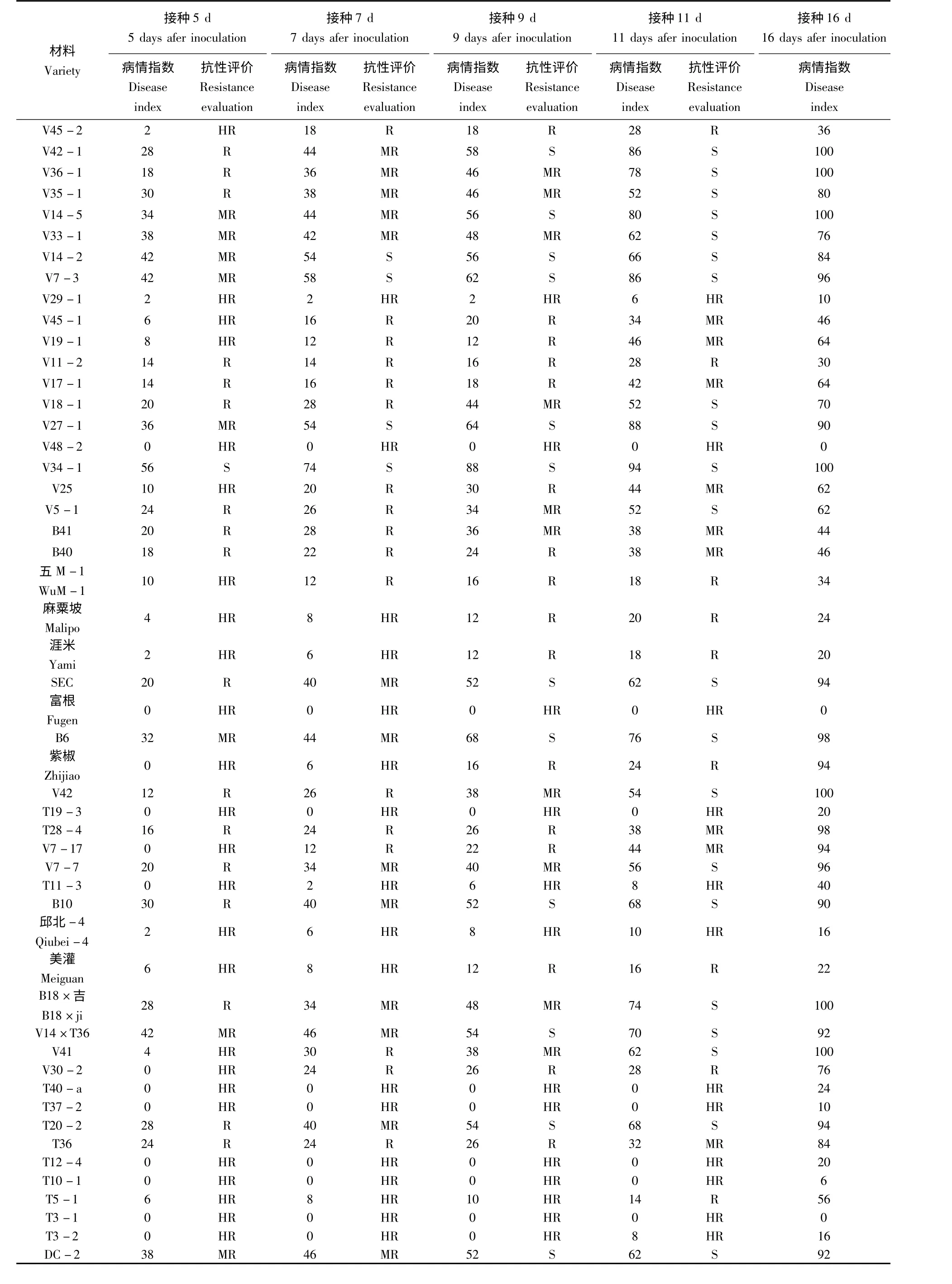
表1 辣椒材料灌根法抗疫病鉴定结果Tab.1 The resistance of peppers to Phytophthora capsici by root-irrigating method
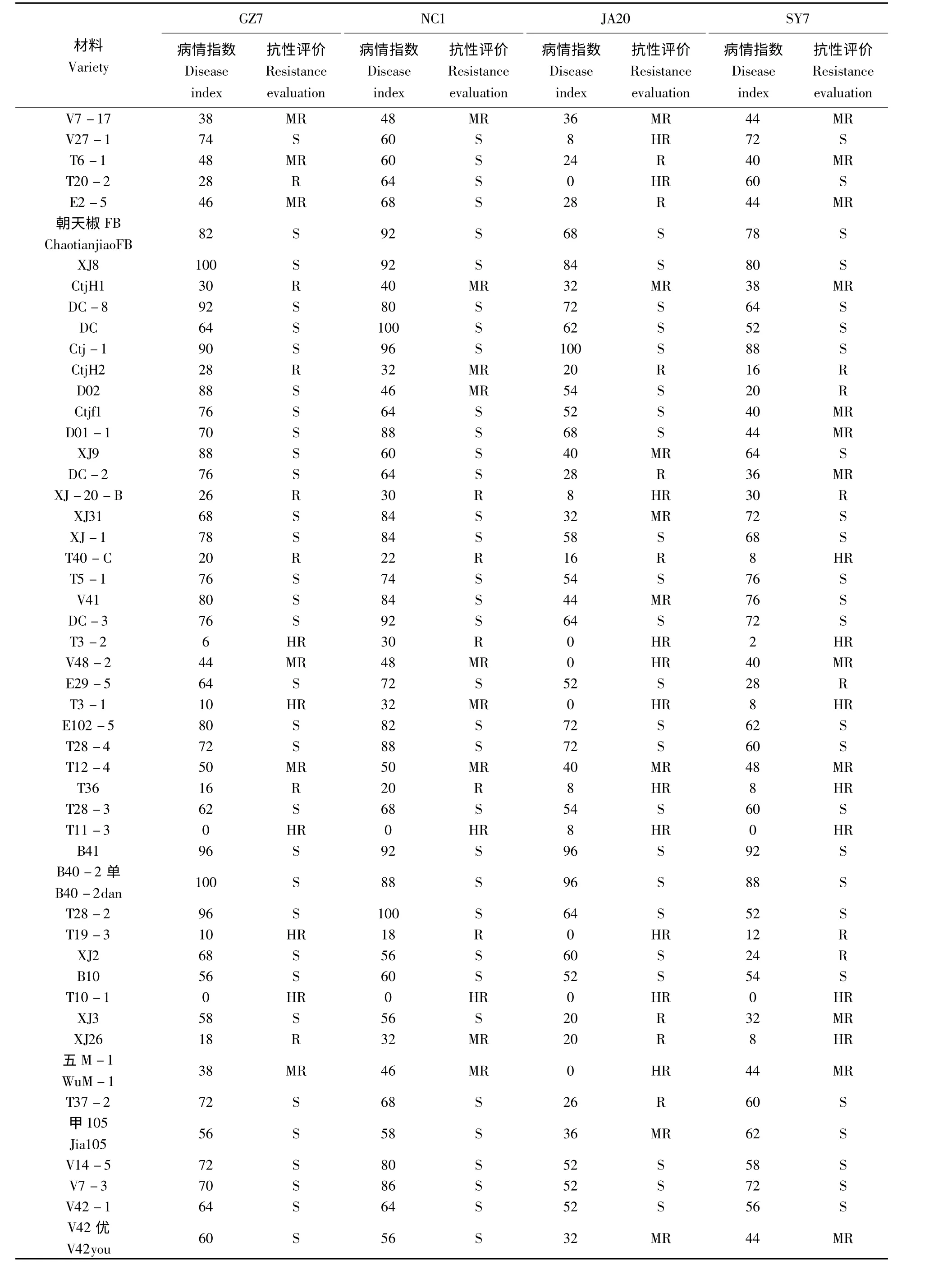
表2 辣椒材料离体叶接种抗性鉴定结果Tab.2 The resistance of peppers to Phytophthora capsici by in vitro leaf method
2.2.3 材料抗感性与类别的关系 通过对离体叶片抗感性和材料来源及种类的关系分析得知,来自韩国的簇生椒朝天椒FB 和来自贵州的簇生椒B10 对4 个菌株均表现出感病性,圆锥椒E102 -5 对4 个菌株都表现感病,3 份朝天椒有两份(CtjH1、CtjH2)表现出较好的抗疫病性,而3 份小米椒有两份(B40-2 单、B41)对4 个菌株均有很高的病情指数,说明其较易发病,3 个灯笼椒中抗病的1 个(V7 -17),感病的2 个(V7 -3、V42 -1)。34 份长椒中,对4 个菌株均表现抗病的有11 份(占32.4%),对4 个菌株均表现感病的也有11 份(占32.4%)。
2.3 两种方法的比较
根据2.1 和2.2 的试验结果,对18 份材料进行了抗感性比较,结果见表3。从表中可以看出,两种方法的鉴定结果较为一致,相似性程度较高,18 份材料中有14 份表现一致,占77.78%,表现不一致的主要为江西长椒,这4 种材料表现不一致的均是离体下为感病而灌根为抗病。对两种方法进行相关性分析,两者的相关性系数为0.597 6,相关性水平较为正显著。
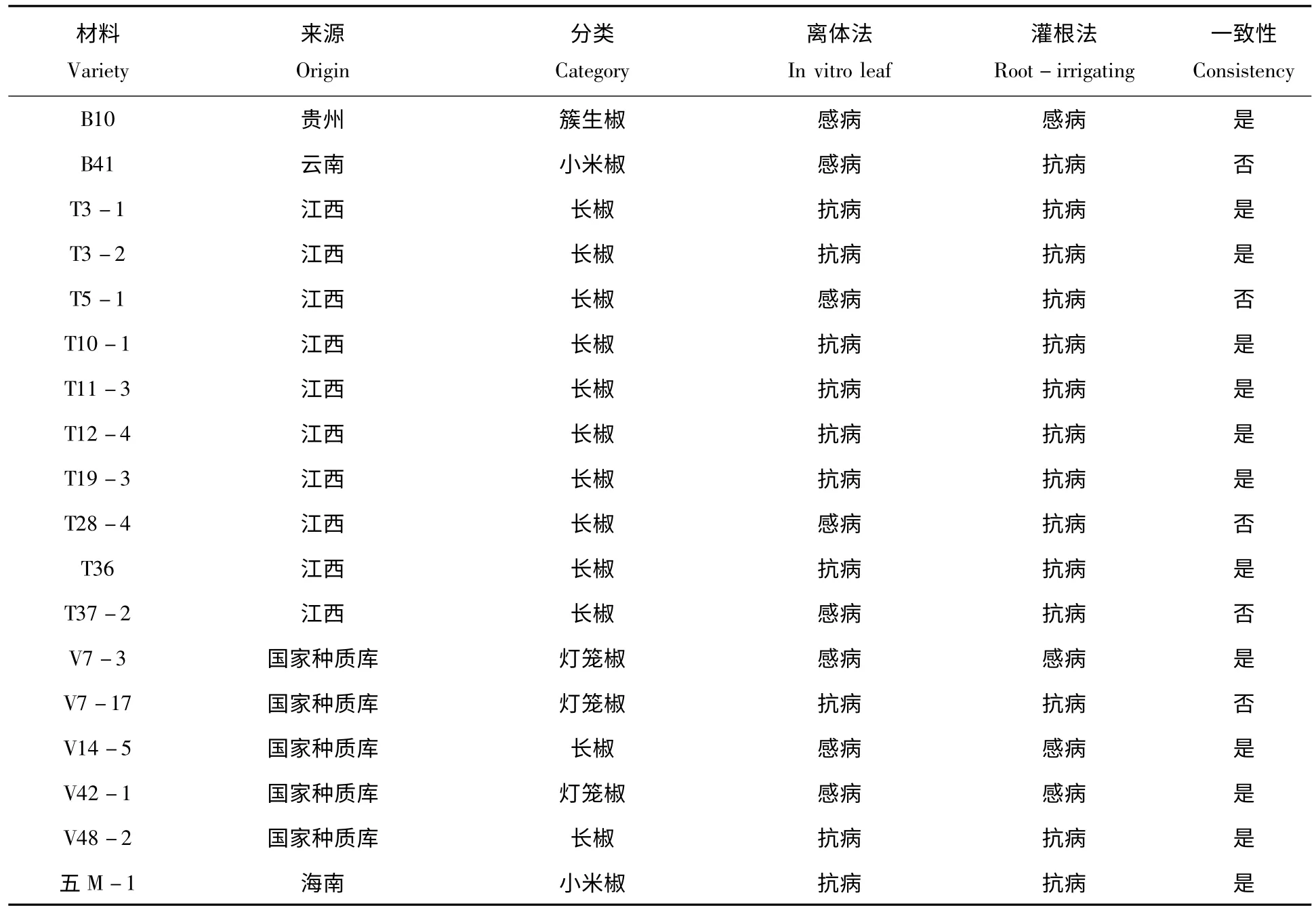
表3 18 份材料离体接种与灌根法的抗感性比较Tab.3 The resistance of 18 peppers to Phytophthora capsici contrasted between in vitro leaf and root-irrigating methods
3 讨论
我国在辣椒抗疫病育种方面起步比较晚,前人在资源抗性鉴定评价方法等取得了一定的成就[10-12]。本研究用离体叶法和灌根法对101 份辣椒材料的疫病抗性进行了鉴定,并对这两种方法进行了比较,用这两种接种方法均可将辣椒品种对疫霉菌的反应区分开来。从抗性鉴定结果的符合程度及相关性分析,离体叶法与灌根法的鉴定结果基本接近,两种鉴定方法的鉴定结果具有较为显著的正相关性。
根据试验发现,两种方法各有特点,可以根据需要选择适宜的接种方法。灌根法比较接近于辣椒疫病在田间的侵染过程,其鉴定结果更具有真实性。离体叶法的优点是快速,在短时间内能检测很多品种,并且取植株叶片,对植株后期生长无影响,适合于对稀有辣椒材料的抗性鉴定。使用离体叶法进行抗性鉴定时,应注意采摘龄期相当的叶片来进行试验。在本试验的研究过程中发现,灌根法中鉴定为抗病的材料有少数在离体叶中表现为感病,这也说明了利用离体叶法筛选疫病抗性源或材料时可能会造成抗性材料的遗漏或抗性基因的丢失。
以往对辣椒疫病鉴定往往只采用一种菌株进行。本试验用不同的菌株对辣椒种质资源进行了抗病性的鉴定。结果表明不同菌株致病力分化明显,显然用一个菌株鉴别出来的辣椒品种抗病性,其抗性结果代表性是有限的。所以在试验中应尽可能多地采用多种菌株进行抗性鉴定,以期得出品种完整、全面的抗性表现结果。
在灌根法鉴定过程中,笔者调查发现感病植株病情会随着时间变化,接种时间越长病情越重。在接种后16 d 调查发现很多植株达到或非常接近死亡级别。许多研究[13-15]将接种疫病调查时间定为7 d,但在本试验中有部分材料在接种7 d 时未见发病或发病极轻,而在11 d 时突然表现比较感病;而有的材料(如V34 -1)在接种3 d 时就表现出感病症状,所以接种后系统的过程调查对于客观评价材料的抗性至关重要,进而为筛选出合适的材料提供准确的信息。对材料进行筛选时根据材料的发病速度也可以判定其抗病情况,发病越早越快的材料必定抗病性差。
本试验鉴定表明,材料V48 -2、富根、T3 -1 抗病表现达到了免疫级别。来自日本的富根在我国北方的一些地区被用作辣椒嫁接的砧木材料,V48 -2 其原产地为泰国,属长椒类,在生产中表现出很强的抗逆性,是一个很好的抗病育种辣材。本实验中材料紫椒、T28 -4 等到接种16 d 时观察病情指数突然暴升,甚至超过很多感病材料,其原因有待于进一步研究。
[1]李智军,龙卫平,郑锦荣,等.辣椒疫病抗性离体叶鉴定法研究[J].华南农业大学学报,2007,28(2):47 -51.
[2]高萍,娄本琴.辣椒疫病的发病因素及综合防治[J].河南农业,2012,21:29 -29.
[3]王云梅,罗晓玲,杨馨,等.大棚辣椒疫病生物药剂田间药效试验[J].四川农业科技,2012,10:42 -43.
[4]李萍,江涛,高智谋,等.辣椒疫霉(Phytophthora capsici)对辣椒的致病力分化研究[J]. 植物病理学报,2012,42(4):431 -435.
[5]刘畅.辣椒疫病生物防治的研究进展[J].安徽农学通报,2009,15(19):99 -101.
[6]易图永,张宝玺,谢丙炎,等.辣椒疫病三种接种方法的比较[J].中国蔬菜,2003,2:16 -l8.
[7]Bosland P W,Lindsey P L.A seedling screen for phytophthora root rot of pepper,Capsicum annuum[J].Plant Disease,1991,75:1048 -1050.
[8]毛爱军,胡洽,耿三省.辣椒疫病菌接种鉴定技术研究[J].北京农业科学,1998,16(2):21 -24.
[9]郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1997.
[10]Polach F J.Identification of strains and inheritance of pathogen city in Phytophthora capsicum[J].Physiopathology,1972,62:20 -26.
[11]Kim E S.Virulence to Korea pepper euhivars of Phytophthora capsicum from different geographic areas[J].Plant Disease,1992,76:486 -489.
[12]Gilortega R. Genetic relationship among four pepper genotypes resistance to Phytophthora capsicum[J]. Plant Breeding,1992,108:118 -125.
[13]冯东昕,李宝栋.辣椒疫病病原菌及抗病育种研究进展[J].中国蔬菜,1999,2:48 -52.
[14]杨新成,胡明文,李正丽.辣椒抗疫病育种材料鉴选[J].贵州农业科学,2011,39(5):131 -132.
[15]李屹,田晓丽.辣椒资源材料抗疫病鉴定及主要农艺性状评价[J].北方园艺,2012,14:138 -141.

