硅肥对雷竹林生长影响研究
戎洁庆,潘 月,桂仁意
(浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安311300)
硅是植物生长发育的重要元素,尤其是提高植物对生物和非生物胁迫的抗性方面有着重要作用。大量研究表明:硅参与调节水稻各种生理生化代谢过程,对水稻生长发育具有良好的促进作用,其中包括能促进水稻幼苗的生长[1];施硅水稻叶片增厚,维管束加粗,叶细胞内线粒体增多,叶绿体较大,叶片中ATP 含量增加[2],而且施硅不同程度地延缓成熟期剑叶叶绿素含量的下降,提高光合速率和气孔导度,降低胞间CO2浓度,改善叶片光合功能[3];施硅促进水稻对光的吸收,改善冠层受光姿态,增大最适叶面积,降低消光系数,促进光合作用[4-5]。硅还能缓解汞对菲白竹、铺地竹、黄条金刚竹毒害作用[6]。
1926 年美国加州大学Sommer 率先提出硅是水稻良好生长所必需的元素之后,人们对硅元素的研究越来越重视,德国和美国先后利用熔渣研制成肥料(即硅肥)来施用。近几年在喜硅作物水稻、小麦、甘蔗等作物试验证明,施硅肥能促进水稻、小麦、甘蔗增加产量、提高品质等。
雷竹(Phyllostachys violascens)是优良的笋用竹种,是硅富集作物之一。前人研究发现,水稻等禾本科植物的含硅量较高,属于硅富集作物。笔者团队从水培雷竹苗的预实验发现,禾本科雷竹对硅的吸收随培养液的硅浓度增加而增强,且硅能缓解雷竹受干旱胁迫的影响。雷竹每年要从土壤中带走大量的硅素养分,导致硅素供应不平衡问题日趋凸显。赵送来等[22]发现,雷竹林土壤不同土层有效态硅的含量和所占的比例随种植年限(0 ~10 年)和有机物覆盖年限的增加呈下降趋势。故本文选取经营10 年的雷竹林为研究对象。雷竹林缺硅有可能降低雷竹的生长、产量和品质,弱化叶片光合功能,增加受干旱、冻害及锰、汞等重金属胁迫的危害。雷竹林在长期的经营过程中,常出现立地生产力衰退现象,尤其是林地覆盖雷竹林,且日趋严重。雷竹林施硅肥可以有效缓解硅元素供需矛盾,但由于目前硅肥应用研究重点集中于水稻、小麦等粮食作物上,对于雷竹林施硅肥的效果仍缺乏针对性的研究。
本文以种植年限为10 年的雷竹林研究对象,研究施高效硅肥对雷竹生长和土壤供硅能力的影响,旨在揭示雷竹林施硅肥的时间和施用量,为雷竹林生产施用硅肥和改善立地生产力的提供理论依据。
1 材料与方法
1.1 供试材料
试验于2012 年浙江雷竹示范园区核心区临安市太湖源镇横徐村进行。该地区属中纬度北亚热带季风气候,温暖湿润,四季分明,年均降水量为1 460 mm,年平均气温为15.8 ℃,7 月最热,1 月最冷。年平均日照时数为1 939 h,无霜期234 d。采样地属低山丘岭地貌,海拔高度在150 m 左右,样地为水稻田改制而成的雷竹林地。试验地雷竹林采用集约经营栽培模式。土壤为黄壤土,pH 值3.92,有效硅含量51.3 mg/kg,全氮含量2.16 g/kg,有机质含量42.19 g/kg,速效磷231 mg/kg,速效钾184 mg/kg,碱解氮212 mg/kg。
供试材料取自种植年限为10 年的雷竹林,为新竹的冠层中部枝条上的叶片和林地土壤。
1.2 试验设计
试验采用小区设计,4 个处理,4 次重复,随机区组排列,小区面积30 m2。硅肥为常熟市陆富新型肥料研发有限公司生产的高效硅肥,含可溶硅>50%,含钾3% ~5%。各处理硅肥施用量水平为:0、75、225 和675 kg/hm2,分别记作CK、T1、T2、T3。试验于2012 年5 月中旬,即新竹抽枝长叶前1 个月,施无机复合肥(N∶P2O5∶K2O=15∶15∶15)2.1 t/hm2和硅肥,作基肥一次性施入土壤。
1.3 测定项目与方法
1.3.1 叶片硅含量测定 分别在施肥后1、2、3、4 和5 个月于每个重复小区里取3 株新竹冠层中部枝条上的成熟叶片,清洗表层所附泥土和灰尘,再用蒸馏水冲洗干净,105 ℃杀青30 min,65 ℃烘干,磨碎过筛(0.25 mm)后,采用50% NaOH 溶液在高压灭菌锅中121 ℃下灭菌20 min 提取植物中的硅含量,并用硅钼蓝比色法测定[7]。
1.3.2 土壤有效硅含量及pH 值测定 分别在施肥后1、2、3、4 和5 个月于每个重复小区里随机挖取3条土壤剖面,分别为表层0 ~10 cm,中层10 ~20 cm 和底层20 ~40 cm 土壤样品各约500 ~1 000 g,并将样品风干、研磨、过筛后备用。采用pH 4.0 的HOAc-NaOAc 缓冲液浸提,硅钼蓝比色法测定土壤有效硅含量[8]。采用土∶水为1∶2.5 在震荡机上震荡30 min,静置30min 后,离子电极pH 计测定上清液pH 值[8]。
1.3.3 叶片光合参数测定 施肥后4 个月,即植株完全展叶3 个月,于2012 年9 月21 日上午08:30—11:00在每个小区选取3 株具有代表性的新竹,采用德国WALZ 生产的GFS -3000 便携式光合-荧光测量系统测定冠层中部朝南成熟叶的光合参数净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2浓度(Ci),其中,水分利用效率(WUE)为Pn/Tr计算所得。测定时为保持环境的稳定性,设定光强为1 300 μmol/(m·s),CO2浓度为当前大气CO2浓度(400 ±20)μmol/(m·s),叶温度为(25 ±1)℃,每次测量3 个重复。
1.4 统计分析
数据统计和分析处理采用Excel 和SPSS 软件,运用Duncan 单因素方差分析各处理之间的差异显著性。
2 结果分析
2.1 叶片硅含量
表1 为施硅肥处理后5 个月内各处理叶片硅含量的变化范围,表2 为各处理叶片硅积累速率的变化范围。由表1 和表2 可知,各处理叶片的硅含量随施肥处理时间的增加而增长。4 个处理的叶片硅含量积累速率先上升后下降。这说明施肥后3 个月,即6 月份至8 月份,为雷竹叶片硅含量的积累期。由表2 可知,施肥硅肥较CK 硅积累速率和积累量高,叶片的硅积累速率和积累量随施肥量的增加呈现增长的趋势,相同处理时间的叶片硅含量随施肥量的增加呈现增长的趋势,T2 和T3 较CK 达到差异显著水平(P <0.05)。这说明施硅肥能促进雷竹对硅素的吸收总量和积累速率。而第5 个月硅积累速率随施肥量增加呈现下降的趋势,这说明雷竹叶片的硅积累到一定量后,雷竹对硅的积累速率开始下降。
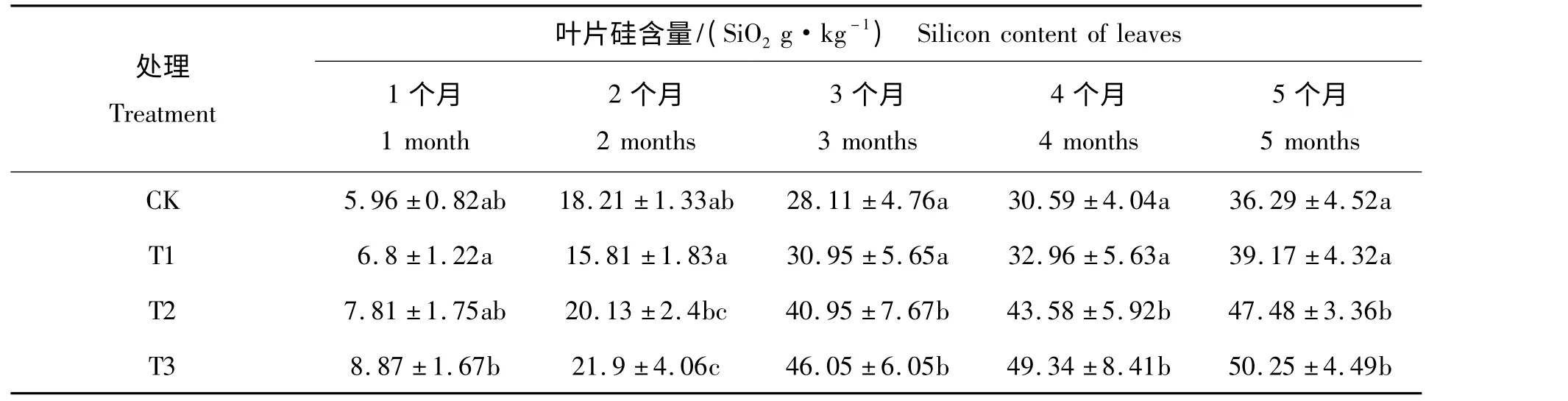
表1 不同施肥处理时间的叶片硅含量Tab.1 Silicon content of leaves in different treated time
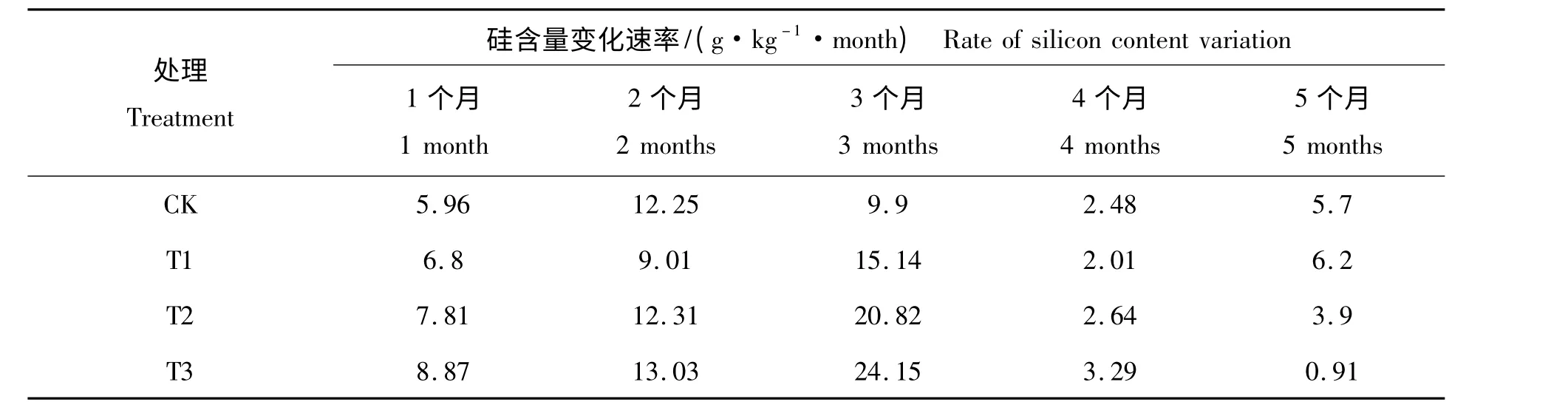
表2 不同施肥处理的叶片硅含量变化速率Tab.2 Variation rate of leaves silicon content in different treatments
2.2 土壤有效硅含量
表3 为土壤表层0 ~10 cm、中层10 ~20 cm 和底层20 ~40 cm 土壤有效硅变化范围。由表3 可知,土壤有效硅含量随土层深度的增加呈现增长的趋势。同处理时间下,土壤有效硅含量随施硅肥量的增加呈现增长的趋势,其中T3 的表层和中层土壤有效硅含量较其他处理达差异显著水平(P <0.05),T2和T3 的底层土壤有效硅含量较其他处理达差异显著水平(P <0.05)。各处理土壤有效硅含量随施肥处理时间增加呈现先下降后增长的趋势,表层和中层土壤有效硅含量随施肥处理时间增加略有下降,底层则几乎不变。这说明施硅肥有效地增加了土壤有效硅含量,有效硅含量保持稳定,且T3 的硅肥量较适合。
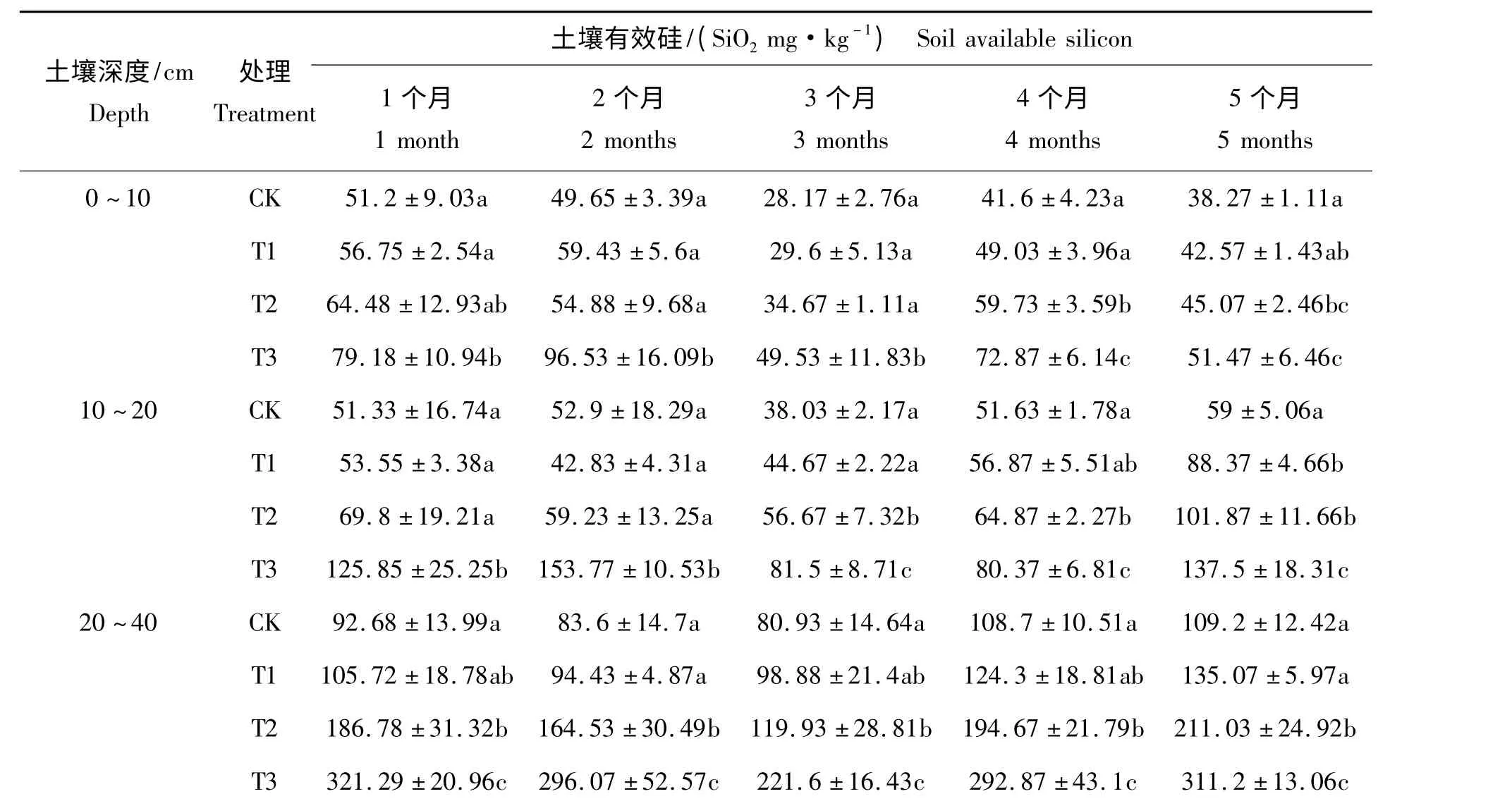
表3 不同施肥处理时间的土壤剖面有效硅含量Tab.3 Available silicon content with depth in the soil profiles in different treating time

表4 不同施肥处理时间的土壤剖面土壤pH 值Tab.4 Soil pH with depth in the soil profiles in different treating time
表4 为土壤表层0 ~10 cm、中层10 ~20 cm 和底层20 ~40 cm 土壤pH 值变化范围。由表4 可知,土壤pH 值随土壤深度的增加呈增长的趋势。同处理时间下,土壤pH 值随施硅肥量的增加呈增长的趋势。其中T3 的pH 值较其他处理达差异显著水平(P <0.05)。各处理的pH 值随时间的增加呈现增长后下降再增长的变化规律,处理5 个月各土壤深度pH 值较处理1 个月变化不大。这说明施硅肥能增加土壤pH 值,且T3 的硅肥量较合适。
2.3 光合作用参数
表5 为施肥4 个月时不同施硅肥处理对雷竹叶片光合作用的影响。由表5 可知,T2 和T1 净光合速率和水分利用率较CK 均有增加。T3 的净光合速率、蒸腾速率、气孔导度及水分利用率较CK 均有增加,且达到差异显著性水平(P <0.05)。施硅肥能提高雷竹叶片的光合作用。
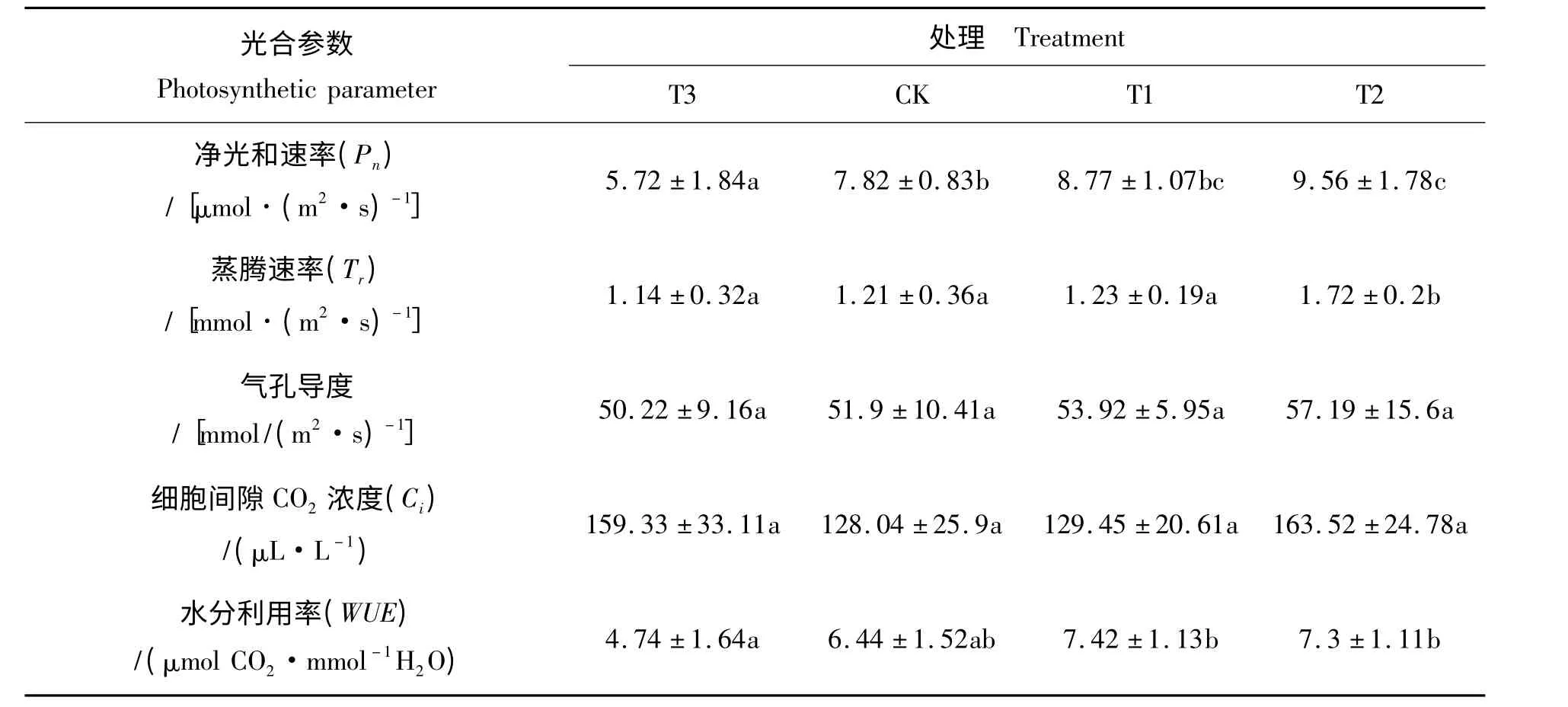
表5 不同施肥处理叶片光合作用参数Tab.5 Photosynthesis parameter of leaves in different treatments
3 讨论
3.1 叶片硅含量
硅在植物体内的分布存在着器官间的差异。一般丰产的水稻地上部分其含量可达干重的10%,叶片中的硅含量超过干重的15%,高者可达30%,遵循“末端分布规律”[9]。邢雪荣[10]发现硅在葫芦科植物冬瓜中的分布情况如下:老叶>成熟叶>幼叶>主茎>侧枝>果皮>果实及根。竹子中的各个器官之间的硅含量从0.3%到9.95%变化,分别是叶>枝>秆>根,叶中含有的硅含量超过了竹子总硅含量的60%[11]。故本试验选取成熟叶片作为雷竹硅积累的研究材料。
在pH <9 时,植物根系从土壤溶液中吸收不带电荷的水溶性单硅酸。单硅酸通过蒸腾流以液态硅酸的形式转运到植株地上部分,然后单硅酸脱水聚合为无定形二氧化硅(SiO2·nH2O),并沉积在植物组织内[12]。Marschner[13]研究发现硅在植物茎叶组织中的分布主要是由该部位的蒸腾速率决定的。龚金龙等[14]研究发现在水稻幼穗分化-抽穗期施硅肥,能有效提高抽穗期和成熟期硅素积累量及硅素利用效率。Ma et al[15]研究发现,在营养生长阶段和生殖生长阶段有40% ~50%的硅沉积在水稻叶片中,而在成熟阶段,只有20% ~30%的硅沉积在叶片。本试验在施肥处理1 个月到3 个月内,即6 月份至8月份叶片蒸腾速率为处理期间最大,6 月份也是雷竹抽枝长叶时期。较高的蒸腾速率和生长阶段的雷竹对硅的较高需求可能使叶片硅含量积累速率和积累量均较大。因此,在雷竹抽枝长叶前施硅肥有利于雷竹积累硅素。
Mitani 等[16]研究发现植物对硅的吸收模式根据对硅的积累程度不同可分为主动吸收,被动吸收和排斥吸收。水稻等禾本科作为喜硅植物对硅的积累及吸收远远超过根系外溶液中的硅浓度,属于主动吸收型。同时,T P Ding 等[11]研究发现竹子对硅素同时存在主动吸收和被动吸收,且土壤水溶液中的硅含量与竹子器官中的硅素含量呈正相关,被动吸收在竹子地上部分的硅素吸收和运输中起重要的作用,并受到硅的积累程度影响。本试验中T3 的叶片硅含量积累到一定量后,可能被动吸收减弱,故硅积累速率较对照下降。Ehsan 等[17]研究水稻中硅含量在pH5.5 红壤土随施硅量的增加呈增长的趋势。刘鸣达研究发现水稻植株体内硅的含量主要与土壤中硅的供给量有关,随土壤水溶态硅浓度增加而增加[18]。本试验随施硅肥量的增加,有效地补充了雷竹林土壤有效硅的含量,雷竹对硅素的吸收和积累随施肥量的增加而增长。
3.2 土壤有效硅含量
土壤有效硅是指土壤中可供当季作物吸收利用的硅素,包括土壤溶液中的单硅酸及各种易于转化为单硅酸的成分。前人研究表明施用硅肥,可促进土壤水溶态硅的释放,提高土壤活性硅的含量,促使土壤无定形硅向活性硅转化[19]。硅肥溶解到土壤中,增加了土壤中可溶性态硅和活性硅,单硅酸与土壤中Al、Fe 离子等反应成稳定的非晶形轻基铝铁硅酸盐,能提高土壤pH[20]。本试验硅肥为碱性,所以硅肥施入土壤后也使土壤pH 提高[19,21]。赵送来[22]研究西天目集约经营雷竹林土壤硅存在形态发现,土壤有效硅含量随土壤深度增加呈增加趋势。表层土壤有效硅含量可能受到淋溶作用和雷竹根系吸收,故较底层有效硅含量低。
3.3 光合作用
光合作用是植物生长的基础。硅通过在叶表皮层沉积而影响叶片的直立度,使叶片增厚,维管束加粗,叶细胞内线粒体增多,叶绿体变大,叶片中ATP 含量增加[2],促进光合作用。叶片中硅化细胞对散射光透过量是绿色细胞的10 倍[23],从而增加对光的吸收。此外,叶片厚度、叶绿体表面积、叶肉细胞壁的厚度、CO2膜透性及碳脱水酶活动与叶肉导度呈正相关[24-25]。Kelly C 等人研究发现生殖生长阶段水稻施硅较未施硅的光合速率高,且叶肉导度与光合速率呈正相关,认为光合速率的增加为非气孔限制所致,而是硅增加了叶片厚度、叶绿体表面积、叶肉细胞壁的厚度,进而增加了叶肉导度,促进了光合作用[5]。同时,从表5 可知,各处理间的气孔导度和细胞间CO2浓度均无显著性差异,说明硅增加雷竹叶片光合速率为非气孔限制。本试验结果显示,施硅肥可以增加了土壤有效硅含量的增加,可提高雷竹叶片对硅素营养的吸收,增加叶片硅积累量和积累速率,增加叶片厚度,促进雷竹的光合作用。施硅肥4个月已经能够对雷竹生长具有有效作用。
4 结论
研究表明,硅肥能促进雷竹生长。T3 的硅肥含量可以有效的增加雷竹林土壤有效硅含量,增加土壤pH 值,提高雷竹叶片对硅素营养的吸收,增加叶片硅积累量和积累速率,促进雷竹的光合作用,进而促进雷竹生长。建议在雷竹抽枝长叶前期施硅肥,施肥量为675 kg/hm2,并可以和其他肥料一起作基肥施入。
[1]Hossain M T,Mori R,Soga K,et al. Growth promotion and an increase in cell wall extensibility by silicon in rice and some other Poaceae seedlings[J]. J Plant Res,2002,115 (1117):23 -27.
[2]Ma J F ,Yamaji N.Silicon uptake and accumulation in higher plants[J].Trends Plant Science,2006,11 (8):392 -397.
[3]王显,张国良,霍中洋,等.氮硅配施对水稻叶片光合作用和氮代谢酶活性的影响[J].扬州大学学报:农业与生命科学版,2010,31(3):44 -49.
[4]Epstein E.The anomaly of silicon in plant biology[J].Proc Natl Acad Sci USA,1994,91(1):11 -17.
[5]Kelly C Detmann,Wagner L Araujo,Samuel C V Martins,et al.Silicon nutrition increases grain yield,which in turn,exerts a feed-forward stimulation of photosynthetic rates via enhanced mesophyll conductance and alters primary metabolism in rice[J]New Phytologist 2012,196:752 -762.
[6]汤玉香,谢寅峰.3 种观赏竹种对汞胁迫的生理响应及硅和稀土的调控作用[D].南京:南京林业大学,2007,6.
[7]戴伟民,张克勤,段彬伍,等.测定水稻硅含量的一种简易方法[J].中国水稻科学,2005,19(5):460 -462.
[8]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,1999.
[9]吴季荣,龚俊义.水稻硅营养的研究进展[J].专论与研究,2010,16(3):5 -8.
[10]邢雪荣,张蕾.植物的硅素营养研究综述[J].植物学通报,1998,15(2):33 -40.
[11]Ding T P,Zhou J X,Wan D F,et al.Silicon isotope fractionation in bamboo and its significance to the biogeochemical cycle of silicon[J].Science Diect,Geochimica et Cosmochimica Acta,2009,72:1381 -1395.
[12]高丹,陈基宁,蔡昆争,等.硅在植物体内的分布和吸收及其在病害逆境胁迫中的抗性作用[J]生态学报,2010,30(10):2745 -2755.
[13]Marschner H.Mineral nutrition of higher Plant[M].San Diego:Academic Press lnc,1995.
[14]龚金龙,胡雅杰,龙厚元,等.不同时期施硅对超级稻产量和硅素吸收、利用效率的影响[J].中国农业科学,2012,45(8):1475 -1488.
[15]Ma Jian Feng Y.Miyake and E.Takahashi.Silicon as a beneficial element for crop plants[M].In:Silicon in Agriculture.Elsevier Science Publishing,New York.2001,8:17 -39.
[16]Mitani N,Ma J F.Uptake system of silicon in different plant species[J].Journal of Experimental Botany,2005,56(414):1255 -1261.
[17]Ehsan Tavakkoli,Graham Lyons,Peter English,et al.Silicon nutrition of rice is affected by soil pH,weathering and silicon fertilization[J]J Plant Nutr Soil Sci,2011,174:437 -446.
[18]刘鸣达,张玉龙.水稻土供硅能力评价方法及水稻硅素肥料效应的研究[D].沈阳:沈阳农业大学,2002,5.
[19]刘鸣达,张玉龙,李军,方海霞.施用钢渣对水稻土硅素肥力的影响[J].土壤与环境,2001,10(3):220 -223.
[20]李学垣.土壤化学及实验指导[M].北京:农业出版社,1997.
[21]张伟,王文党,战玉林,等.吉林省东部水稻土有效硅状况及硅肥效应研究[J].土壤通报,1994.25(1):37 -39.
[22]赵送来,宋照亮,姜培坤,等. 西天目集约经营雷竹林土壤硅存在形态与植物有效性研究[J]. 土壤学报,2003,l49(2):331 -338.
[23]李发林.硅肥的功效及施用技术[J].云南农业,1997(9):16.
[24]Evans J R,Kaldenhoff R,Genty B,et al.Resistances along the CO2diffusion pathway inside leaves[J].Journal of Experimental Botany,2009,60:2235 -2248.
[25]Tholen D,Zhu X G. The mechanistic basis of internal conductance:a theoretical analysis of mesophyll cell photosynthesis and CO2diffusion[J].Plant Physiology,2011,156:90 -105.

