MSCT 激光定位下经皮肺穿刺并发症的影响因素
周静
随着医学影像学的快速发展,CT 引导肺活检作为一种安全有效的活检技术已广泛应用于临床,在肺部疾病诊断和治疗中的地位日益突出[1],而且其创伤小、准确性高[2]。MSCT 激光定位穿刺尽管是一种微创检查技术,但毕竟属有创性检查,因此不能避免并发症的发生。肺穿刺主要的并发症是气胸与出血,气胸是最常见的并发症,影响气胸发生率的因素较多[3-5]。本文对导致常见并发症发生的因素进行综合分析,旨在总结经验、减少并发症的发生率、提高肺穿刺的安全性。
材料与方法
1.一般资料
搜集本院2004年3月-2011年6月因肺部病变行经皮肺穿刺的197例病例,其中男123例,女74例,年龄20~86岁,平均61岁,病灶直径0.6~14.2cm。术前对所有患者行血常规与出凝血时间检查,全部患者术前均行常规MSCT 平扫,邻近纵隔及肺门的病变同时行增强扫描,以明确病变的位置、形态、血供及病变与心脏大血管的关系。
2.检查方法
检查设备采用Philips Mx8000 4层螺旋CT 机配备Pinpoint激光定位系统,穿刺针采用Cook公司生产的18~21G 同轴弹道切割式活检枪。MSCT-Pinpoint定位方法:根据CT 扫描确定肺内肿块性病变的位置,选择患者合适的体位,以病灶为中心进行扫描,扫描范围将病灶完全包括,然后输入Pinpoint软件,进行pinpoint校准,确认pinpoint系统正常,再依据监视器中实时显示的横轴面及矢状面模拟穿刺针进针角度和深度,选定好最佳穿刺层面和进针点,以pinpoint系统机械臂激光束于皮肤上的激光点为中心局部常规消毒铺洞巾,用2%的利多卡因局部麻醉。将同轴穿刺针的针尖置于皮肤激光点,针尾对准激光束,嘱咐患者呼气末阶段屏气,穿刺针根据激光束的导引快速进针,根据预先确定的进针深度将穿刺针的针尖插入病灶边缘,再行CT 扫描,结合多平面重组(multi-planar reformation,MPR)图像确认穿刺针尖的位置、方向正确后,行活检枪切割取材。取材完成后拔出活检枪,取出穿刺针沟内组织,用10%甲醛溶液固定,本组111例行2次及以上取材,直至标本满意后拔出穿刺针,用敷贴覆盖并局部按压,86例为单次取材,最后行常规全肺低剂量扫描,观察有无并发症,完成后送到病房继续观察,门诊患者在本科观察30min~1h。标本送病理室常规石蜡包埋切片。
结 果
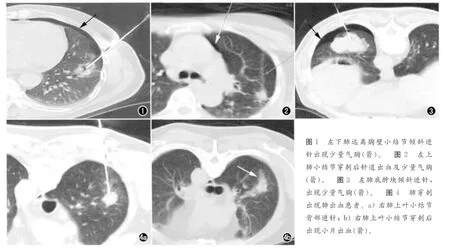
197例肺穿刺并发肺压缩10%以下气胸15 例(7.6%,图1、2),并发肺压缩15%~35%气胸3 例(1.5%,图3),临床仅行吸氧、平卧处理;并发肺压缩60%以上气胸1例(0.5%),临床进行胸腔闭式引流,住院1周治愈出院;所有气胸病例均在穿刺术中及术后30min内发生。并发肺出血18 例(9.1%,图4a、b),均在术中及术后常规扫描时发现,未作任何处理,1周后复诊均自行吸收消散。气胸及肺出血共存者12例(6.1%)。本组病例未发生大咯血、纵隔气肿、空气栓塞、针道肿瘤细胞种植或播散转移等并发症。
讨 论
经皮肺穿刺活检对肺内病变定性诊断的价值已经得到广大医师的认可,而如何减少并发症的发生一直是研究的热点,能有效避免严重并发症的发生是CT穿刺技术成熟的一个重要标志[6],其最主要的并发症是气胸及出血,Hiraki等[7]报道的一组1089例CT 引导下的肺穿刺活检病例,其气胸的发生率为42.3%,其中11.9%的患者需置管治疗,占总病例数的5%。Tsai等[8]报道的CT 引导下肺穿刺活检气胸的发生率为27.9%,需置管治疗者占6.6%;肺出血的发生率为14.8%,其中严重出血的发生率为0.3%。王灵枝等[9]报道经皮肺穿刺并发急性脑梗死l例,考虑为肺穿刺抽吸活检引起急性空气栓塞,造成脑梗死。另有相关文献报道因肺部穿刺活检而引起出血窒息和肺动脉栓塞并导致患者死亡的个案[10]。Ibukuro等[11]研究显示,CT 导引肺穿刺活检术引起针道种植性转移的发生率为0.56%;Sano等[12]认为CT 导引肺穿刺活检一般不会引起胸膜播散或胸壁种植转移。本组病例气胸发生率仅为9.6%,需置管治疗者仅1 例(0.5%);肺出血18例(9.1%),仅表现为沿针道分布或病灶边缘少许淡薄斑片状或云絮状阴影;气胸和肺出血共存者12例(6.1%),本组无其他严重并发症发生,并发症发生率明显低于文献报道。笔者回顾既往文献并结合实际操作经验,对并发症发生的原因进行综合分析,并以归纳。
1.患者自身存在的影响因素
患者在定位和活检过程中维持呼吸位置的一致性非常重要,这样既能保证穿刺的成功率,又能降低并发症的发生率,笔者在穿刺过程中使用了不同的屏气方式,包括平静呼吸中屏气、吸气后屏气、呼气后屏气、呼气末阶段屏气(吸气-呼气-屏气)。对以上几种呼吸方式进行比较,笔者认为呼气末阶段屏气是最容易重复的呼吸模式,也容易被患者接受,也有报道认为可在平静呼吸中不屏气进行操作[13]。病灶的大小、部位对并发症的发生也有影响,相关统计显示病灶>3cm 且距离胸膜3cm 以内者,特别是与邻近胸膜粘连或侵犯胸膜及胸壁的患者穿刺时气胸发生率极低,本组125例仅发生7例气胸,发生率为5.6%;这是由于病灶大,穿刺点选择面较广,受呼吸影响较小,而贴近胸膜使得穿刺针与肺组织接触减少。病灶<3cm 且距胸膜3cm以上者,并发症发生率明显增高,本组53例共12例发生气胸,发生率为22.6%。特别是病灶<2cm时,气胸发生率明显增高,本组12例气胸中有7例病灶小于2cm;6例进针距胸膜>4cm,最长达9cm;这是因为病灶较小时,随呼吸活动移动度较大,另外病灶离胸壁越远,穿刺针进针距离变长,进针时间增加,而穿刺针移动容易损伤邻近的肺组织,也就容易产生气胸[13]。裘敏剑等[14]对290例肺穿刺活检安全性分析结果发现,并发症的发生与穿刺针所经肺组织的长度呈正相关,当穿刺针所经肺组织的长度超过2cm 时,并发症发生率超过50%。本组103 例进针距离≥3cm,发生气胸15 例,发生率为14%,虽然低于文献报道,但发生率远高于胸膜下病变。
穿刺路径中存在肺气肿、肺大泡区域极容易导致气胸发生[2],文献报道合并肺气肿的患者气胸的发生率为34.3%[15],本组病例合并慢阻肺患者54例,其中12例并发气胸,发生率为22%,而其中病灶直径1.5~3.0cm 者4例,<1.5cm 者5例,发生率明显高于未合并慢阻肺者,故在实际操作中应尽量避开这些区域。另外为了避开一些重要解剖结构也需要改变进针方式,如双肺上叶的病变在穿刺点选择时需要避开胸椎横突、肩胛骨、女性乳腺及大血管等结构而被迫选取侧胸膜穿刺或前(后)偏侧胸膜穿刺点,该穿刺位置由于肋骨的解剖结构容易造成针胸膜夹角较小,进针手法别扭,从而导致较高的气胸发生率[4],本组病例针胸膜夹角为65°~90°者151 例,发生气胸7 例,发生率为4.6%;夹角为45°~65°者43例,发生气胸10例,发生率为23%;夹角小于45°者3例,发生气胸2例,随着针胸膜夹角的变小,气胸发生率明显增高。
并发肺出血的主要原因是穿刺路径中出现血管损伤,包括肿瘤血管、瘤周肺、纵膈、胸膜组织内血管,术前进行CT 增强扫描有助于周边血管分布情况的显示,定位时应尽量避免,可减少肺出血的发生率。如采用胸骨旁前方进入,必须选择紧邻胸骨内侧或距离胸骨边缘>2.5cm,以避免损伤乳内动脉,穿透胸壁过程中应避开肋骨下缘肋间动脉走行区域,以免损伤血管及肋间神经。
2.操作者的影响因素
对患者来说,仰卧位通常比俯卧位更容易坚持更长时间,对年纪偏大、体质较差、伴随慢性阻塞性肺气肿的患者尽量采取仰卧位,因为穿刺时患者需长时间保持一个特定的体位,俯卧位时患者往往难以坚持,容易移动体位和屏气不配合,从而造成穿刺针与肺组织的摩擦,导致并发症的发生。
因弹枪式不可分解切割针针芯与针体不可分解拆移,尾部手柄大而重,如果进针较浅、横向或斜向进针时,针尖因重力作用会发生移位,并易造成患者正常肺组织的划伤而导致发生并发症[2]。同轴弹道切割式活检枪由自动击发装置和活检针组成,两者可分离,同轴法活检的优点是可多角度、多次插入带槽针芯击发取材以获取足够的标本[16],由于其活检枪与穿刺针分开,穿刺时穿刺针较轻巧,容易把握,穿刺成功后又可进行多次、多点、多向切割活检,而不需重复穿刺路径,减少了对肺部及胸膜的反复损伤,从而降低了并发症的发生率。本组111例进行2次及以上取材,10例发生气胸,发生率为9%;11 例出现肺出血,发生率为9.9%。86 例为单次取材,发生气胸8 例,发生率为9.3%;7 例发生肺出血,发生率为8.1%。文献报道16G 和18G 穿刺针的粗细与术后气胸发生无相关性[17]。本组164例 使 用18G 切 割 针,33 例 使 用21G切割针。使用18G 切割针气胸发生率为9.7%(16/164),肺出血发生率为9.1%(15/164);21G 切割针两种并发症发生率分别为9%(3/33)、9%(3/33),18G和21G 切割针并发症发生率比较差异无统计学意义(P>0.05)。需注意的是,在取切割组织标本和拔除定位针时应将定位针针芯留于定位针内,以避免极为罕见但病死率很高的空气栓塞的发生[18]。
操作者穿刺手法技巧的掌握程度及对穿刺点的选择对并发症发生率有较大影响,笔者在进行穿刺的初期,并发症发生率相对较高,随着穿刺例数的增加,熟练程度及手法技巧的提高,并发症发生率明显降低。
综上所述,影响穿刺并发症发生率的因素较多,它们之间存在一定的相互关联,难以确定各自的独立影响因素,病灶越小、距胸膜越远、合并慢性阻塞性肺气肿的患者更容易发生并发症。术前根据患者情况进行综合分析,充分评估可能导致的影响因素,选择更加合理的穿刺工具、穿刺方法和熟练的穿刺技巧将有效降低并发症的发生率,提高肺穿刺的安全性。
[1] 陈克敏,黄蔚,吴志远.CT 引导下肺活检和并发症的预防[J].介入放射学杂志,2011,20(2):163-165.
[2] 尹智伟,辛喜娣,张译文,等.CT 导引下切割针在肺周围性病变穿刺活检中的应用[J].医学影像学杂志,2009,19(12):628-1631.
[3] Yeow KM,Su IH,Pan KT,et al.Risk factors of pneumothorax and bleeding:nultivariate analysis of 660CT-guided coaxial cutting needle lung biopsies[J].Chest,2004,126(3):748-754.
[4] 王培源,王霞,张林,等.肺穿刺活检中针胸膜夹角对气胸发生率的影响[J].中国临床医学影像杂志,2008,19(12):879-882.
[5] Choi CM,Um SW,Yoo CG,et al.Incidence and risk factors of delayed pneumothorax after transthoracic needle biopsy of the lung[J].Chest,2004,126(5):1516-1521.
[6] 黄振国,张雪哲.CT 导引下肺内病变穿刺活检影响气胸发生率因素分析[J].临床放射学杂志,2003,156(7):582-585.
[7] Hiraki T,Mimura H,Godara H,et al.Incidence of and risk factors for pneumothorax and chest tube placement after CT fluoroscopy?guided precutaneous lung biopsy:retrospective analysis of the procedures conducted over a 9-year period[J].AJR,2010,194(3):809-814.
[8] Tsai IC,Tsai WL,Chen MC,et al.CT-guided core biopsy of lung lesions:aprimer[J].AJR,2009,193(5):1228-1235.
[9] 王灵枝,高红.经皮肺穿刺并发急性脑梗死一例[J].介入放射学杂志,2007,16(11):792.
[10] Tomiyama N,Yasuhara Y,Nakajima Y,et al.CT-guided biopsy of the lung lesions:a survey of severe complication based on 9783 biopsies in Japan[J].Eur J Radiol,2006,59(1):60-64.
[11] Ibukuro K,Tanaka R,Takeguchi T,et al.Air embolism and needle track implantation complicating CT-guided percutaneous thoracic biopsy:single-institution experience[J].AJR,2009,193(5):W430-436.
[12] Sano Y,Date H,Toyooka S,et al.Percutaneous computed tomo-graphy-guided lung biopsy and pleural dissemination:an assessment by intraoperative pleural lavage cytology[J].Cancer,2009,115(23):5526-5533.
[13] 陈德顺.CT 引导下经皮肺穿刺活检34例临床分析[J].临床肺科杂志,2006,11(4):510.
[14] 裘敏剑,郑良伟,胡红杰.CT 引导下肺穿刺活检的安全性分析[J].中华结核和呼吸杂志,2002,25(2):86-88.
[15] 李国栋,周正荣,李文涛,等.CT 引导下经皮肺组织活检术常见并发症及体会[J].介入放射学杂志,2007,16(12):847-849.
[16] 贾宁阳,刘士远,李文涛,等.多层CT 引导下经皮同轴穿刺活检技术的临床应用[J].介入放射学杂志,2008,17(3):200-203.
[17] 钟涛,于红光,王勇,等.CT 引导下经皮肺穿刺活检术后气胸发生率的相关因素分析[J].中华放射学杂志,2007,41(11):1232-1236.
[18] Ghafoori M,Varedi P.Systemic air embolism after percutaneous thansthoracic needle biopsy of the lung[J].Emerg Radiol,2008,15(5):353-356.

