葡萄糖酸锰和氯化锰作为口服磁共振肝脏对比剂的实验研究
姚楠,高萌,张健,蒋翠花,黄德健,倪以成
Mn2+具有很强的顺磁性,导致T1弛豫时间缩短,并且可被肝细胞特异性摄取,使肝脏T1WI信号明显升高,是一种良好的肝脏磁共振阳性对比剂[1]。其中CMC-001是由丹麦CMC Contrast AB公司研制的一种口服新型含锰肝脏磁共振对比剂,已经进入三期临床研究[2],其主要应用集中于肝脏和胆道局灶性病变的诊断研究,如肝脏转移肿瘤和胆管肿瘤成像[3-4],其成像原理是锰口服后通过门静脉进入肝脏,被肝细胞摄取,蓄积在肝脏和胆道,因此可以提高肝实质和胆道的信号,而转移瘤病灶呈相对低信号,在T1WI图像上可以把肿瘤更清晰地区分出来,实现成像目的[5]。
锰口服后,主要在肠道吸收,但吸收效率通常很有限,因为在PH 值较高的小肠液里,锰变成不可溶的氢氧化物多聚体,影响了肠道对锰的吸收效率[6],从而使肝脏中锰不能达到有效含量,影响成像效果。相关畜禽饲料研究表明,螯合形式的有机锰在小肠中的吸收率高于无机形态的锰,因为螯合物可以防止金属元素在肠道变成不溶性化合物或防止金属元素被吸附在有碍元素吸收的不溶解胶体上,促进元素的吸收[7]。因此螯合锰可能提高肝脏中锰的含量,具有开发为口服锰磁共振对比剂的潜在价值。
本研究通过比较有机螯合物葡萄糖酸锰和氯化锰(CMC-001的主要成像成分)口服后对肝脏的磁共振增强效果和肝脏中锰的含量两方面的研究,为寻找安全有效的肝脏磁共振新型对比剂提供实验依据。
材料与方法
1.药品和试剂
四水合氯化锰(分析纯,西陇化工股份有限公司);葡萄糖酸锰(食品级,上海泰诺化工有限公司);锰储存液(国家标准溶液,国家钢铁测试中心冶金部钢铁研究总院);异氟烷(河北九派制药有限公司,110501);HNO3(优级纯,上海久亿化学试剂有限公司)。实验用水均为超纯水。
2.仪器
磁共振仪(美国GE EchoSpeed 1.5T),GE AW 4.3工作站;大鼠线圈(上海辰光医疗科技股份有限公司,CG-MUC18-H150-AG);TAS-990 型原子吸收光谱仪(北京普析通用仪器有限责任公司);MARS-5型微波消解仪(美国CEM 公司);Matrix VMP小动物麻醉机(北京吉安得尔科技有限公司);电热干燥箱(上海精宏DHG-9123A)。
3.实验动物
SD 大鼠,48只,全雄,体重(250±20)g,SPF 级,购自上海斯莱克实验动物有限责任公司,动物质量合格证号:SCXK(沪)2007-0005。
4.实验分组与设计
取SD 大鼠36只,分为3组,每组12只。组1:四水合氯化锰灌胃组;组2:葡萄糖酸锰灌胃组;组3:超纯水灌胃组。各组禁食12h后,分别灌胃,灌胃剂量为2mmol/kg,灌胃体积为10mL/kg。各组灌胃后分别在4h和8h处死6只大鼠,取出肝脏,放在80℃烘箱中烘干48h,称重。
取剩余SD 大鼠12只,分为2组,每组6只。组1:四水合氯化锰组;组2:葡萄糖酸锰组。两组禁食12h后吸入异氟烷麻醉,进行肝脏MRI扫描,扫描结束后分别灌胃,灌胃剂量和体积同前,之后分别在4h和8h再次进行肝脏MRI扫描。
5.肝脏样品预处理和测定
供试品制备:取肝脏样品0.5g,精密称定,置聚四氟乙烯消解罐内,加浓硝酸5mL 混匀,浸泡15min,再加硝酸5mL 并盖好内盖,旋好外套。置微波消解炉内消解(表1)。

表1 微波消解升温程序
取出冷却至室温后,聚四氟乙烯(polytetraflilroethylene,PTFE)内罐中的溶液以0.1%硝酸润洗至挥酸杯再置电热板上缓缓加热至红棕色蒸汽挥尽,并继续加热浓缩至约1mL,放冷,用纯水转移至50mL 容量瓶中,并稀释至刻度,摇匀即得[8]。
锰标准曲线的制备:精密量取不同浓度的锰标准溶液,采用原子吸收法测定吸光度,记录读数,以浓度为横坐标,吸收度为纵坐标,绘制标准曲线。回归得到方程为Y=0.2364x+0.0101,r=0.9998,结果表明Mn在0~4.00μg/mL范围内呈良好的线性关系。
精密度试验:精密吸取标准品溶液,分别连续进样6次,测定吸光度,计算RSD,RSD 为0.35%。
稳定性试验:取供试品,依法制备得供试品溶液,每隔2h进一次样品,共进6次,计算含量及RSD,结果RSD 为3.10%,说明样品在10个小时内稳定。
重复性试验:取相同的6份供试品,依法制备得供试品溶液,计算含量及RSD,结果表明,含量为16.90μg/g,RSD 为2.87%。
加样回收率试验:采用6份样品,每份0.25g,分别加入标准溶液进行测定,计算平均加样回收率为95.20%,RSD 为2.01%。
样品含量测定:按照样品前处理的微波消解操作对样品进行消解处理并得到样品溶液,根据标准曲线,通过下列公式计算出样品中的Mn含量。样品中锰的最终浓度=(样品浓度×50)/肝脏干重(单位:μg/g肝脏组织)。
6.磁共振检查
磁共振检查采用GE Excite Echospeed HD 1.5T超导磁共振成像设备,大鼠线圈。冠状面定位,常规行横轴面T1WI扫描,层厚3mm,层间隔0.2mm,视野10cm×10cm,矩阵224×192,激励次数2。T1WI SE序列,TR 550ms,TE 24ms。
7.磁共振图像分析
在每只大鼠SE-T1WI图像上选取肝脏图像最明显、连续的三个层面。在GE 后处理工作站AW 4.3上选取直径为3mm 的兴趣区(ROI),自动得到肝脏信号强度(singal intensity,SI),取连续三层SI的平均值代表肝脏的SI。采用下列公式计算肝脏的信噪比:

8.数据处理
所有实验数据均以平均值±标准差(±s)表示,采用SPSS 12.0软件进行统计学分析,组间比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1.大鼠肝脏中锰的含量
表2显示了大鼠分别灌胃两种锰溶液后4h、8h肝脏中的锰含量。由表可知,两种锰溶液灌胃后在相同的时间点,四水合氯化锰组大鼠肝脏中锰含量较葡萄糖酸锰组高,并随着时间的延长,两组肝脏中锰含量均减低,但两组之间锰含量差异无统计学意义(P>0.05)。

表2 两种锰溶液灌胃后4h和8h大鼠肝脏锰含量
2.MRI结果
图1、2分别显示了四水合氯化锰组和葡萄糖酸锰组大鼠灌胃前、灌胃后4h、8h肝脏MRI扫描图像;表3、4分别显示了四水合氯化锰组和葡萄糖酸锰组大鼠灌胃前、灌胃后4h、8h 肝脏信噪比、信号增强百分率和时间的关系。
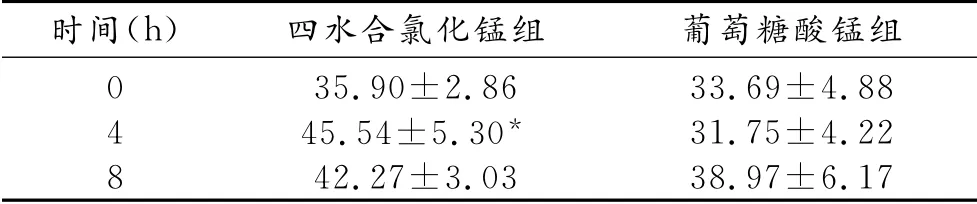
表3 各时间点大鼠肝脏T1 信噪比
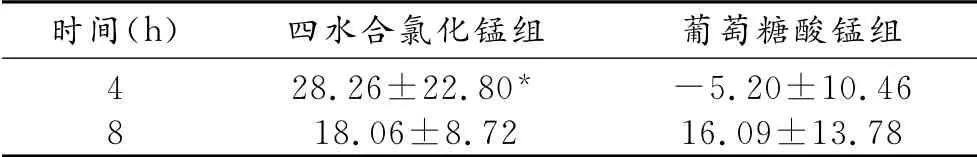
表4 各时间点大鼠肝脏T1 信号增加百分率
结合图表结果可知,大鼠分别灌胃两种锰溶液后,在相同的时间点,四水合氯化锰组大鼠肝脏的信号强度高于葡萄糖酸锰组,随着时间的延长,四水合氯化锰组大鼠肝脏的信号强度逐渐减弱,而葡萄糖酸锰组大鼠肝脏的信号强度逐渐增高。其中,灌胃后4h两组间T1信噪比和信号增加百分率差异均有统计学意义(P<0.01)。
配置相同摩尔浓度的四水合氯化锰溶液和葡萄糖酸锰溶液,将两种溶液分别装在5mL 注射器中,等距离放置在线圈里,进行磁共振T1WI扫描。图3显示了两种溶液的MRI扫描图像。在相同锰摩尔浓度(0.55μmol/mL)的情况下,四水合氯化锰溶液的信号强度(138.65±1.88)高于葡萄糖酸锰溶液(132.65±2.81),差异有统计学意义(P=0.0434)。
讨 论
目前全球广泛使用含钆磁共振对比剂,由于其会引起一种罕见但极其严重的疾病-肾源性系统纤维化,美国FDA 于2007年发布警告,要求修改含钆对比剂的说明书,以尽量减少使用该类药物[9]。而另一类顺磁性元素锰为人体必需微量元素,Mn2+最外层轨道上具有5个不成对的电子,能缩短水质子T1值,导致T1弛豫时间缩短,和钆具备相似的增强作用,成为继钆之后一种很有前景的磁共振对比剂[10]。
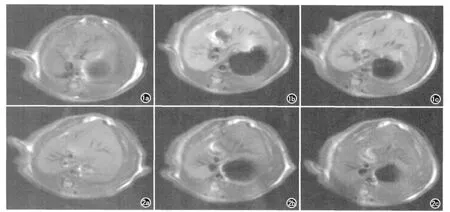
图1 氯化锰灌胃前和灌胃后大鼠肝脏磁共振图像。a)基线扫描图像;b)氯化锰灌胃后4h图像;c)氯化锰灌胃后8h图像。图2 葡萄糖酸锰灌胃前和灌胃后大鼠肝脏磁共振图像。a)基线扫描图像;b)葡萄糖酸锰灌胃后4h图像;c)葡萄糖酸锰灌胃后8h图像。
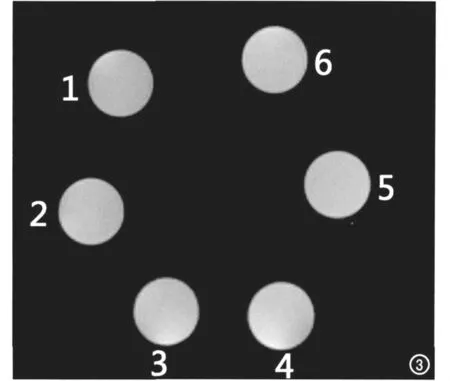
图3 同摩尔浓度氯化锰和葡萄糖酸锰溶液的磁共振图像。1,2,3 葡萄糖酸锰溶液;4,5,6 氯化锰溶液。
锰福地吡三钠注射液是世界上第一种肝细胞特异性锰类磁共振对比剂,已在临床使用多年[11],然而其缓慢推注的给药方式一方面增加了额外的费用和时间,另一方面使全身大部分脏器暴露在高浓度的Mn2+环境中,容易产生副作用,如脸色潮红、恶心、呕吐等[12]。口服给药一方面通过肝脏首过效应减少了锰的毒性,另一方面使Mn2+蓄积在肝脏,经过胆汁排泄,因此口服锰对比剂是一种安全有效的肝胆磁共振对比剂,目前正处于研究阶段[13]。
锰经肠道吸收后主要和a2巨球蛋白结合,通过肝门静脉进入肝脏,被肝细胞摄取[14]。一些促吸收剂如维生素C、D3、丙氨酸等可以促进锰在肠道的吸收,从而增强肝脏T1WI图像信号[15]。
葡萄糖酸锰是一种营养强化剂,人体吸收率高,广泛应用于食品、保健品、婴幼儿配方食品中补充矿物质锰。结合它的安全性和吸收性,本研究选用葡萄糖酸锰作为一种口服锰对比剂和CMC-001的成像成分氯化锰从磁共振成像效果和肝脏的锰含量两方面进行研究,从本组实验结果可见,口服氯化锰后,肝脏中的锰含量和磁共振增强效果呈正相关,即肝脏锰含量越高,磁共振增强效果越明显;而口服葡萄糖酸锰后,肝脏锰含量最高时(即灌胃后4h),磁共振强化效果反而最低。对此,本研究配制了相同摩尔浓度的葡萄糖酸锰和氯化锰溶液,浓度均为0.55μmol/mL(即两种锰溶液灌胃后4h大鼠肝脏中锰的平均含量),比较了两种溶液的T1WI图像,结果表明,氯化锰溶液的T1信号强度高于葡萄糖酸锰溶液(P<0.05),说明相同摩尔浓度的锰溶液T1信号强度可能和锰的存在形式有关,溶液中离子形式的氯化锰T1增强效果高于螯合物形式的葡萄糖酸锰。
结合前面的整体实验,灌胃两种锰溶液后4h,四水合氯化锰组大鼠肝脏锰含量略高于葡萄糖酸锰组(P>0.05),但磁共振增强效果前者明显高于后者(P<0.01),这种整体和体外实验的差异可能是由于体内环境和体外环境不同、肝脏中锰的存在状态不同所致。
无论从肝脏锰含量或磁共振增强效果来看,口服氯化锰皆优于葡萄糖酸锰,说明氯化锰更适合作为肝脏磁共振口服锰对比剂。
[1] Jφrgensen JT,Rief M,Brismar TB,et al.A new manganese-based oral contrast agent(CMC-001)for liver MRI:pharmacological and pharmaceutical aspects[J].Acta Radiol,2012,53(7):707-713.
[2] Albiin N,Kartalis N,Bergquist A,et al.Manganese chloride tetrahydrate(CMC-001)enhanced liver MRI:evaluation of efficacy and safety in healthy volunteers[J].MAGMA,2012,25(5):361-368.
[3] Brismar TB,Kartalis N,Kylander C,et al.MRI of colorectal cancer liver metastases:comparison of orally administered manganese with intravenously administered gadobenate dimeglumine[J].Eur Radiol,2012,22(3):633-641.
[4] Thomsen HS,Barentsz JO,Burcharth F,et al.Initial clinical experience with oral manganese(CMC-001)for liver MR imaging[J].Eur Radiol,2007,17(1):273-278.
[5] Chabanova E,Logager VB,Moller JM,et al.Manganese based MR contrast agents:formulation and clinical applications[J].Open Drug Saf J,2011,2(1):29-38.
[6] 武书庚,齐广海,郑君杰.有机微量元素研究进展[J].山东饲料,2002,10(1):4-5.
[7] 计峰,罗绪刚,刘彬,等.用原位结扎肠段灌注法研究有机锰在肉仔鸡小肠中的吸收特点[J].安徽农业大学学报,2005,32(2):132-135.
[8] 中华人民共和国卫生部.食品中铁、镁锰的测定[S].GB/T 5009.90-2003.
[9] Thomsen HS.Recent hot topics in contrast media[J].Eur Radiol,2011,21(3):492-505.
[10] Rief M,Huppertz A,Asbach P,et al.Manganese-based oral contrast agent for liver magnetic resonance imaging:evaluation of the timecourse and dose response of liver signal intensity enhancement[J].Invest Radiol,2010,45(9):565-571.
[11] King LJ,Burkill GJC,Scurr ED,et al.MnDPDP enhanced magnetic resonance imaging of focal iver lesions[J].Clin Radiol,2002,57(12):1047-1057.
[12] Bellin MF,Webb JA,Van Der Molen AJ,et al.Safety of MR liver specific contrast media[J].Eur Radiol,2005,15(8):121-127.
[13] Thomsen HS,Loegager V,Noergaard H,et al.Oral manganese for liver imaging at three different field strengths[J].Acad Radiol,2004,11(6):630-636.
[14] Andersen ME,Gearhart JM,Clewell HJ.Pharmacokinetic data needs to support risk assessments for inhaled and ingested manganese[J].Neurotoxicology,1999,20(2):161-171.
[15] Thomsen HS,Svendsen O,Klastrup S.Increased manganese concentration in the liver after oral intake[J].Acad Radiol,2004,11(1):38-44.

