地下水挥发性有机污染物自然衰减能力评价方法
谢云峰,曹云者,柳晓娟,孔祥斌,2,李发生*
1.环境基准与风险评估国家重点实验室,中国环境科学研究院,北京 100012 2.河北农业大学资源与环境科学学院,河北 保定 071000
地下水挥发性有机污染物自然衰减能力评价方法
谢云峰1,曹云者1,柳晓娟1,孔祥斌1,2,李发生1*
1.环境基准与风险评估国家重点实验室,中国环境科学研究院,北京 100012 2.河北农业大学资源与环境科学学院,河北 保定 071000
挥发性有机物是我国污染场地地下水中高频检出的污染物,在地下水中多以非水相液体(NAPL)形式存在,成为持久的污染源,具有较高的环境和健康风险。监测自然衰减技术以成本低,扰动小,无二次污染等特点越来越受到关注。概述了目前国外主要的地下水挥发性有机污染物自然衰减能力评价方法。60个污染场地的应用情况表明,污染物浓度趋势分析和水文地球化学指标方法的应用频率最高,简单的污染场地使用这两种方法可以准确评价地下水挥发性有机污染物的自然衰减能力,复杂的污染场地需要综合多种手段(微生物学方法,微宇宙实验,稳定同位素分析等)提高自然衰减评价结果的可靠性。稳定同位素分析方法既能指示污染物的降解途径,也能量化自然衰减的速率,是目前地下水挥发性有机污染物自然衰减评价研究最受关注的技术。
地下水污染羽;苯系物;卤代烃;生物降解;微宇宙实验;稳定同位素分析;微生物分析
挥发性有机物是地下水中常见的污染物,各类厂矿企业、加油站等的污染物泄漏对地下水水质影响非常突出。华北平原加油站抽样调查结果显示,20%的加油站存在渗漏和安全隐患,加油站附近的浅层地下水都受到不同程度的污染[1]。由于在地下水中溶解度较低,大量的挥发性有机污染物在地下以非水相液体(NAPL)形式存在[2],NAPL的存在成为一个持续的污染源,增加了环境污染风险和地下水修复的难度[3]。地下水有机物污染修复的方法主要有抽出处理(pump amp; treat)技术、原位化学处理技术、原位生物处理技术等。目前,抽出处理技术的应用频率最高,该方法对降低污染物浓度,控制污染羽扩大和迁移的效果很好,由于抽出处理技术存在明显的拖尾效应,要将污染物浓度降到很低的水平需要很长的时间,导致修复成本很高;原位化学处理技术的成本高,受场地条件影响很大,且可能导致二次污染;原位生物处理技术是通过强化污染物的生物降解过程达到消除污染目的,该技术的成本低,场地扰动小,近年来越来越受到重视[4]。
监测自然衰减技术是20世纪90年代发展起来的地下水污染修复技术,并在污染场地地下水修复中应用越来越广泛。美国超级基金场地地下水修复技术统计结果显示,2005—2008年实施修复的164个场地中,应用监测自然衰减技术的比例高达56%[5]。主动修复(抽出处理技术)和被动修复(自然衰减技术)配套使用已成为地下水污染修复的发展趋势[5]。污染物在地下水环境中同时发生对流、扩散、挥发、吸附和生物降解等过程,其中生物降解过程能将污染物转换成无毒无害的物质,即地下水自我修复过程。相关研究表明,场地中常见的挥发性有机污染物如氯代烃、苯系物(BTEX)等都能够被生物降解[4],大量场地调研结果证实挥发性有机物在地下水中均发生了不同程度的生物降解[6]。监测自然衰减技术主要是利用生物降解过程来降低污染物浓度,控制污染物的风险,或通过土壤介质的吸附作用降低污染物的活性。根据美国国家环境保护局(US EPA)对监测自然衰减的定义,应用监测自然衰减需要对污染地下水的自我修复能力进行评价,证实场地条件下生物降解过程能够在合理的时间内,将污染物的暴露风险控制在可接受的水平[7]。US EPA要求实施监测自然衰减的场地需开展长期的自然衰减效果跟踪监测,以确保污染物的自然衰减效果与预想的一致。笔者通过概述目前国际上主要的地下水挥发性有机污染物自然衰减能力评价方法,评价不同方法的优势与不足,探讨自然衰减评价方法的发展趋势,以期为我国开展地下水污染自然衰减能力评价提供方法参考。
1 污染物自然衰减能力评价方法
US EPA建议,确认场地发生自然衰减的三个依据为:1)地下水和土壤监测历史数据表明污染物总量和浓度表现出明显的降低趋势,且地下水污染羽浓度的降低不仅是污染羽迁移导致的结果;2)环境水文地球化学数据间接证实场地条件下发生的自然衰减过程;3)现场和微宇宙实验结果直接证实自然衰减过程的发生,以及自然衰减过程降解目标污染物的能力[7]。围绕上述依据配套了一系列的自然衰减能力评价方法,主要有污染物浓度(总量)趋势分析法、环境水文地球化学指标分析法、微生物学方法、微宇宙实验、稳定同位素分析等。
1.1 污染物浓度(总量)趋势分析
地下水中污染物浓度的变化趋势是评估自然衰减能力最重要的证据,在现有的自然衰减评价相关指南中均将污染物浓度变化趋势作为首要的证据[7-9],根据地下水中污染物浓度的时间变化趋势可以评估溶解污染羽(plume)所处的状态。污染羽的状态分为扩张、稳定和收缩,扩张状态指污染羽的范围还在扩大,污染羽中污染物浓度还在增加,污染物进入地下水的速率小于自然衰减的速率;稳定状态指污染羽边界保持稳定,污染物浓度没有明显的增加趋势,污染物进入地下水的速率与自然衰减速率相当;收缩状态指污染羽的范围缩小,污染物浓度降低,污染物进入地下水的速率小于自然衰减的速率[8]。如果地下水污染羽处于缩小和稳定状态,说明地下水的自然衰减修复作用在现有的场地条件下能控制污染物的扩散,可将污染物控制在一定范围内,能有效降低污染物的迁移暴露风险。如果污染羽处于扩张状态,说明自然衰减作用不能有效地控制污染物的迁移,不能达到风险控制的目的。
地下水污染羽状态评估方法分为统计方法和图形法。统计方法基于同一监测井多期监测数据,利用统计方法分析检验污染物浓度的变化趋势,常用的统计方法有Mann-Kendall检验和Mann-Whitney U检验等[7],为了评价整个污染羽所处的状态,通常需要有污染羽源区,中游和下游等不同区域多个监测井的多期监测数据[10-11];图形法通过对比多个时期污染羽的污染物等浓度分布图分析污染羽的状态,污染物浓度分布图包括整个污染羽的浓度分布图,单个监测井污染物浓度时间变化趋势,地下水流向上污染物浓度随迁移距离的变化趋势图等[12-13]。图形法可以定性评价污染物浓度变化趋势和溶解污染羽所处的状态,统计方法可以客观定量地评价污染羽所处的状态。在实际的应用中,通常是图形法和统计方法相结合。
1.2 水文地球化学指标分析
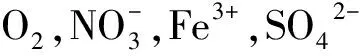

注:好氧呼吸以O2为电子受体;反硝化以为受体;铁还原以Fe3+为电子受体;硫酸盐还原SO42-为电子受体;产甲烷作用以CO2电子受体。
地下水中氧化还原电位(ORP),溶解氢,pH和温度等也可以辅助分析污染物的降解过程,一些微生物降解过程仅发生在特定的氧化还原条件范围内。ORP对生物降解的速率有一定的影响;溶解氢可以评估氧化还原过程,分析氯代烃污染物的还原脱氯效率,不同氧化还原条件下,氢的利用效率存在显著差异,因此,氢浓度可以作为主导氧化还原过程的指示剂,氢浓度比ORP能更加有效地区分不同的还原条件[16];pH和温度对地下水微生物活性有显著影响,生物降解适宜的pH为6~8[6-7]。水文地球化学指标分析的另一个重要用途是根据上游电子受体的供给能力,利用质量平衡方法评估地下水生物降解作用可降解的污染物浓度(总量),评估生物降解作用的可持续性[17]。
1.3 微生物学方法
生物降解是将污染物无害化的自然衰减过程。地下水中存在可降解目标污染物的微生物是证实生物降解的一个重要指标。在实验室中已分离了大量可降解BTEX的微生物,主要有假单胞菌(Pseudomonas)、不动杆菌(Acinetobacter)、芽孢杆菌(Bacillus)、红球菌(Rhodococcus)、诺卡氏菌(Nocardia)、罗尔斯通氏菌(Ralstonia)和产碱杆菌(Alcaligenes)等[18-22]。氯代烃生物降解过程比BTEX复杂,是逐级脱氯的过程,微生物对氯代烃脱氯能力存在较大差异。现有研究表明,四氯乙烯(PCE)和三氯乙烯(TCE)转化为二氯乙烯(DCE)的过程较容易实现,有很多的微生物可以将PCE和TCE转换成DCE[23-27],但目前分离出的可将DCE降解为氯乙烯(VC)和乙烯的微生物只有Dehalococcoidesethenogenesstrain 195和strain BAV[28],Strain BAV是Dehalococcoides的一种,与Dehalococcoidesethenogenesstrain 195类似。研究表明,如果不存在Dehalococcoidesspecies,DCE降解为VC或乙烯的过程就不会发生,Dehalococcoidesspecies是目前报道的唯一可将PCE和TCE完全脱氯的微生物。其他微生物,如Dehalococcoidesspecies strain FL12可以从TCE和DCE的还原脱氯中获取能量,PCE和VC也支持该菌种生长,能进行缓慢脱氯,但是脱氯不完全。
鉴定地下水中存在可降解目标污染物的微生物是评价地下水生物降解能力的重要手段。Hendrickson 等[29]发现DehalococcoidesDNA的存在与完全脱氯降解为乙烯有很显著的关系,且高DehalococcoidesDNA含量与乙烯产生速率存在一致性[30-31],因此,监测DehalococcoidesDNA可以用于评估场地条件下氯代烯烃的还原脱氯作用[32-33]。微生物研究主要包括细菌种属的鉴定和微生物群落结构的分析,常用的分析手段有磷脂脂肪酸(phospholipid fatty acids, PLEA)法、变性梯度凝胶电泳(denaturing gradient gel electrophoresis, DGGE)、16S rRNA、聚合酶链式反应(polymerase chain reaction, PCR)等[31,34-35]。实际场地地下水自然衰减评价结果表明,绝大部分场地微生物并不是自然衰减能力的限制因素,所以在相关的自然衰减能力评价指南中微生物手段只是辅助性的手段[7-8],只有当污染物浓度和水文地球化学指标分析结果存在较大的不确定性时,才需用微生物学方法进一步证实。微生物学方法的主要局限是只能检测已成功分离出来的可降解目标污染物的微生物菌种,没有检测到可降解目标污染物的微生物,并不能排除污染物被其他微生物降解,因为这些微生物的降解能力在实验室没有被证实,菌种没有被成功分离,所以检测不到[36]。
1.4 微宇宙实验(microcosm)
微宇宙实验利用场地获取的土壤和地下水,通过实验模拟研究污染物的自然衰减过程。微宇宙实验可以通过质量平衡定量估算生物降解的贡献率[37],如果设计合理,维护得当,微宇宙实验能够为评估场地条件下的自然修复提供非常有力的证据。微宇宙实验结果受实验材料的性质、微宇宙的物理性质、采样策略和实验运行周期等影响很大,由于场地条件的空间异质性,污染羽不同位置的自然衰减过程可能存在很大的差异。微宇宙实验材料需要能代表污染羽最主要的地球化学条件,如果污染区范围很大,水文地球化学条件空间变异很大,每种地球化学条件至少做一个微宇宙实验[7,33,38]。
由于微宇宙实验的条件与场地实际条件存在较大的差异,所以应用微宇宙实验主要是证实生物降解对污染物自然衰减的贡献。通常情况下,不能利用微宇宙实验估算场地条件下生物降解的速率。由于微宇宙实验持续的时间通常为几周或几个月,可能检测不出微生物降解的细微变化,而这些变化在场地条件下具有显著的环境意义。很多地下水污染羽实际的生物降解速率低于微宇宙实验的检测限[7]。只有当其他方式无法获取生物降解速率时,才用微宇宙实验方法,如地下水流向或水位在短时间内波动较大,不能通过比较检测井污染物浓度变化来估算生物降解速率[7]。
大多数微宇宙实验是静止的,无法模拟地下水的迁移过程,与实际场地的生物降解过程存在较大的差异,如果要模拟地下水迁移过程中的自然衰减,就需要采用连续水流土柱模拟。连续水流土柱模拟实验可以观测在平均地下水滞留时间下,不同还原过程的矿化速率[7]。土柱模拟实验只模拟了小尺度的异质性,然而实际场地条件通常空间异质性较大,将一维均质模拟实验结果应用到三维异质的场地条件下存在很多困难。因此,基于室内模拟手段预测场地条件下的自然衰减过程时,要充分考虑模拟条件与实际场地的差异。
1.5 稳定同位素分析(stable isotope fractionation)
稳定同位素分析方法是利用有机污染物在生物降解过程中会发生同位素分馏现象来评价生物降解的过程[39]。碳、氢、氮、氧和硫等是有机物的主要元素,氯是氯代烃类的主要组成物质,这些元素均存在至少两个能够被质谱仪检测到的同位素。稳定同位素的物理和化学性质一致,但是由于重同位素与轻同位素在零位能上的差别,其量子机械效应存在微小差异,导致有机物在地下水含水层迁移转化过程中存在同位素分馏现象。随着高分辨率色谱-同位素比值质谱(GC-IRMS)技术的不断发展,单体化合物稳定同位素分析(compound specific isotope analysis, CSIA)方法日趋成熟,CSIA技术广泛应用于有机物生物降解过程研究和自然衰减评价。Sherwood等[40]利用δ13C值证实了丹佛空军基地主要泄漏污染物PCE和TCE在场地条件下发生了生物降解。Griebler等[41]利用CSIA技术和产物分析法评估了旧煤气厂污染含水层本能生物修复潜力,结果表明13C12C分馏数据为BTEX的原位生物降解提供了确定性证据。Fischer等[42]利用CSIA技术评估苯在污染含水层的生物降解能力,基于多层次采样,碳和氢同位素比例被用于确定苯生物降解发生的条件(氧化或厌氧)。Richnow等[43]利用碳同位素(13C12C)组成评价了垃圾渗漏液污染羽厌氧区域芳香烃的生物降解能力,同位素分馏证据表明乙苯和二甲苯在厌氧污染羽区域发生了生物降解。Nijenhuis等[44]的研究表明,在地下水的流向上,随着生物降解的进行,初始污染物的重同位素比例升高,最终产物的重同位素比例降低,整个过程同位素比例保持质量平衡(图2)。地下水污染羽中初始污染物和过程产物在地下水流向上浓度逐渐降低〔图2(a)和图2(b)〕,最终产物的浓度逐渐升高〔图2(c)和图2(d)〕。利用地下水中污染物及降解过程产物的同位素组成情况可以指示污染物的生物降解过程[45-46]。同位素分析技术是可定量评估有机物生物降解能力的方法,当清楚污染物的生物降解途径如BTEX和氯代烃,就可以利用同位素技术定量评估原位生物降解潜力[39]。

注:(a)为初始污染物三氯乙烯;(b)和(c)分别为三氯乙烯生物降解的过程产物二氯乙烯和氯乙烯;(d)为三氯乙烯降解的最终产物乙烯。
地下水污染物生物降解途径研究中应用较多的为C和H的同位素。有机污染物微生物降解作用下的同位素分馏受代谢途径、辅酶作用、降解类型与降解程度及有机物性质等因素的综合影响,分馏特征比较复杂[46-48],因此,应用单一的同位素组成特征评价微生物降解存在较大的局限。应用多元素稳定同位素技术(如CHCl稳定同位素分馏评价氯代烃类微生物降解过程)评价地下水挥发性有机污染物的微生物降解能力是重要的发展方向[49]。
1.6 生物降解作用对污染物自然衰减的贡献
生物降解是自然衰减修复最重要的过程,证实生物降解的贡献是评价污染物自然衰减的核心。污染羽处于稳定或缩减状态并不一定是生物降解的结果,在某些情况下,非生物过程如弥散、吸附和挥发等过程也足以使溶解污染羽处于稳定甚至收缩状态。污染物浓度,地球化学指标和微生物学方法分析的结果只能说明地下水条件适宜生物降解过程的发生,并不能确定发生了生物降解过程。降解产物检出是证明生物降解发生最直接的证据,但当地下水污染源成分复杂,难以确定降解产物时,就需要采用稳定示踪剂来评估生物降解的贡献[50]。如氯代烃污染场地,当污染源有TCE和DCE复合污染时,DCE是TCE的降解过程产物,但是由于污染源含有DCE,检出DCE不能证明TCE发生了生物降解。稳定示踪剂是与目标污染物的理化性质类似,但已确定不能被生物降解,在地下水迁移过程中,除生物降解过程外,其他过程如挥发、吸附和弥散对污染物行为类似[9,51],在相同的迁移路径上,污染物浓度与示踪剂浓度下降趋势的差异就是生物降解作用的贡献。可用于BTEX生物降解评价的稳定示踪剂有三甲苯和四甲苯等,氯代烃类生物降解的稳定示踪剂有氯化物等。
2 自然衰减能力评价方法应用情况及发展趋势
2.1 污染物浓度分析和水文地球化学指标法应用较广泛
为了分析自然衰减能力评价方法的实际应用情况,笔者调研了国外60个地下水污染场地自然衰减能力评价案例,分析了不同方法的应用情况(表1)。

表1 地下水挥发性有机污染物自然衰减评价方法比较
从表1可知,应用污染物浓度分析方法的最多,有44个场地;应用水文地球化学指标和稳定同位素分析方法的也较多;应用微宇宙实验和微生物学方法的较少。污染物浓度分析是评价地下水溶解污染羽状态(扩大、稳定和缩小)最直接的证据,地下水中目标污染物降解产物的检出可以直接说明发生了微生物降解作用[52]。水文地球化学条件根据污染羽不同位置电子受体浓度及降解产物的变化分析地下水中污染物生物降解的主导过程,同时,根据上游电子受体的浓度可以预测地下水条件对污染物的净化能力,进而评估生物降解的可持续性。由于微生物在大部分场地并不是一个限制因素,因此对条件相对简单的污染场地(地下水流向明确,水环境时空变异较小,污染初始的污染物及降解途径清楚等),污染物浓度分析和水文地球化学指标方法足以证实地下水污染羽的自然衰减能力。对条件复杂的污染场地(地下水流向复杂,水环境时空变异大,复合污染和多个污染源等),单一的评价方法就会存在很大的局限,需要辅助其他评价方法如微宇宙实验、微生物学方法等。
2.2 稳定同位素分析是最具潜力的评价方法之一
调查的案例中有28个场地使用了稳定同位素分析方法。但这些案例主要是研究地下水中污染物微生物降解的分馏特征,评估应用同位素分析方法评价自然衰减的可行性。相关研究表明,利用同位素分析方法不但能了解污染物在地下水的降解途径,同时能定量估算生物降解的速率。与其他方法相比,同位素分析方法的监测灵敏度更高,降解产物在较低浓度时,同位素分析方法能确定生物降解的发生;如果污染源是复合污染,地下水条件复杂,传统方法的评价效率会比较低,而同位素分析方法可以弥补传统方法的不足,提高自然衰减评价的准确性。污染物在不同微生物降解条件下,同位素分馏特征存在较大的不确定性,且环境条件对分馏特征也有显著的影响,因此,对降解过程比较复杂的污染物,目前直接应用稳定同位素分析还存在困难。随着相关研究的深入,稳定同位素分析将会是地下水污染物自然衰减评价最具潜力的方法之一。
2.3 多种手段综合应用已成为自然衰减能力评价的发展趋势
场地地下水自然修复能力评价受场地异质性的影响很大,目前大部分的评价指南都建议采用地下水主要流向上的监测数据评价污染物的自然衰减过程。但是在某些场地条件下,污染物生物降解只发生在污染羽边缘,因为在边缘区域可提供来自清洁区的电子受体[53]。场地条件的区域差异,导致不同区域的地下水环境存在显著差异,污染物在不同环境条件下的降解途径和程度都存在较大的差异,也增加了自然衰减评价的难度。场地条件在空间上存在显著的异质性,在时间上也存在明显的差异。相关研究表明,微生物活动随时间变化存在波动,可能导致不同时间段生物降解作用显著变化[36,54]。自然衰减能力评价只能反映取样分析周期内污染物的生物降解速率,基于某个特定时间范围内的评价结果,预测污染羽的长期行为会存在较大的不确定性。场地条件的复杂性导致任何一种方法都不可能解决所有场地自然衰减的评价问题,为了提供更加可靠的评价结果,在有条件的前提下,尽可能综合运用多种手段评估地下水挥发性有机污染物的自然衰减能力[50,55-56],如Nijenhuis等[44]利用稳定同位素分析、微宇宙实验和分子生物标记方法评价氯代烯烃在厌氧含水层的自然衰减能力。
3 结语
总的来看,地下水挥发性有机污染物自然衰减能力评价以污染物浓度分析和水文地球化学指标为主。污染物浓度分析确定地下水污染羽所处的状态和污染水平;水文地球化学指标用于确定污染物可能的降解途径,上下游水文地球化学指标的差异可预测生物降解的能力和可持续性。条件简单的地下水污染场地,污染物浓度分析和水文地球化学指标方法足以证实地下水污染羽的自然衰减能力,而复杂场地就需要辅助其他方法来提高评价结果的可靠性。在实际应用中,综合运用多种评价方法,可以更加充分地理解场地污染物的自然衰减过程,降低评价结果的不确定性。
稳定同位素分析的核心是有机污染物自然衰减过程的同位素分馏特征,分馏特征受污染物性质、场地条件和微生物种类等因素的影响较大,为了提高稳定同位素分析的评价效率,目前的研究主要从污染物自然衰减过程中稳定同位素分馏规律和同位素方法学两个方面进行。污染物生物降解的同位素分馏规律主要是通过室内模拟不同的环境条件,研究污染物的生物降解途径及同位素分馏特征;同位素方法研究主要是从单稳定同位素方法向多稳定同位素方法发展,如应用C和H同位素评价BTEX的生物降解,C和Cl同位素评价氯代烃的生物降解过程等。目前,稳定同位素分析已成为国际自然衰减能力评价研究的热点。
[1]环境保护部.全国地下水污染防治规划(2011—2020年)[R].北京:环境保护部,2011.
[2]RAO P S C,ANNABLE M D,KIM H.NAPL source zone characterization and remediation technology performance assessment:recent developments and applications of tracer techniques[J].J Contaminant Hydrology,2000,45(12):63-78.
[3]SOGA K,PAGE J W E,ILLANGASEKARE T H.A review of NAPL source zone remediation efficiency and the mass flux approach[J].J Hazard Materi,2004,110(123):13-27.
[4]LANGWALDT J H,PUHAKKA J A.On-site biological remediation of contaminated groundwater:a review[J].Environ Pollut,2000,107(2):187-197.
[5]US EPA.Superfund remedy report:13th edition(EPA 542-R-07-012)[R].Washington DC:US Environmental Protection Agency,2010.
[6]SUAREZ M P,RIFAI H S.Biodegradation rates for fuel hydrocarbons and chlorinated solvents in groundwater[J].Bioremediation Journal,1999,3(4):337-362.
[7]US EPA.Technical protocol for evaluating natural attenuation of chlorinated solvents in ground water(EPA600R-98128)[R].Washington DC:US EPA,1998.
[8]ASTM.Standard guide for remediation of ground water by natural attenuation at petroleum release sites(E1943-98:reapproved 2010)[R].Philly:American Society for Testing and Materials,2010.
[9]WIEDEMEIER T H.Technical protocol for implementing intrinsic remediation with long-term monitoring for natural attenuation of fuel contamination dissolved in groundwater[R].Denver:Colorado Parsons Engineering Science Inc,1995.
[10]CHEN K F,KAO C M,WANG J Y,et al.Natural attenuation of MTBE at two petroleum-hydrocarbon spill sites[J].J Hazard Materi,2005,125(123):10-16.
[11]RICHMOND S A,LINDSTROM J E,BRADDOCK J F.Assessment of natural attenuation of chlorinated aliphatics and BTEX in subarctic groundwater[J].Environ Sci Technol,2001,35(20):4038-4045.
[12]SKUBAL K L,BARCELONA M J,ADRIAENS P.An assessment of natural biotransformation of petroleum hydrocarbons and chlorinated solvents at an aquifer plume transect[J].J Contaminant Hydrology,2001,49(12):151-169.
[13]GELMAN F,BINSTOCK R.Natural attenuation of MTBE and BTEX compounds in a petroleum contaminated shallow coastal aquifer[J].Environmental Chemistry Letters,2008,6(4):259-262.
[14]MARK D.Field investigation into the biodegradation of TCE and BTEX at a former metal plating works[J].Engineering Geology,2003,70(34):321-329.
[15]COZZARELLI I M,BEKINS B A,BAEDECKER M J,et al.Progression of natural attenuation processes at a crude-oil spill site:1.Geochemical evolution of the plume[J].J Contaminant Hydrology,2001,53(34):369-385.
[16]CHAPELLE F H,HAACK S K,ADRIAENS P,et al.Comparison of Eh and H2measurements for delineating redox processes in a contaminated aquifer[J].Environ Sci Technol,1996,30(12):3565-3569.
[17]NEWELL C J,AZIZ C E.Long-term sustainability of reductive dechlorination reactions at chlorinated solvents sites[J].Biodegradation,2004,15(6):387-394.
[18]ALISON M C.The use of nucleic acid based stable isotope probing to identify the microorganisms responsible for anaerobic benzene and toluene biodegradation[J].J Microbiological Methods,2011,85(2):83-91.
[19]STAPLETON R D,BRIGHT N G,SAYLER G S.Catabolic and genetic diversity of degradative bacteria from fuel-hydrocarbon contaminated aquifers[J].Microbiol Ecol,2000,39(3):211-221.
[20]KIM D,KIM Y-S,KIM S-K,et al.Monocyclic aromatic hydrocarbon degradation byrhodococcussp.strain DK17[J].Applied Environ Microbiol,2002,68(7):3270-3278.
[21]王琳,邵宗泽.4株苯系物降解菌菌株的筛选鉴定、降解特性及其降解基因研究[J].微生物学报,2006,46(5):753-757.
[22]BERLENDIS S,LASCOURREGES J F,SCHRAAUWERS B,et al.Anaerobic biodegradation of BTEX by original bacterial communities from an underground gas storage aquifer[J].Environ Sci Technol,2010,44(9):3621-3628.
[23]GERRITSE J,RENARD V,GOMES T M P,et al.Desulfitobacteriumsp.strain PCE1:an anaerobic bacterium that can grow by reductive dechlorination of tetrachloroethene or ortho-chlorinated phenols[J].Archives of Microbiology,1996,165(2):132-140.
[26]ADRIAN L,SZEWZYK U,WECKE J,et al.Bacterial dehalorespiration with chlorinated benzenes[J].Nature,2000,408(6812):580-583.
[27]NYER E K,PAYNE F,SUTHERSON S.Discussion of environment vs. bacteria or let′s play ‘name that bacteria’[J].Ground Water Monitoring Remediation,2003,23(2):32-44.
[28]HE J,RITALAHTI K M,YANG K-L,et al.Detoxification of vinyl chloride to ethene coupled to growth of an anaerobic bacterium[J].Nature,2003,424(6944):62-65.
[29]HENDRICKSON E R,PAYNE J A,YOUNG R M,et al.Molecular analysis ofDehalococcoides16s ribosomal DNA from chloroethene-contaminated sites throughout North America and Europe[J].Applied and Environmental Microbiology,2002,68(2):485-495.
[30]LENDVAY J M,LÖFFLER F E,DOLLHOPF M,et al.Bioreactive barriers:a comparison of bioaugmentation and biostimulation for chlorinated solvent remediation[J].Environ Sci Technol,2003,37(7):1422-1431.
[31]LU X,WILSON J T,KAMPBELL D H.Relationship betweenDehalococcoidesDNA in ground water and rates of reductive dechlorination at field scale[J].Water Res,2006,40(16):3131-3140.
[32]LU X,WILSON J T,KAMPBELL D H.Comparison of an assay forDehalococcoidesDNA and a microcosm study in predicting reductive dechlorination of chlorinated ethenes in the field[J].Environmental Pollution,2009,157(3):809-815.
[33]FENNELL D E,CARROLL A B,GOSSETT J M,et al.Assessment of indigenous reductive dechlorinating potential at a TCE-contaminated site using microcosms,polymerase chain reaction analysis and site data[J].Environ Sci Technol,2001,35(9):1830-1839.
[34]KAO C M,CHEN C S,TSA F Y,et al.Application of real-time PCR-DGGE fingerprinting,and culture-based method to evaluate the effectiveness of intrinsic bioremediation on the control of petroleum-hydrocarbon plume[J].J Hazard Materi,2010,178(123):409-416.
[35]STAPLETON R D,SAYLER G S.Assessment of the microbiological potential for the natural attenuation of petroleum hydrocarbons in a shallow aquifer system[J].Microbiol Ecol,1998,36(3):349-361.
[36]SMETS B F,SICILIANO S D,VERSTRAETE W.Natural attenuation:extant microbial activity forever and ever[J].Environ Microbiol,2002,4(6):315-317.
[37]BOTTON S,PARSON J R.Degradation of BTEX compounds under iron-reducing conditions in contaminated aquifer microcosms[J].Environmental Toxicology and Chemistry,2006,25(10):2630-2638.
[38]AULENTA F,BIANCHI A,MAJONE M,et al.Assessment of natural or enhanced in situ bioremediation at a chlorinated solvent-contaminated aquifer in Italy:a microcosm study[J].Environment International,2005,31(2):185-190.
[39]MECKENSTOCK R U,MORASCH B,GRIEBLER C,et al.Stable isotope fractionation analysis as a tool to monitor biodegradation in contaminated acquifers[J].J Contaminant Hydrology,2004,75(34):215-255.
[40]SHERWOOD L B,SLATER G F,SLEEP B,et al.Stable carbon isotope evidence for intrinsic bioremediation of tetrachloroethene and trichloroethene at area 6 dover air force base[J].Environ Sci Technol,2000,35(2):261-269.
[41]GRIEBLER C,SAFINOWSKI M,VIETH A,et al.Combined application of stable carbon isotope analysis and specific metabolites determination for assessing in situ degradation of aromatic hydrocarbons in a tar oil-contaminated aquifer[J].Environ Sci Technol,2004,38(2):617-631.
[42]FISCHER A,THEUERKORN K,STELZER N,et al.Applicability of stable isotope fractionation analysis for the characterization of benzene biodegradation in a BTEX-contaminated aquifer[J].Environ Sci Technol,2007,41(10):3689-3696.
[43]RICHNOW H H,ANNWEILER E,MICHAELIS W,et al.Microbial in situ degradation of aromatic hydrocarbons in a contaminated aquifer monitored by carbon isotope fractionation[J].J Contaminant Hydrology,2003,65(12):101-120.
[44]NIJENHUIS I,NIKOLAUSZ M,KOTH A,et al.Assessment of the natural attenuation of chlorinated ethenes in an anaerobic contaminated aquifer in the bitterfeldwolfen area using stable isotope techniques,microcosm studies and molecular biomarkers[J].Chemosphere,2007,67(2):300-311.
[45]HUNKELER D,ARAVENA R,BUTLER B J.Monitoring microbial dechlorination of tetrachloroethene(PCE) in groundwater using compound-specific stable carbon isotope ratios:microcosm and field studies[J].Environ Sci Technol,1999,33(16):2733-2738.
[46]NIJENHUIS I,ANDERT J,BECK K,et al.Stable isotope fractionation of tetrachloroethene during reductive dechlorination bySulfurospirillummultivoransandDesulfitobacteriumsp.strain PCEs and abiotic reactions with cyanocobalamin[J].Applied and Environmental Microbiology,2005,71(7):3413-3419.
[47]王万春.微生物降解有机物的碳氢同位素分馏研究进展[J].矿物岩石地球化学通报,2007,26(3):269-275.
[48]MORASCH B,RICHNOW H H,SCHINK B,et al.Stable hydrogen and carbon isotope fractionation during microbial toluene degradation:mechanistic and environmental aspects[J].Applied and Environmental Microbiology,2001,67(10):4842-4849.
[49]THULLNER M,CENTLER F,RICHNOW H-H,et al.Quantification of organic pollutant degradation in contaminated aquifers using compound specific stable isotope analysis:review of recent developments[J].Organic Geochemistry,2012,42(12):1440-1460.
[50]BOMBACH P,RICHNOW H H,KASTNER M,et al.Current approaches for the assessment of in situ biodegradation[J].Applied Microbiology and Biotechnology,2010,86(3):839-852.
[51]WIEDEMEIER T H,SWANSON M A,WILSON J T,et al.Approximation of biodegradation rate constants for monoaromatic hydrocarbons (BTEX) in ground water[J].Ground Water Monitoring Remediation,1996,16(3):186-194.
[52]MARTIENSSEN M,FABRITIUS H,KUKLA S,et al.Determination of naturally occurring MTBE biodegradation by analysing metabolites and biodegradation by-products[J].J Contaminant Hydrology,2006,87(12):37-53.
[53]WILSON R D,THORNTON S F,MACKAY D M.Challenges in monitoring the natural attenuation of spatially variable plumes[J].Biodegradation,2004,15(6):359-369.
[54]BEKINS B A,COZZARELLI I M,GODSY E M,et al.Progression of natural attenuation processes at a crude oil spill site:Ⅱ.Controls on spatial distribution of microbial populations[J].J Contaminant Hydrology,2001,53(34):387-406.
[55]STELZER N,IMFELD G,THULLNER M,et al.Integrative approach to delineate natural attenuation of chlorinated benzenes in anoxic aquifers[J].Environ Pollut,2009,157(6):1800-1806.
[56]IMFELD G,NIJENHUIS I,NIKOLAUSZ M,et al.Assessment of in situ degradation of chlorinated ethenes and bacterial community structure in a complex contaminated groundwater system[J].Water Res,2008,42(45):871-882. ○
AssessmentMethodsofVolatileOrganicContaminantsNaturalAttenuationinContaminatedAquifers
XIE Yun-feng1, CAO Yun-zhe1, LIU Xiao-juan1, KONG Xiang-bin1,2, LI Fa-sheng1
1.State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China 2.College of Resources and Environment Science, Agricultural University of Hebei, Baoding 071000, China
Volatile organic contaminants (VOCs) are among the most frequently detected pollutants in groundwater of industrial contaminated site in China. VOCs are commonly found entrapped as non-aqueous phase liquids (NAPL) in the soil pores of subsurface and become persistent sources of groundwater pollution with higher risk of environment and health. Monitoring natural attenuation (MNA) technology has gained more and more attention in recent years due to its low cost, small disturbance and no secondary pollution. The current frequently applied approaches to assess the ability of natural attenuation of aquifer contaminants were summarized both abroad and at home. The case studies of natural attenuation assessment for 60 sites showed that trend analysis of contaminant concentration and hydro-geochemical indicator methods were the most frequently applied methods. For a simple contaminated site, the in situ biodegradation process could be accurately and reliably assessed by the above two methods. For a complex contaminated site, the integration of different technologies, such as microcosm, microbiological analysis and stable isotope analysis, was recommended for a more robust and reliable characterization of in situ degradation process. In recent years, Stable Isotope Analysis method had gained increasing attention for assessing natural attenuation of organic contaminants in aquifers due to its potential to indicate contaminants degradation pathway and to quantify the rate of natural attenuation.
groundwater contaminant plume; BTEX; chlorinated aliphatic hydrocarbons (CAHs); biodegradation; microcosm; stable isotope analysis (SIA); microbiological analysis
1674-991X(2013)02-0104-09
2012-07-04
国家环境保护公益性行业科研专项(201109017)
谢云峰(1981—),男,博士后,主要从事污染场地风险评价研究,xieyf@craes.org.cn
*责任作者:李发生(1966—),男,研究员,博士生导师,主要从事污染场地调查评价与修复研究,lifs@craes.org.cn
X523
A
10.3969j.issn.1674-991X.2013.02.018

