益气化浊胶囊对KKAy小鼠骨骼肌组织中胰岛素受体底物表达的影响
郭俊杰,张素超,赵玉立
(山西省中医药研究院,山西太原 030012)
胰岛素抵抗(Insulin resistance)是2型糖尿病的病理生理基础,贯穿2型糖尿病发展始终,在胰岛素信号通路的各个环节均可发生。中医药在治疗糖尿病有较好效果,在改善症状和防治并发症上有一定的优势,但缺乏对胰岛素抵抗作用机理方面的深入研究。本实验观察益气化浊胶囊对胰岛素抵抗KKAy小鼠骨骼肌组织内胰岛素受体底物IRS-1、IRS-2蛋白表达量的影响,进一步从蛋白水平探讨其对糖尿病胰岛素抵抗的作用机理。
1 材料与方法
1.1 药物与试剂 益气化浊胶囊由黄芪、黄精、女贞子、苍术、蚕茧、丹参、鬼箭羽组成,山西省中医院制剂室生产,其中1/2量黄芪以药材原药入药,兼作赋形剂,其余药味采用水煎煮提取工艺,制成胶囊,批号20 100318;盐酸吡咯列酮片由北京大洋药业有限公司生产,批号100301。碘 [125I]胰岛素放射免疫分析药盒购自北京普尔伟业生物科技有限公司,批号20100913。β-actin(Santa Cruz Biotechnology,1∶1000),兔抗 IRS-1一抗(Bioworld公司,1∶1000),兔抗 IRS-2一抗(cell Signling公司,1∶1000),辣根酶标记的抗IgG抗体(北京康为世纪生物技术有限公司)。
1.2 实验动物与分组 C57BL/6J小鼠与KKAy小鼠,8~10周龄,雌性,体质量25~28 g,购自中国医学科学院实验动物中心,许可证号SCXK(京)2009-2004。C57BL/6J小鼠8只给予普通饲料,KKAy小鼠予高脂饲料(10%脂肪,10% 蔗糖,基础饲料),购自中国医学科学院实验动物中心。适应性喂养一周后,用微量血糖仪(美国强生公司稳豪®倍优型)连续两次测KKAy小鼠血糖,以随机血糖≥11.1 mmol/L诊断为糖尿病。将符合条件的KKAy小鼠随机分为4组:模型对照组、阳性对照组(盐酸吡格列酮)、益气化浊胶囊高剂量组、低剂量组,每组8只。益气化浊胶囊高剂量组予益气化浊胶囊2 g/(kg·d),临床用量的20倍;低剂量组予益气化浊胶囊1 g/(kg·d),临床用量的10倍;阳性对照组予盐酸吡咯列酮2.5 mg/(kg·d),临床用量的10倍,正常对照组、模型对照组,以20 mL/(kg·d)给予等容积生理盐水,灌胃给药,一日1次,连续8周。灌胃前将益气化浊胶囊用蒸馏水配置成质量浓度为0.1 g/mL、0.05 g/mL两种溶液,将盐酸吡格列酮研成细粉后用蒸馏水配置成质量浓度为0.13 mg/mL的溶液。(给药量以60 kg/d的人用量计算。)
1.3 检测指标
1.3.1 空腹血糖、血清胰岛素及胰岛素抵抗指数检测 实验动物禁食12 h后,采用微量血糖仪尾静脉采血直接测空腹血糖,摘除眼球采血用放射免疫分析法测定空腹血清胰岛素,计算稳态胰岛素抵抗指数(HOMA-IR),其计算公式为=空腹血糖胰岛素×空腹血糖/22.5[1]。
1.3.2 Western-blot检测骨骼肌中IRS-1、IRS-2蛋白的表达 取100 mg骨骼肌组织,加入0.5 mL蛋白裂解液,超声匀浆,离心,取上清,加入等体积的2×SDS buffer离心,收集上清,制备10%的分离胶及5%的浓缩胶,取存骨骼肌组织蛋白上清20μL,电泳约3 h,将蛋白转移到硝酸纤维素膜上,然后用去离子水冲洗,5%BSA溶液4℃封闭过夜,硝酸纤维素膜放入含有0.1%TBST冲洗2次,先后与一抗抗体、过氧化物酶标志的二抗及显色底物孵育。用ECL底物化学发光显色,显影,定影,扫描。用photoshop软件,计算亮度值,IRS-1、IRS-2蛋白表达水平以IRS-1/β-actin、IRS-2/β-actin 的比值表示。
1.4 统计学分析 实验数据经SPSS 17.0统计软件进行分析,以均数±标准差()表示,多组间比较采用方差分析,组间两两比较采用LSD-t法,P<0.05表示差异有显著性。
2 结果
2.1 益气化浊胶囊对KKAy小鼠血糖和胰岛素水平的影响与正常对照组比较,模型对照组动物空腹血糖(FPG)、空腹血糖胰岛素(FINS)、HOMA-IR显著升高(P<0.01);与模型对照组相比,阳性对照组、高剂量组FPG、FINS、HOMA-IR均显著降低(P<0.01或 P<0.05),低剂量组FPG降低(P<0.05)(表1)。
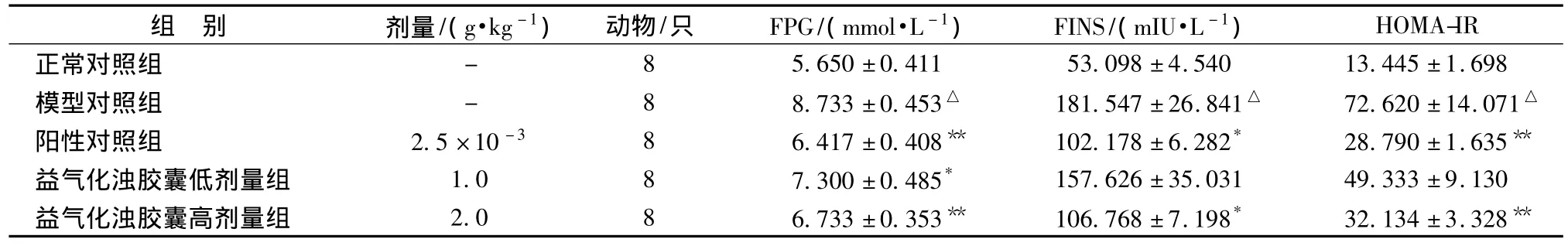
表1 各组小鼠FPG、FINS、HOMA-IR水平比较
2.2 骨骼肌IRS-1蛋白的表达与正常对照组比较,模型对照组骨骼肌组织IRS-1蛋白表达量均显著降低(P<0.01);与模型组比较,阳性对照组IRS-1蛋白水平显著升高(P<0.01),益气化浊胶囊高、低剂量组IRS-1蛋白水平均升高(P<0.05)。(表2,图1)
2.3 骨骼肌IRS-2蛋白的表达与正常对照组比较,模型对照组骨骼肌组织IRS-2蛋白表达量均显著降低(P<0.01);与模型组比较,阳性对照组IRS-2蛋白水平升高(P<0.05),益气化浊胶囊高、低剂量组IRS-2蛋白水平均升高,但无统计意义。(表2,图1)
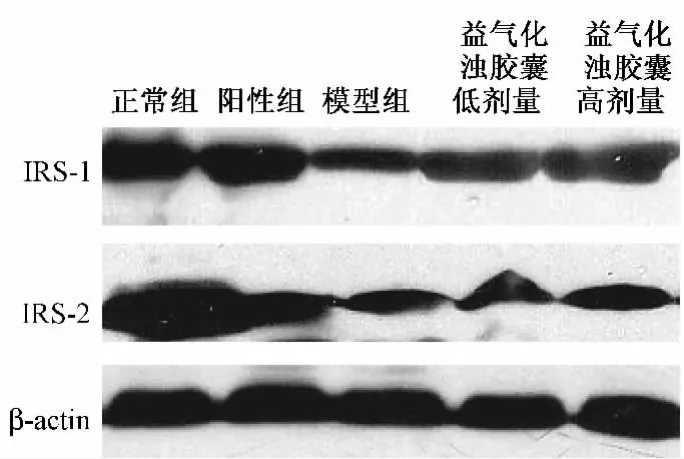
图1 IRS-1、IRS-2在骨骼肌组织中的表达

表2 骨骼肌组织中IRS-1、IRS-2蛋白表达水平
3 讨论
2008年中华医学会糖尿病学会组织的糖尿病流行病学调查结果显示,在20岁以上的人群中,年龄标化的糖尿病患病率为9.7%,而糖尿病前期的比例更高达15.15%,成为世界糖尿病患病率增长最快国家之一[2]。研究表明[3],92%的2型糖尿病患者存在胰岛素抵抗,甚至在诊断2型糖尿病前15~20年已经存在胰岛素抵抗。一项针对5728例受试者口服葡萄糖耐量试验结果分析显示,中国人群空腹血糖受损、葡萄糖耐量异常与胰岛素抵抗与胰岛素分泌功能的下降均有关[4],不同糖耐量人群胰岛素抵抗具有空腹血糖越高基础胰岛素抵抗越严重[5]。因此,改善胰岛素抵抗已成为2型糖尿病临床治疗的首要问题。
本研究选用与人类的Ⅰ型糖尿病表现极为相似的KKAy小鼠模型作为研究对象,KKAy小鼠是在遗传易感的的基础上加环境因素而诱发,是一种理想的人类2型糖尿病动物模型[6]。正常对照组选择与 KKAy小鼠具有基因同源性C57BL/6J小鼠[7]。实验结果提示胰岛素抵抗模型成立。
现代研究认为[8]PI3K/AKT途径是胰岛素信号传导的经典途径,IRS作为胰岛素性信号转导通路中的重要信号蛋白,既是胰岛素受体酪氨酸激酶的底物,也是胰岛素多种生物调节作用的中间体,在胰岛素抵抗中起重要的作用[9]。IRS-1是最先发现的胰岛素受体底物,其分布广泛,主要在骨骼肌组织表达,骨骼肌是胰岛素介导的葡萄糖摄取的关键靶器官之一,在餐后胰岛素介导的80%的葡萄糖摄取有骨骼肌完成[10]。IRS-2与IRS-1相对分子质量相似,分布广泛,但主要在肝脏和胰腺 β 细胞中表达[11]。Rui等[12]报道,延长胰岛素的刺激作用能使IRS-1和IRS-2水平明显下降。王冰等[13]报道胰岛素抵抗大鼠肌肉组织中IRS-1 mRNA仅为正常组的47.9%。正常情况下,IRS-1在胰岛素信号传导中起主要作用,而当IRS-1受抑制时,IRS-2会成为胰岛素受体的主要底物,但IRS-2需要更高浓度的胰岛素才能产生作用[14]。当IRS-2表达减少时,会导致胰岛素作用的减弱,减弱到一定程度时,胰岛素信号的细胞内传导即受到阻滞[15]。
临床使用改善胰岛素抵抗的药物以噻唑烷二酮类为主,但此药物对肝肾功能异常则禁用并存在水肿、心血管疾病的副作用。本实验以吡格列酮为阳性对照药,降糖机制是增加靶细胞对胰岛素作用的敏感性。有实验证明[16]吡格列酮的胰岛素增敏作用可能与IRS-1、IRS-2蛋白的表达的增强有关。
2型糖尿病胰岛素抵抗患者辨证多为气阴两虚,瘀浊互阻。中药复方益气化浊胶囊由黄芪、女贞子、苍术、丹参、鬼箭羽、黄精、蚕茧组成,诸药合用标本兼治,补泻兼施,共奏益气养阴补脏、祛瘀化浊通络之功。本研究结果中,益气化浊胶囊明显降低KKAy小鼠FPG,降低HOMA–IR,改善胰岛素抵抗;模型组骨骼肌组织中IRS-1、IRS-2蛋白表达水平显著低于正常对照组,提示骨骼肌中IRS-1、IRS-2蛋白表达的减少可能是2型糖尿病胰岛素抵抗的发病机制之一;阳性对照组骨骼肌组织中IRS-1、IRS-2蛋白表达水平显著高于模型对照组,证实吡格列酮降血糖,改善胰岛素抵抗,与增加骨骼肌中IRS-1、IRS-2蛋白表达有关;益气化浊胶囊能增高IRS-1蛋白表达,与阳性对照组比较,IRS-2蛋白表达升高不明显。
从实验中推测出:益气化浊胶囊作用机制可能与吡格列酮相似,通过上调骨骼肌中IRS-1蛋白表达,修复胰岛素信号传导通路,降低自发性2型糖尿病KKAy小鼠FPG、改善胰岛素抵抗,IRS-2在骨骼肌发挥作用可能需要一定的条件,有待进一步实验研究。
[1]Hafner S M,Kennedy E,Gonzalez C,et al.A prospective analysis of the HOMA model,The Mexico City diabetes study[J].Diabetes Care,1996,19(10):1138-1141.
[2]Yang W Y,Lu J M,Weng J P,et al.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(12):1090-1101.
[3]Defrenzo R A.The triumvirate,beta-cell,muscle,liver,A conclusion responsible for NIDDM [J]. Diabetes,1998,37:667.
[4]Bi Y,Zeng L,Zhu D,et al.Association of β-cell function and insulin sensitivity with fasting and 2-h plasma glucose in a large Chinese population[J].Diabetes Obes Metab,2012,14(2):174-180.
[5]杨 明,张 敏,周广朋,等.不同糖耐量人群胰岛素抵抗和胰岛β细胞功能的比较研究[J].实用医院临床杂志,2012,9(3):47-50.
[6]Watson R T,Khan A H,Furukawa M,et al.Entry of newly synthesized GLUT4 into the insulin-responsive storage compartment is GGA dependent[J].EMBO,2004,23(10):2059-2070.
[7]Khan A H,Capilla E,Hou J C,et al.Entry of newly synthesized GLUT4 into the insulin responsive storage compartment is dependent upon both the amino terminus and the large cytoplasmic loop[J].J Biol Chem,2004,279(36):37505-37511.
[8]Zorzano A,Palacin M,Guma A,Mechanisms regulating GLUT4 glucose transporter expression and glucose transport in skeletal musule[J].Acta Physiologica Scan Dinavica,2005,183(1):43.
[9]Pessin J E,Saleiel A R,Signaling pathways in insulin action:molecular targets of insulin resistance[J].J Clin Invest,2000,106(2):165-169.
[10]白震民,王安利,李胜志.运动对胰岛素抵抗模型大鼠骨骼肌GLUT4和PKBβ mRNA表达的影响[J].北京体育大学学报,2010,33(6):44-46.
[11]Seti G,Federici M,Hribal M L,et al.Defects of the insulin receptor substrste(IRS)system in human metabolic disorders[J].Faseb J,2001,15(1):2099-2111.
[12]Rui L,Fisher T L,Thomas J,et al.Regulation of insulin/insulin-like growth factor-1 signaling by protea-some-mediated degradation of insulin receptor substrate-2[J].J Biol Chem,2001,276(43):40362-40367.
[13]王 冰,李洪亮,杨文英,等.N-乙酰半胱氨酸改善高脂饲养大鼠外周胰岛素抵抗的机制[J].中国糖尿病杂志,2010,18(4):255.
[14]周云枫.黄芪多糖对2型糖尿病大鼠肾组织胰岛素信号转导的影响[J].武汉大学学报,2005,26(2):139-143.
[15]Withers D J,White M.Perspective:The insulin signaling system—a common link in the pathogenesis of type 2 diabetes[J].Endocrinology,2000,141(6):1917-1921.
[16]陈 秋,朱玉霞,苏言辉,等.吡格列酮对胰岛素抵抗HepG2细胞胰岛素受体底物表达的影响[J].山东中药,2009,49(17):4-6.

