双黄连注射液中半抗原成分酶联免疫检测方法的建立
尹 婕,尹利辉,胡昌勤,金少鸿
(中国食品药品检定研究院,北京 100050)
双黄连注射液是由金银花、黄芩、连翘经提取精制而成的复方制剂,具有清热解毒、疏风解表的功效。自1990年上市以来,广泛用于治疗病毒和细菌引起的感染[1]。1992年被国家中医药管理局指定为全国中医医院急诊首批必备中成药[2]。但随着临床的广泛应用,其不良反应报道也日益增多,其中75%系过敏反应[3]。特别是近几年来频繁出现的严重不良反应/事件,使双黄连注射液作为高风险中药注射剂品种备受关注。
现有研究指出双黄连注射液中致敏成分的存在是其引起过敏反应的主要原因之一[4-5]。但目前对于致敏物质的成分、性质仍不明确。文献报道双黄连注射液的过敏反应与其组分黄芩苷有直接关系[6]。有研究表明黄芩苷可作为一种小分子半抗原,刺激小鼠产生特异性抗体[7]。前期的实验也证实黄芩苷能够特异性地与黄芩提取物免疫获得的抗血清结合,即黄芩苷具有反应原性。但对于黄芩苷致敏作用的机制仍缺乏有力的实验依据。另一方面,黄芩苷具有显著的抗菌抗病毒作用,是黄芩的主要有效成分,在多种含黄芩药材的制剂分析中常被作为质控的指标。因此,有必要对黄芩苷的致敏性、作用机制及其致敏的限量进行深入研究,并建立灵敏、高效、稳定的黄芩苷微量检测方法。
目前常用于黄芩苷检测的方法皆为理化分析方法,以HPLC法最常用[8-10]。但由于某些致敏原能够诱发过敏反应往往取决于其特定的化学结构,即“化学决定簇”,并且致敏的浓度亦较低,这就要求对致敏原定性定量检测的方法要具备很高的特异性和灵敏度。以酶联免疫吸附法(ELISA)为代表的免疫分析技术具有特异性强、灵敏度高、操作简便,且特别适用于大批量样品检测等优点。要建立ELISA法,首先需要相应的抗体。因此本实验首先在体外制备了黄芩苷的完全抗原,免疫家兔获得针对黄芩苷的特异性抗体,旨在建立一种双黄连注射液中半抗原成分的ELISA定量检测方法,为进一步研究含有黄芩苷的中药注射剂中致敏性物质提供依据。
1 材料
1.1 试剂与仪器 黄芩苷(baicalin,BAL,中国食品药品检定研究院,批号110715-201016,纯度94.0%);黄芩素(baicalein,中国食品药品检定研究院,批号111595-200905,纯度98.5%);连翘苷(中国食品药品检定研究院,批号110821-201112,纯度96.8%);绿原酸(中国食品药品检定研究院,批号110753-200413,纯度100%);黄芩提取物(批号 200907231Y)。牛血清白蛋白(BSA)、N-羟基琥珀酰亚胺(NHS)、卵清蛋白(OVA)、酪蛋白(Sigma公司);山羊血清、马血清(北京元亨圣马生物技术研究所);脱脂奶粉、明胶、四甲基联苯胺(TMB)(Amresco公司);辣根过氧化酶标记的羊抗兔IgG(IgG/HRP-Ab,北京索莱宝科技有限公司)。
XS105电子天平(Mettler Toledo公司);Spectrum Two红外光谱仪(PerkinElmer公司);Modulyo冷冻干燥机、Multikan Spectrum酶标仪(Thermo公司);DH4000B电热恒温培养箱(天津市泰斯特仪器有限公司)。
1.2 实验动物 新西兰白兔,雄性,4~5月龄,体质量为2.0~3.0 kg,由北京市昌扬西山养殖场提供。许可证编号:SCXK(京)2011-0010。动物实验均按照国际动物实验的指导原则进行。
2 实验方法
2.1 黄芩苷完全抗原(BAL-BSA)的合成与体外鉴定 采用NHS活性酯法将BAL与载体蛋白BSA偶联制备完全抗原,偶联产物经冷冻干燥后于-20℃保存。分别采用红外吸收光谱法和MALDITOF-MS 对偶联物进行鉴定[11]。
2.2 黄芩苷完全抗原(BAL-BSA)的免疫原性鉴定及酶联免疫检测方法的建立
2.2.1 抗血清的制备 采用混合免疫法以完全抗原BAL-BSA为免疫原,免疫新西兰兔3只,免疫程序参照文献进行[11]。同时设置BAL单独免疫组,经相同的剂量和程序免疫。用间接ELISA法检测所分离的抗血清的效价。
2.2.2 抗血清效价的测定及间接ELISA法的建立以BAL为包被抗原,采用间接ELISA法测定抗血清的效价。以待测血清的OD450值大于或等于阴性对照OD450值的2.1倍,且两者之差大于0.2(即P/N≥2.1且P-N>0.2)时所对应的血清最大稀释倍数作为抗体效价。
2.2.2.1 间接ELISA法检测条件的优化 分别对包被缓冲液、封闭液以及酶标抗体的稀释度进行优化筛选。按照阳性与阴性血清OD450值之比(P/N值)最大,且阴性血清及空白对照的OD450值较低的原则确定条件。
将包被原BAL、待测血清和阴性血清分别倍比稀释,在96孔板上进行方阵滴定。选取阳性血清OD450值在1.0左右,阴性血清OD450值0.2左右,且空白对照OD450值小于0.1的反应孔所对应的抗原浓度和血清稀释度作为最适抗原包被浓度和血清稀释度。
2.2.2.2 间接ELISA法的特异性和灵敏度 采用两种方法考察间接ELISA法的特异性:a)将BAL进行倍比稀释,按照优化后的检测条件,检测免疫血清中抗体的水平;b)分别以金银花提取物、连翘提取物、刺五加提取物、丹参提取物作为包被原,按照优化后的条件检测。根据AOAC标准[12],以阴性均值)加3倍标准差(sd,n=20)的和)作为本方法的检测限,当待测样品的测定结果>+3sd时,判为阳性;<+2sd时,判为阴性。
将未经免疫的阴性血清和免疫后的阳性血清平行进行倍比稀释,按优化后的条件检测。以阳性血清与阴性血清OD450值之比(P/N)≥2.1的最大血清稀释度作为检测灵敏度。
2.2.3 间接竞争ELISA法检测抗血清的特异性及其交叉反应性 采用间接竞争ELISA法,分别以黄芩素、连翘苷、绿原酸和黄芩提取物为竞争性抗原,考察兔抗血清的特异性和交叉反应性。间接竞争ELISA法的操作要点为[13]:将效价最高的抗血清稀释为最佳工作浓度的两倍,以50μL/孔加至BAL包被的酶标板中。再分别加入等体积倍比稀释的竞争用抗原溶液,混合均匀。同时以50μL抗血清稀释液和等体积的样品稀释液作为标准,以100μL样品稀释液作为空白对照。37℃孵育1 h。其他步骤同非竞争ELISA法。
2.3 双黄连注射液中半抗原成分的检测 采用优化后的间接ELISA法对26批双黄连注射液中的致敏性半抗原成分进行检测。注射液包被前用10倍浓度的包被液调节pH9.6,同时包被阳性(包被BAL)和阴性对照(包被液)。根据AOAC标准判定,只有当阳性对照呈阳性,阴性对照呈阴性时实验才成立。
3 实验结果
3.1 黄芩苷完全抗原(BAL-BSA)的体外鉴定经红外吸收光谱分析证实BAL与BSA偶联成功;通过MALDI-TOF-MS估算出偶联产物中 BAL与BSA的偶联比约为3∶1,可用于免疫动物制备相应的抗血清[11]。
3.2 间接ELISA方法的建立
3.2.1 间接ELISA法各项实验条件的优化 考察的几种常用封闭液中,1%明胶溶液阴性值最低,封闭效果最佳(见图1);用碳酸盐缓冲液(CBS,0.05 mol/L,pH 9.6)稀释包被原BAL,包被效果优于磷酸盐缓冲液(PBS,0.01 mol/L,pH 7.2)(见图2);当酶标二抗稀释度为1∶10000时,P/N最大,且阴性血清及空白对照的OD值相对较低,因此二抗的最佳工作浓度确定为1∶10000(见图3)。
方阵滴定中固定酶标二抗的工作浓度为1∶10000,筛选包被抗原与抗血清的最佳工作浓度及稀释倍数,结果见表1。当包被原质量浓度为100μg/mL,抗血清稀释倍数为1∶500时,阳性孔的OD值为0.978,阴性孔OD值较低,P/N最大,且空白对照孔的OD值小于0.1。因此确定BAL的最适包被质量浓度为100μg/mL,抗血清的最适稀释倍数为1∶500。
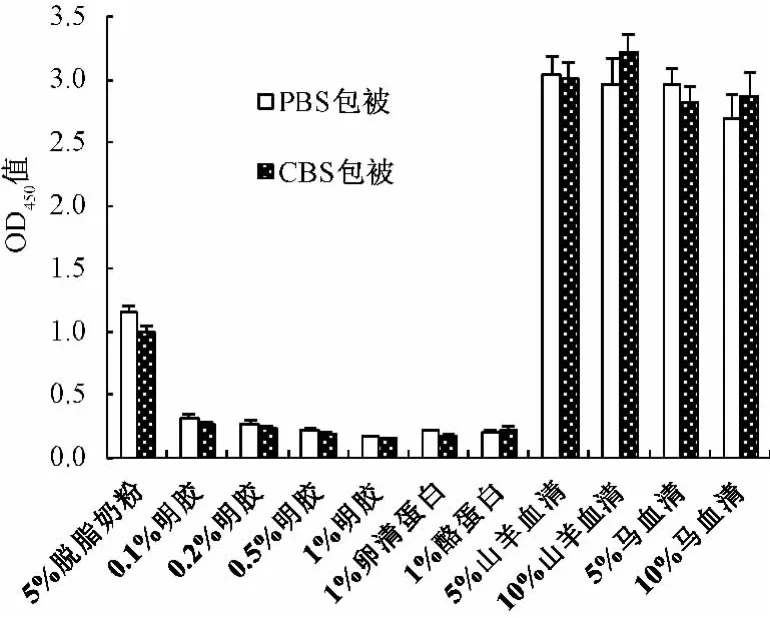
图1 封闭液的选择Fig.1 Optimization of the blocking solution
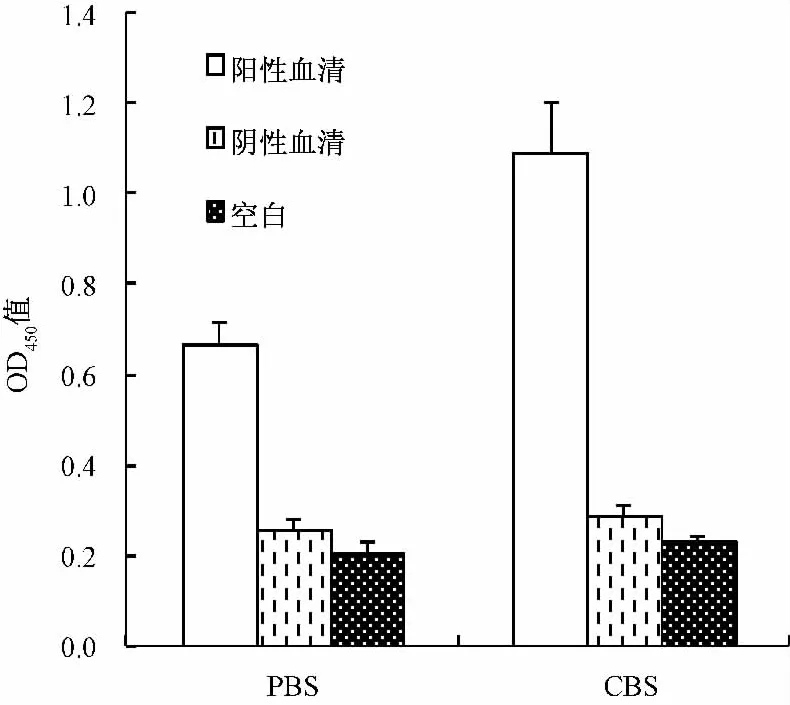
图2 包被缓冲液的选择Fig.2 Optimization of the coating solution
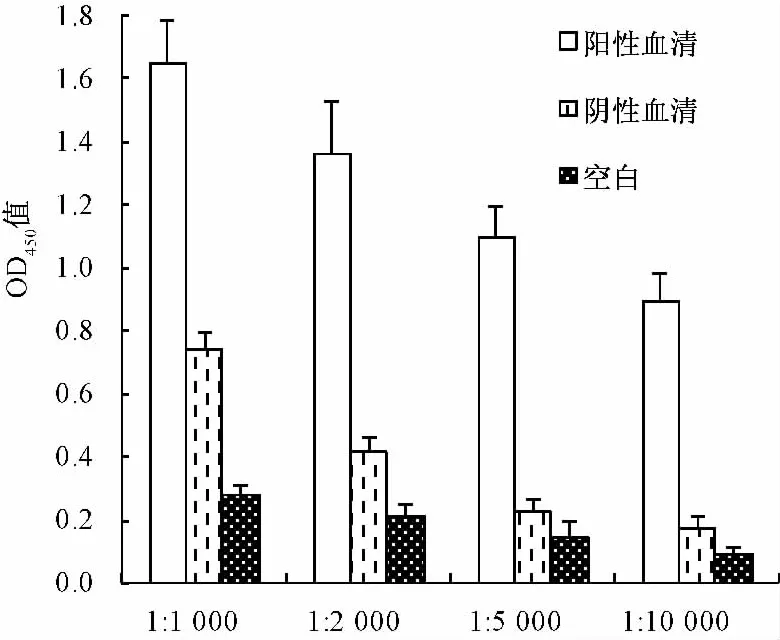
图3 酶标二抗工作浓度的选择Fig.3 Determination of the optimal dilution of goat anti rabbit IgG/HRP-Ab
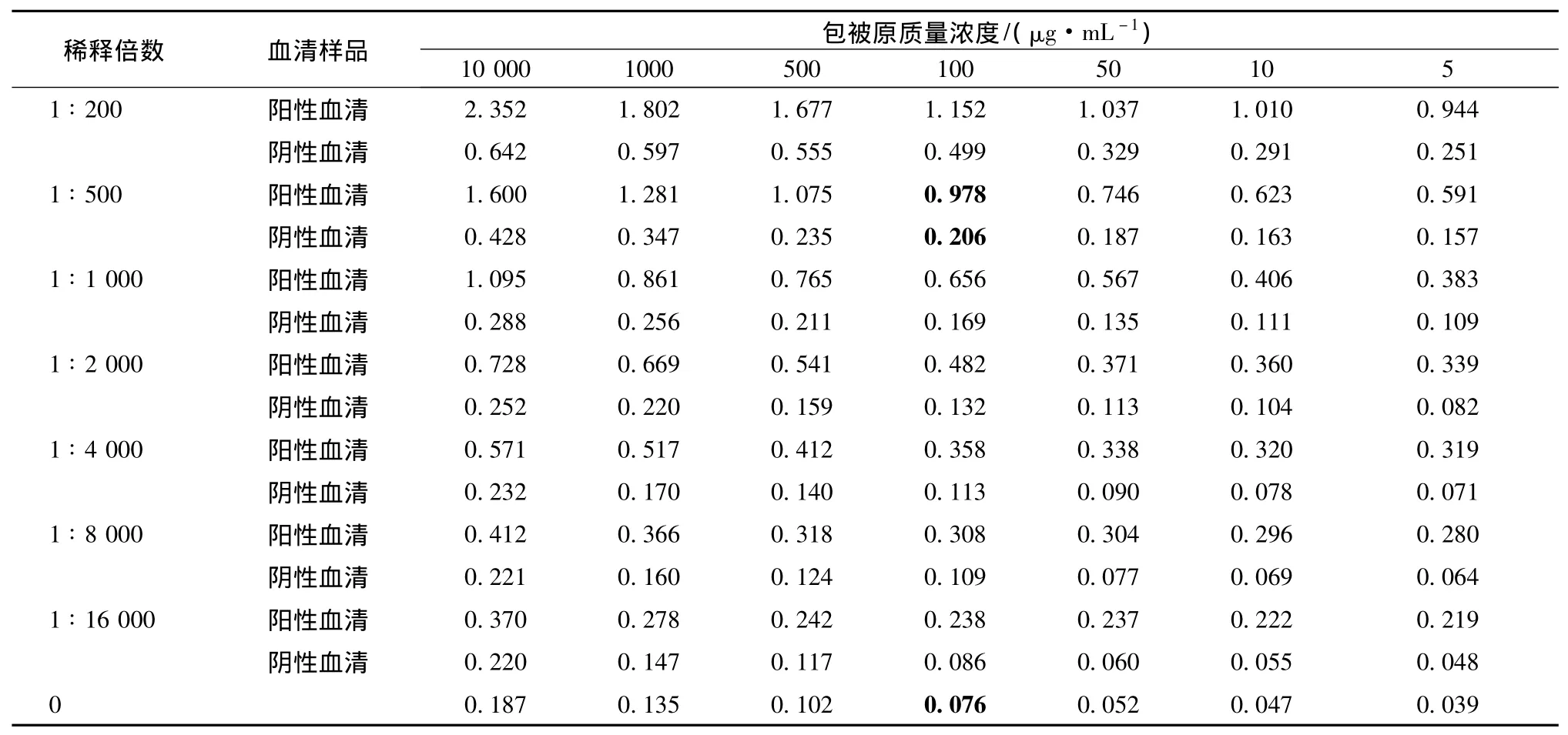
表1 方阵滴定实验中的OD450值(n=3)Tab.1 OD value at 450 nm in square titration(n=3)
3.2.2 间接ELISA法的特异性和灵敏度 方阵滴定结果表明随着BAL包被质量浓度的减小,血清中抗体的水平也随之降低。同时阳性血清中的抗体水平明显高于阴性血清(见图4)。说明经完全抗原BAL-BSA免疫后的家兔产生了针对BAL的特异性抗体,这也证实了完全抗原BAL-BSA偶联成功。分别以黄芩提取物、金银花提取物、连翘提取物、刺五加提取物和丹参提取物包被,除黄芩提取物外,其他提取物ELISA结果均为阴性,表明所建立的间接ELISA法检测抗BAL抗体具有良好的特异性。
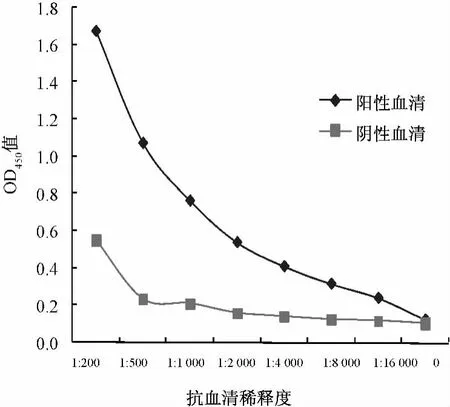
图4 间接ELISA法检测抗体的灵敏度Fig.4 Sensitivity of detecting antibody in rabbit serum with ELISA
对比倍比稀释的阳性和阴性血清的检测结果,显示当血清稀释度达到1∶8000时,P/N值仍大于2.1,说明该方法的灵敏度为1∶8000(见图4)。
3.2.3 间接ELISA法的操作程序 以CBS(pH 9.6,0.05 mol/L)为包被液,将BAL稀释至100μg/mL,100μL/孔,4℃包被过夜;用PBST洗涤后,加入1%明胶溶液37℃封闭2 h;洗涤,用PBST将待测抗血清按1∶500稀释,100μL/孔,同时设置阴性对照和空白对照。37℃温育1 h;洗涤,将酶标二抗(IgG/HRP-Ab)按1∶10000稀释,100μL/孔,37℃孵育1 h;洗涤,加入TMB底物缓冲液,100μL/孔,37℃显色15 min;每孔加入50μL 2 mol/L H2SO4溶液终止反应;用酶标仪记录450 nm波长处的OD值。
3.2.4 抗血清效价的测定及黄芩苷完全抗原(BAL-BSA)的免疫原性鉴定 采用上述ELISA反应条件,对完全抗原BAL-BSA免疫后的兔抗血清进行效价测定。以免疫前血清为阴性对照,每个样品平行设定三个复孔。测定结果见表2。结果显示采用所构建的完全抗原BAL-BSA免疫的3只家兔均产生了针对BAL的多抗,这也证实了BAL-BSA不但具有反应原性,同时具备免疫原性,说明完全抗原BAL-BSA合成成功。由于动物个体差异,3份抗血清效价各不相同,其中以1号家兔抗血清的效价最高,达到1∶8000。同时采用BAL单独免疫家兔,在相同的免疫条件下,所获得的抗体效价仅为1∶500,免疫原性很低。
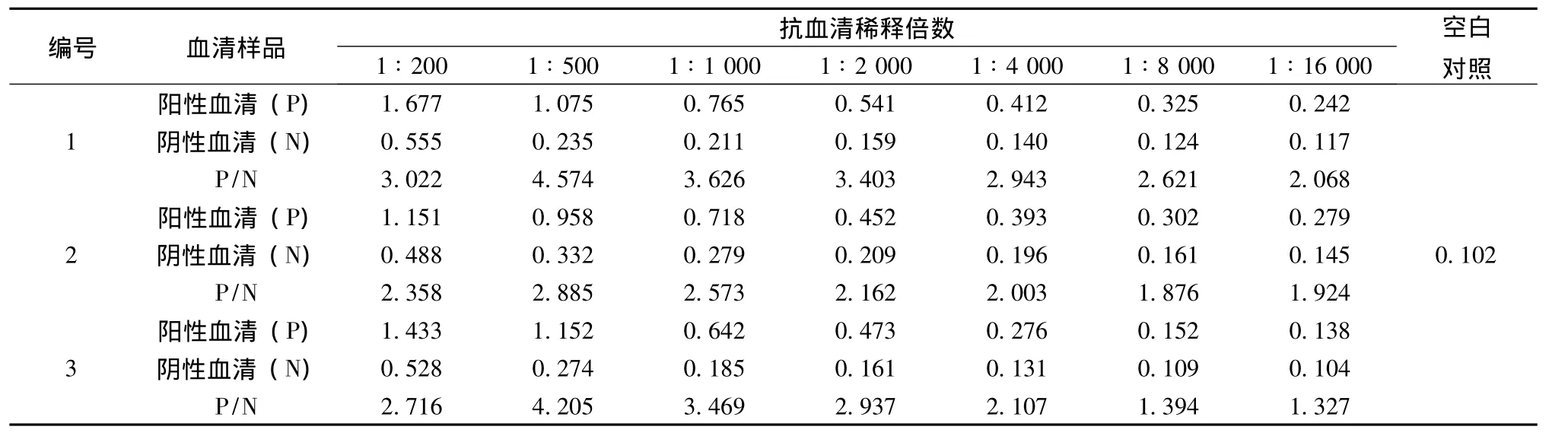
表2 不同兔抗血清间接ELISA测定结果(OD450)(n=3)Tab.2 OD value at 450 nm by indirect ELISA with different rabbit antisera(n=3)
3.2.5 抗血清的特异性检测 间接竞争ELISA法的结果表明连翘苷和绿原酸与抗血清无交叉反应,它们对BAL与抗血清的结合均无竞争抑制作用。图5为黄芩素(图5-A)和黄芩提取物(图5-B)与抗血清的交叉反应结果。由图5可知,OD450值随着竞争质量浓度的增加而减小,提示兔抗血清具有BAL特异性。以竞争质量浓度的对数为横坐标,以B/B0(竞争抗原孔吸收值/标准孔吸收值)为纵坐标,绘制竞争标准曲线。根据回归方程计算出黄芩素和黄芩提取物的抑制中质量浓度IC50分别为634.2μg/mL、5.85 mg/mL。

图5 竞争ELISA法检测抗血清的特异性Fig.5 Antiserum specificity detected by competitive ELISA
3.3 双黄连注射液中半抗原成分的检测 对26批双黄连注射液采用间接非竞争ELISA法进行检测。根据方阵滴定的结果拟合间接ELISA法标准曲线,由此计算阳性样品中可能的致敏性成分量。固定抗血清的稀释倍数为1∶500,以OD450值对抗原包被质量浓度(μg/mL)进行线性回归,得标准曲线为y=219.48x-117.21(r2=0.9910),抗原浓度与OD值呈现良好的线性关系,线性范围为2.5~100μg/mL;方法的检出限(+3sd)为0.43μg/mL,定量限+10sd)为 2.52μg/mL。
间接ELISA法结果显示,26批双黄连注射液样品中来源于两个厂家的3批样品(S8、S19、S25)检出微量抗原性成分,其含有量在3.5~4.4μg/mL之间,其余批次样品测定结果均为阴性。同时对比26批样品中黄芩苷的HPLC法测定结果,发现26批样品中S25黄芩苷的量最高(7.2 mg/mL),并且同批次样品在临床上出现过严重的ADR。
4 讨论
双黄连注射液作为第一批接受再评价的中药注射剂品种之一,过敏性休克和过敏样反应是其导致患者死亡的主要原因。作为一种多味药材的复方制剂,其所含的植物蛋白、多糖等大分子物质具有完全抗原性;其中的一些小分子化合物(如绿原酸、黄芩苷)可作为半抗原与体内蛋白质结合形成完全抗原,使机体致敏[7,14]。这种药品本身成分的复杂性以及引起过敏反应的多因素性,导致双黄连注射液引起的过敏反应具有很大的不可预知性和不确定性。现有的研究尚不能明确双黄连注射液的多种成分中,何种成分是主要的致敏原。
本研究进一步明确了双黄连注射液的半抗原成分——黄芩苷(BAL)的致敏性。采用NHS活性酯法在体外构建了BAL与BSA的完全抗原BALBSA,经动物免疫实验证实:BAL一般不易使机体致敏,其在与蛋白质等大分子载体结合成为完全抗原后兼具有良好的反应原性和免疫原性,可诱导机体产生高效价、高特异性的抗体。在优化了各项实验条件的基础上,建立了用于检测BAL的间接ELISA法。采用该方法检测发现双黄连注射液中BAL的量、ELISA法检测结果与临床ADR之间存在一定的相关性。这与文献报道双黄连注射剂的过敏反应与组分BAL有直接关系一致[6]。同时对比分析间接ELISA法和HPLC法的测定结果,发现两种方法的结果存在差异。26批注射液样品中均含有BAL(>6.0 mg/mL),而间接ELISA法仅检出3批样品呈阳性,说明间接ELISA法检出的抗原性成分并非BAL分子本身,提示双黄连注射液致敏的主要抗原决定簇与BAL的结构有关,所建立的间接ELISA法可用于检测注射液中潜在的与BAL结构相关的微量抗原性成分。实验中制备的抗BAL抗体,为BAL免疫试剂盒的开发提供了技术基础,也为后续深入研究BAL的免疫检测及快速检测技术奠定了基础;另一方面,所建立的ELISA法具有一定的通用性,可为进一步研究双黄连注射液或其他组成中含有黄芩或黄芩苷的中药注射剂(如清开灵注射液、茵栀黄注射液、痰热清注射液、舒肝宁注射液、银黄注射液等)中的致敏性物质提供依据。
[1]卫生部药典委员会.中药成方制剂第十一册:双黄连注射液[S].1996:38-39.
[2]宫 涛,刘 阳,张伯礼.310例双黄连注射剂不良反应分析[J].天津中医学院学报,2003,22(1):49-50.
[3]方世平,王燕平,颜 琳,等.双黄连注射剂不良反应10年系统性定量分析[J].药物流行病学杂志,2005,14(3):147-151.
[4]赵玉斌,肖 颖,谢雁鸣,等.双黄连注射液过敏原研究进展及其重要致敏原的易感基因研究策略[J].中国中药杂志,2011,36(8):1106-1108.
[5]张启云,张卓辉,张增珠,等.双黄连注射剂中半抗原物质ELISA检测方法的研究[J].江西中医学院学报,2009,21(1):39-41.
[6]童 路.双黄连注射剂的不良反应与成分间的关系[J].中成药,1997,9(4):47-48.
[7]屈会化,赵 琰,王雪茜,等.黄芩苷人工抗原的合成与鉴定[J].北京中医药大学学报,2010,33(9):606-609.
[8]罗小敏,陈建真.黄芩及其制剂中黄芩苷定量方法研究进展[J].世界科学技术-中医药现代化,2006,8(5):76-79.
[9]吴雪丹,丁宝月,傅应华.HPLC法测定复方苦参洗剂中盐酸小檗碱和黄芩苷[J].中成药,2012,34(5):868-871.
[10]李伟佳,王 强.HPLC测定4种中药制剂中栀子苷和黄芩苷的含量[J].中成药,2007,29(8):1177-1179.
[11]尹 婕,尹利辉,金少鸿.黄芩苷完全抗原的合成鉴定及其多克隆抗体的制备[J].药物分析杂志,2012,32(5):738-743.
[12]AOAC peer-verified methods program,manual on policies and procedures [S]. Arlington USA:AOAC International,1998:10.
[13]肖甄磊,谢忠良,何计国.卡巴氧的代谢物喹喔啉-2-羧酸人工抗原的合成及其多克隆抗体的制备[J].食品科学,2008,29(5):60-64.
[14]何 洲,屈会化,王雪茜,等.绿原酸作为半抗原的致敏性研究[J].北京中医药大学学报,2010,33(10):667-680.

