参苓白术散对利血平所致脾虚小鼠血清蛋白质组影响
张 帆,伍 春,明海霞,侯 茜,胡 锋,段永强,王 岚
(甘肃中医学院系统生物学与中医药转化研究所,中西医结合基础学科重点实验室,甘肃兰州 730000)
参苓白术散具有益气健脾,渗湿止泻的作用,是治疗脾虚湿盛泄泻的常用方。但其具体机制尚不清楚。血清中含有由各种不同细胞、组织和器官分泌的多种蛋白质,机体在任一时间阶段的病理、生理改变都可在血清中反映出来[1-2]。本研究从血清蛋白质组学的角度,将蛋白质组学和中医证型及药物干预研究结合起来[3-4],用双向凝胶电泳技术[5]分析参苓白术散对利血平所致脾虚证模型小鼠血清的二维凝胶图谱,对治疗前后表达差异明显的蛋白点进行基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)鉴定分析[6]。研究参苓白术散对该模型小鼠血清蛋白质组的影响,探讨其治疗脾虚泄泻的作用机制。
1 材料和方法
1.1 动物 昆明种SPF级健康小鼠,7~8周龄,雌、雄各半,体质量(20±2)g,由甘肃中医学院SPF动物实验中心提供,实验动物生产许可证号SCXK(甘)2011-0001。
1.2 主要试剂与仪器 Aurum Serum Protein Mini Kit、ProteoExtract Albumin/IgG Removal Kit、固 相pH梯度干胶条(IPG dry strip pH3~10 NL,17 cm)、40%(W/V)Bio-Lyte Ampholyte(pH3~10),美国BIO-RAD公司;碘乙酰铵(IAA)、琼脂糖、胰蛋白酶、乙晴(ACN)三氟乙酸(TFA)、基质α-氰基-4-羟基肉桂酸(CHCA)、蛋白质 Mark、溴酚蓝,美国Sigma公司;尿素、二硫苏糖醇、三羟甲基氨基甲烷(Tris)、丙烯酰胺(Arc)、甲叉双丙烯酰胺(Bis)、甘氨酸、四甲基乙二胺(TEMED)、3-[(3-胆酰胺丙基)-二乙铵]-丙磺酸(CHAPS)、硫脲(Thiourea)、十二烷基磺酸钠(SDS)、铁氰化钾[K3Fe(CN)6],美国Amresco公司;考马斯亮蓝试剂盒,南京建成;硫代硫酸钠、无水碳酸钠、甲醛、硝酸银、乙醇、冰醋酸、醋酸钠均为国产分析纯。所有缓冲液均用Milli-Q水配制。
IPG-phor等电聚焦仪、Ettan DALTⅡ垂直平板电泳系统、Quantity One图像分析软件,PDQues±8.0凝胶图像分析软件、垂直电泳槽、电泳仪、酶标仪(Bio-Ra公司)、高速低温离心机(Beckman公司)、SANYO-MDF-U73V超低温冰箱(三洋电机株氏会社)、漩涡混合器、扫描仪(清华紫光)、TS—1型脱色摇床(江苏海门市其林贝尔仪器制造有限公司)。
1.3 药物 参苓白术散:山西华康药业股份有限公司(生产批号110501);利血平:广东邦民制药厂有限公司(生产批号110719)。
2 方法
2.1 动物分组 造模前随机设正常对照组30只和造模组90只。造模成功后将造模组小鼠再随机分为模型组、参苓白术散高剂量组、参苓白术散低剂量组。
2.2 造模及给药 将小鼠置SPF环境中雌雄分笼适应性喂养3 d后开始造模。方法如下:正常组小鼠注射等量生理盐水。模型组注射利血平注射液,每只小鼠按10-4g/kg于小鼠背部皮下注射,每天1次,连续17 d。第11~17日药物干预组同时灌服参苓白术散,每天1次,低剂量组为临床等效剂量的5倍,1.5 g/kg;高剂量组为临床等效剂量的10倍,3 g/kg。正常饮食饮水,实验时间共17 d[7]。
2.3 标本的采集 最后一次给药24 h后取各组小鼠摘眼球取血,4℃静置2 h后以5000 r/min离心5 min取上清液,置于EP管中,把同组的小鼠血清各50μL混合,置于-80℃备用。同时,用比色法测定各组血清D-木糖水平(按试剂盒说明进行测定。试剂盒购自南京建成生物工程研究所,批号:20110504),碘-淀粉酶比色法测定[7]小鼠血清淀粉酶。
2.4 血清中高丰度蛋白的去除 按照Aurum Serum Protein Mini Kit的操作说明,用180μL Aurum血清蛋白结合缓冲液稀释,稀释60μL待纯化血清,取200μL稀释的血清样本上柱,离心,用200μL结合缓冲液清洗树脂,再离心,收集已去除白蛋白和IgG的过滤液,以100μL分装,-80℃保存备用。采用Bradford法测定各血清样本的蛋白浓度后进行双向凝胶电泳。
2.5 双向电泳(2-DE)、银染和图像分析
2.5.1 第一向等电聚焦 采用17 cm长,pH3~10的固相pH梯度干胶条聚焦,总上样量400μL含蛋白质180μg,用Bio-Rad公司的IPG-phor等电聚焦仪进行等电聚焦。设置等电聚焦程序参数为:主动水化20℃,50 V 12 h,除盐 250 V 30 min,1000 V 1 h,线性升压10000 V 5 h,10000 V聚焦60000 V 5 h,500 V保持任意时间。
2.5.2 第二向SDS-PAGE电泳 平衡后的IPG胶条移至12%SDS-PAGE胶上端,加入SDS电泳缓冲液,电泳条件为:起始用低电流(5 mA/gel)待样品完全走出IPG胶条,浓缩成一条线后,再加大电流(25 mA/gel),待溴酚蓝指示剂达到底部边缘时停止电泳。将凝胶小心地从玻璃板上剥离,轻轻置于适当大小的塑料染色盘中用双蒸水洗3次,固定液固定过夜。
2.5.3 染色 按银染试剂盒说明进行,包括固定、敏化、水洗、银染、水洗、终止、水洗步骤。
2.5.4 凝胶电泳图谱分析 硝酸银染色后的双向电泳凝胶采用Image Scanner TM扫描仪进行透射扫描,数字化图像文件采用PDQuest 8.0双向凝胶图谱分析软件(美国BIO-RAD公司)进行凝胶的数据分析。每组实验重复3次,共获得6张2-DE凝胶图像。分别将模型组、参苓白术散低剂量组和参苓白术散高剂量组的血清蛋白图谱与正常对照组血清蛋白图谱进行比较,每两组图谱中蛋白质的表达量相差两倍及以上的点视为有差异的点。并选取差异较为明显的蛋白点,进行进一步的MALDI-TOFMS鉴定分析。
2.5.5 质谱鉴定 切取差异表达蛋白质点,经水洗、脱色、酶解和萃取,获得蛋白质的肽混合样品,冻干备用。
取1μL样品进行质谱点靶鉴定,以API4800串联飞行时间质谱仪(MALDI-TOF/TOF),采用正离子模式和自动获取数据的模式进行数据采集;PMF的质谱扫描范围为800~3500 Da;选择强度最大的10个峰进行二级质谱。将一级和二级质谱数据整合并使用GPS3.6(Applied Biosystems)和Mascot2.1(Matrix Science)对质谱数据进行分析和蛋白鉴定。
2.5.6 差异蛋白的数据库查询 采用Flex analysis软件处理肽质量指纹谱(Peptide Mass Fingerprint,PMF),得PMF图谱。将肽质量指纹谱用Matrixscience提供的Mascot软件搜索NCBInr数据库,查询PMF所对应蛋白质及相关信息。
3 结果
3.1 利血平法构建小鼠脾虚模型 本实验用利血平造模后,空白对照组小鼠,双眼明亮有神,活动灵活,皮毛顺滑有光泽,饮食、饮水适中,大便正常。模型组小鼠,皮毛失去光泽、拱背、扎堆、活动减少、随后出现皮毛枯槁、倦卧、嗜睡、便塘、肛周污秽、食量减少(P<0.01)、消瘦等症状,血清D-木糖及血清淀粉酶均明显降低(P<0.01)。(见表1),说明模型的复制成功[8-9]。
经参苓白术散干预后第4天起,一般情况逐渐好转,进食量增多、活动增加,血清淀粉酶和D-木糖水平增加(P<0.05)。
表1 各组体质量、食量、血清淀粉酶、血清D-木糖水平的变化()Tab.1 Diversification of body weight,food intake and serum amylase as well as serum D-xylose content in different groups()

表1 各组体质量、食量、血清淀粉酶、血清D-木糖水平的变化()Tab.1 Diversification of body weight,food intake and serum amylase as well as serum D-xylose content in different groups()
注:与模型组比较,▲P<0.01,*P<0.05
组 别 剂量/(g·kg-1)动物数/只体质量/g食量/g血清淀粉酶/(U·100 mL-1)D-木糖/(Inmol·L -1)正常对照组 - 30 24.16±2.88▲ 3.54±0.48▲ 729.23±18.69▲ 5.13±0.26▲模型组 - 30 21.30±2.71 2.86±0.56 608.82±15.60 2.73±0.41参苓白术散低剂量组 1.5 30 22.63±2.09 3.27±0.53 654.57±20.48 3.89±0.52参苓白术散高剂量组 3 30 22.56±1.91 3.45±0.52 693.64±19.50 4.73±0.35
3.2 参苓白术散对利血平致脾虚小鼠血清蛋白质组变化的影响
3.2.1 2-DE结果 用PDQuest 8.0双向凝胶图谱分析软件对正常对照组、模型组、参苓白术散高剂量组和参苓白术散低剂量组的血清电泳图谱进行对比分析(见图1,图2),在模型组中发现35个蛋白点与正常对照组有明显差异,在经过治疗后,这些表达异常的蛋白点均回复至正常水平或趋于正常水平。模型组和正常组比较有25个低表达,高表达的有10个。

图1 血清2-DE凝胶图谱(银染)Fig.1 Gel map of serum 2-DE(silver staining images)

图2 差异点在二维凝胶图谱中的局部2D及3D图Fig.2 Local 2D and 3D map of point-of-difference in the two-dimensional gel patterns
3.2.2 质谱鉴定结果 对10个差异明显的在治疗组高表达的蛋白点进行质谱鉴定,得到各个点的肽质量指纹谱,如图3所示。用Matrixscience提供的Mascot软件搜索NCBInr数据库,查询PMF所对应蛋白质及相关信息,成功鉴定出6种蛋白质(见表2),分别为β-球蛋白(beta-globin)、维生素D结合蛋白(vitaminD-binding protein)、妊娠区带蛋白(Pregnancy zone protein)、载脂蛋白A-I(apolipoprotein A-I)、载脂蛋白A-IV(apolipoprotein AIV)和白蛋白(albumin)。
图3 蛋白质点的MALDI-TOF-MS质谱结果示例Fig.3 Examples of single-point protein's MALDI-TOF-MS mass spectrometry
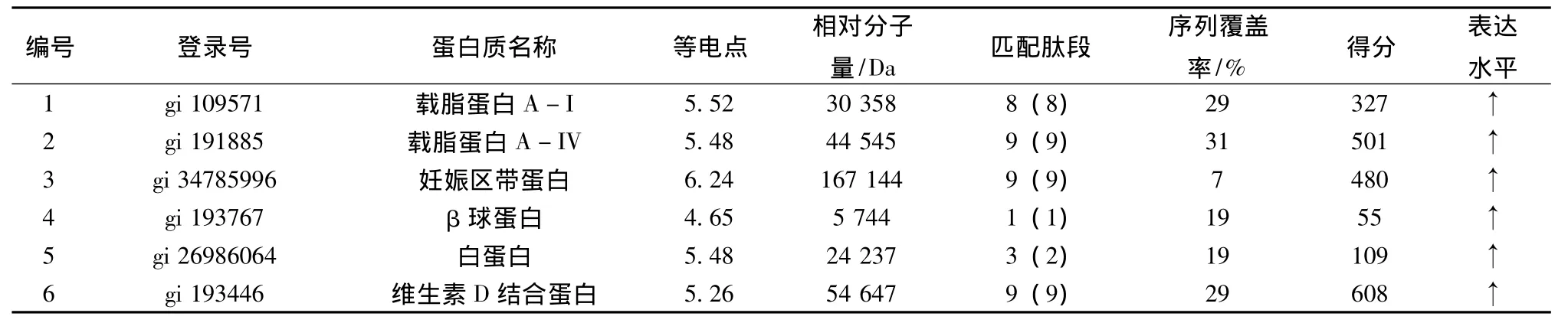
表2 差异表达蛋白的质谱分析和数据查询结果Tab.2 Results of mass spectrometry and data query of differential expression of proteins
4 讨论
脾虚动物模型的制作方法主要包括模拟中医传统病因和用西医病因病理造模等两大类[10],利血平所致动物脾虚模型,是利用西药的副作用产生类似脾虚的临床表现,也是脾虚实验研究的常用模型[7],利血平属于肾上腺能神经阻断剂,用药后交感神经系统的功能受到遏制,副交感神经系统的功能相对占优势,于是出现如肠运动功能亢进,大便次数增多、腹痛、腹泻、胃酸分泌增加、溃疡病等副作用[11]。建立脾虚证动物模型应考虑与脾运化功能失职相关的指标。利血平所致的脾虚小鼠模型在一定程度上反映了类似的病理改变,其表现和中医脾虚证有高度的相符性。
参苓白术散是由人参、茯苓、白术、甘草、山药、扁豆、薏苡仁、桔梗、砂仁、莲子等组成,功效健脾益气,渗湿止泻;主治脾胃虚弱,食少便塘,四肢乏力,形体消瘦等证。据现代药理学研究,该药大剂量时能抑制肠管的收缩,小剂量时则可兴奋之。张仲林等[12]通过研究发现,正常小鼠灌服参苓白术散后胃的排空速度明显加快,对胃轻瘫小鼠的胃排空能力显著提高,并能使腹泻小鼠的腹泻次数及腹泻量减少,这一结果表明参苓白术散对动物的胃肠具有双向调节功能。针对利血平致脾虚模型小鼠的特点及参苓白术散的药理作用,本研究选用参苓白术散对利血平致脾虚小鼠进行药物干预,在用药7 d后,检测其血清蛋白质组的变化,经质谱分析,从10个高表达的蛋白中鉴定出β-球蛋白、维生素D结合蛋白、妊娠区带蛋白、载脂蛋白 A-I、载脂蛋白 A-IV和白蛋白等6种蛋白,这6种蛋白在脾虚证模型小鼠血清中表达下调,在参苓白术散高剂量组表达上调,且高剂量组的蛋白表达量基本和正常对照组一致。模型组小鼠在用参苓白术散灌胃7 d后,脾虚症状得到改善。
维生素D结合蛋白主要由肝实质细胞合成[13],是一种多功能的血浆蛋白质。其中一项重要功能是作为维生素D的载体蛋白。还可以清除血浆的代谢物、内毒素和坏死细胞释放到细胞外的一些有害物质[14]。在免疫方面也有重要功能,可以和B淋巴细胞表面的IgG、T淋巴细胞表面的Fc受体及单核细胞结合,在急性组织损伤反应中可转化为巨噬细胞的激活因子、增强中性粒细胞趋化作用等[15]。
载脂蛋白A-I(ApoA-I)是体内含量最多的载脂蛋白之一,其合成部位主要是肝脏、小肠,它与高密度脂蛋白结合,在机体非特异性免疫过程中发挥抗内毒素的功能[16]。脾虚时由于ApoA-I表达降低,使机体非特异性免疫功能紊乱。
载脂蛋白A-IV(ApoA-IV)是由肠道细胞分泌的一种蛋白质,随乳糜微粒经淋巴系统进入血液。可根据生理条件的不同而在各种脂蛋白之间重新分布,参与脂蛋白的代谢,主要参与外源性脂肪的吸收及高密度脂蛋白的成熟过程,与ApoA-I共同参与机体的非特异性免疫。在人体,除了小肠,下丘脑也可分泌 ApoA-IV[17]。肠道 ApoA-IV的合成和分泌主要受脂肪吸收的刺激[18]。
本研究中脾虚的表现主要体现在小肠功能紊乱,小肠吸收功能障碍,由于脾虚证小鼠肠道吸收不良,使机体细胞内氨基酸、糖类、脂肪等营养物质水平下降,细胞中合成蛋白质原料及能量不足,导致细胞合成蛋白质的能力降低,从而使多种蛋白的合成不足,机体免疫功能低下,肠道细胞损伤。参苓白术散干预利血平所致脾虚小鼠后,以上6种蛋白质表达上调。提示参苓白术散能直接调节脾虚小鼠的免疫功能、促进与小肠吸收功能相关的蛋白质正常表达,保护其肠组织和肠细胞的损伤[19],本研究为探讨脾虚证的本质、诊断的客观化奠定了基础。
[1]廖秋林,陈晓东,丁彦青,等.血清蛋白质组学技术及研究进展[J].中国病理生理杂志,2008,24(2):402-407.
[2]赵海燕,郭 勇.中医证本质研究中的血清蛋白质组学应用探讨[J].中华中医药学刊,2010,28(1):88-90.
[3]贾连群,王彩霞,冯峻屹,等.基于蛋白质组学技术的脾虚证本质研究探析[J].中华中医药学刊,2011,29(4):720-721.
[4]朱明丹,杜武勋,姜 民,等.中医证候与基因、蛋白质、代谢组学研究思路探讨[J].中国中医基础医学杂志,2010,16(1):69-71.
[5]宗美娟,孟 猛,双向凝胶电泳技术在胰腺癌蛋白质组学研究中的应用及条件优化[J].山东医药,2010,50(3):20-22.
[6]甄 艳,施季森,质谱技术在蛋白质组学研究中的应用[J].南京林业大学学报:自然科学版,2011,35(1):103-108.
[7]李仪奎.中药药理实验方法学[M].2版.上海:上海科学技术出版社,2006:162-163,459.
[8]中华人民共和国卫生部药政司.中药治疗脾虚证的临床研究指导原则[J].中国医药学报,1988,3(5):71.
[9]沈自尹,王文健.中医虚证辨证参考标准[J].中西医结合杂志,1986,6(10):598.
[10]陆 佰,荣李林.脾虚动物模型研制的进展[J].齐齐哈尔医学院学报,2006,27(2):194-195.
[11]郭文峰,高小玲,李茹柳,等.利血平致大鼠脾虚模型尿D-木糖排泄率与肠黏膜三磷酸腺苷水平的研究[J].中国中西医结合消化杂志,2008,16(4):211-214
[12]张仲林,钟 玲,臧志和,等.参苓白术散对动物胃肠动力影响的实验研究[J].时珍国医国药,2009,20(12):3151-3152.
[13]MeLeod J F,Cooke N E.The vitamin D-binding protein,alpharfeto protein,albumin multigene family:detetion of transcripts in multiple tissues[J].J Biol Chem,1989,264(36),21760-21769.
[14]Van Baelen H,Bouillon R,De Moor P,et al.Vitamin D-binding protein(Gc-globulin)binds actin[J].J Biol Chem,1980,255(6):2270-2272.
[15]Meier U,Gressner O,Lamrnert F,et al.Gc-Globulin:Roles in responsetoinjury[J]. ClinChem, 2006,52(7):1247-1253.
[16]Ma J,Liao X L,Lou B,et al.Role of apolipoprotein A-I in protecting against endotoxin toxicity[J].Acta Biochem Biophys Siu,2004,36(6):419.
[17]Liu M,Doi T,Shne L,et al.Intestinal satiety protein apolipoprotein AIV is snyhtesized and regulated in rat hypothalamus[J].Am J Physiol Regul Integr Comp Physiol,2001,280(5):R1382-387.
[18]Tso P,Liu M.Ingested fat and satiety[J].Physiol Behav,2004,81(2):275-287.
[19]杨旭东,张 杰,王 崴,等.参苓白术散对脾虚小鼠肠保护作用及其机制的研究[J].牡丹江医学院学报,2009,30(5):9-11.

