多学科协作治疗直肠癌伴同时性肝转移患者一例
鞠海星 朱玉萍 朱利明 刘鲁迎 杜义安 张凌男 吴伟 丁国军 朱远 应杰儿 李德川
·病例讨论·
多学科协作治疗直肠癌伴同时性肝转移患者一例
鞠海星 朱玉萍 朱利明 刘鲁迎 杜义安 张凌男 吴伟 丁国军 朱远 应杰儿 李德川
一、病史简介
患者女性,69岁。2011年3月患者无明显诱因出现便血,伴排便次数增多症状,每日3~5次,时有里急后重,无黏液便,无腹痛、腹胀、腹泻。2011年6月症状加重,遂来我院就诊,肛门指诊发现直肠肿块。患者既往无高血压、糖尿病、心脏病等病史,个人史、家族史无特殊发现。直肠指检,发现距肛缘7 cm处可触及肿块下缘,质硬,活动度欠佳,退出可见指套染血。相关辅助检查:癌胚抗原为18.12 ng/ml,血常规、生化等检查无明显异常。肠镜检查:距肛缘8 cm处有一肿块,环绕肠腔全周,肠腔狭窄。取病理回报:中分化腺癌。K-ras基因检测为突变型。盆腔MRI检查:示直肠中下段肿瘤,有一骶前转移结节,肠周可见数枚肿大淋巴结。上腹部CT检查:右肝转移瘤。胸部CT检查无明显异常。患者及家属对治疗持积极态度,但经济条件一般。
二、治疗前讨论
影像科专家:患者盆腔MRI检查发现直肠中下段明显不规则环形增厚,增强显影后强化较明显,直肠外膜不完整,直肠与骶尾骨之间见一约1.8 cm×1.5 cm大小结节灶,增强显影后环形强化,直肠周围另见多个小淋巴结(图1)。上腹部CT检查:示右肝后叶上段第Ⅶ段见一枚低密度灶,大小约4.2 cm×3.3 cm,形态不规则,边界欠清楚,增强扫描: 示动脉期轻度强化,边缘可见迂曲增粗的肝内动脉影(图2);病灶在门脉期持续强化,边界显示清楚。结合患者的肠镜及病理检查,目前诊断:直肠癌伴肝转移cT3N1M1a,ⅣA期。

图1 直肠癌患者初始治疗前的盆腔MRI检查图像
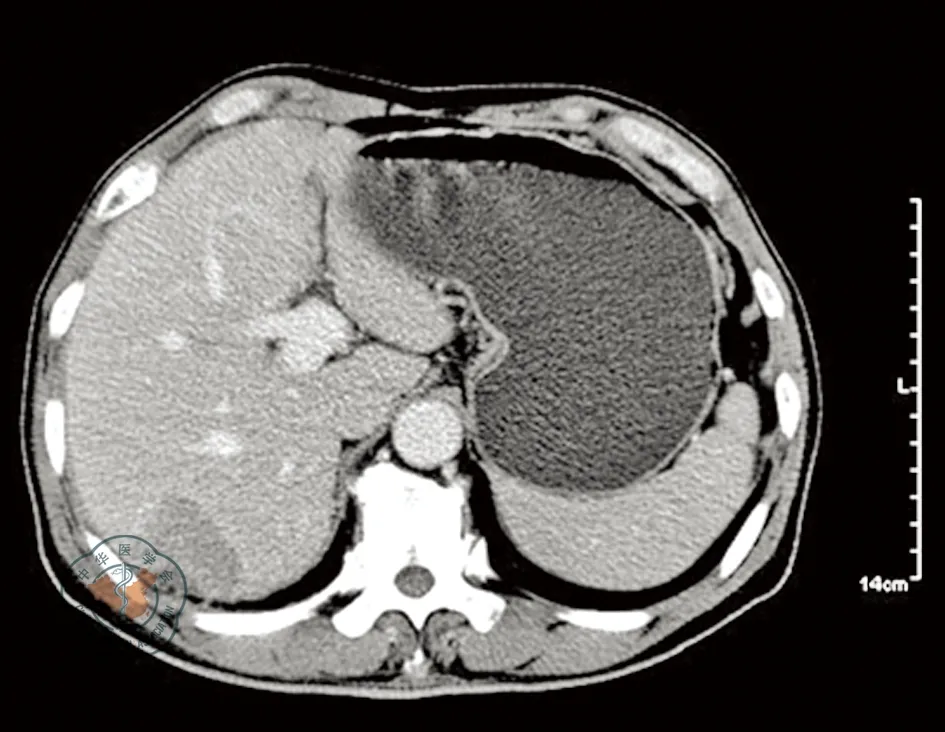
图2 直肠癌患者初始治疗前肝转移灶CT检查图像
肝胆外科专家:患者肝脏第Ⅶ段为单发转移肿瘤,大小4.2 cm×3.3 cm,余肝未见肿瘤占位病变,肝脏质地较好,无明显肝硬化,肝脏转移瘤切除可能性大。若原发灶和转移灶均能获得根治性切除,可提高患者治疗疗效,延长生存时间。但患者具有同时性肝转移、肝脏肿瘤较大等预后不良因素,所以也可考虑先行全身化疗,若肿块缩小,再考虑直肠原发灶和肝转移灶的同期或分期切除[1]。
结直肠外科专家:该患者为直肠癌ⅣA期,目前无明显梗阻、严重出血、穿孔等征象,宜先采用全身化疗为主的综合治疗。近年的临床试验结果提示手术切除肝转移瘤可为患者生存带来益处。2004年Adam[2]教授认为肝转移灶如能达到R0切除条件,患者的5年生存率高达48%。肝转移灶最初无法切除经转化治疗后可达到R0切除的患者,其5年生存率为33%;但肝转移灶不能切除的患者5年生存率则低于10%。随着技术进步及有效药物的应用,2009年Kopetz[3]教授认为肝转移灶获R0切除的患者5年生存率提高至55%;肝转移灶未能切除的患者5年生存率低于20%。该患者肝脏转移瘤评估有潜在可切除条件,遂考虑给予患者积极的治疗方案,同期或分期切除原发灶及转移灶,以获得最佳的治疗效果。因该患者直肠指检肿块较为固定,活动度差,影像学检查提示肿块外浸润明显,且直肠周围多发肿大淋巴结,转移可能性大,局部分期为cT3N1,若先行手术治疗,局部R0切除可能性较小,环周切缘阳性的可能性较高,术后局部复发得可能性大,会导致治疗失败。所以术前应行放射和化学治疗,肿瘤明显降期后,再考虑再行手术治疗。
肿瘤内科专家:本患者直肠癌伴同时性肝转移,直肠原发病灶目前不可切除,故计划进行新辅助治疗,争取手术达到R0切除条件。目前推荐的术前治疗方案有:FOLFOX(奥沙利铂+亚叶酸钙+氟尿嘧啶)、FOLFIRI(伊立替康+氟尿嘧啶)、CapeOX(卡培他滨片+奥沙利铂)或这些上述方案分别联合分子靶向药物,与分子靶向药物的联合会有更高的有效率[4-5]。结合本患者K-ras基因类型(突变型)、年龄及拟局部放疗的特点,建议采用氟尿嘧啶类药物与奥沙利铂联合的二药方案,若经济条件允许,可联合贝伐单抗。
放疗科专家:若患者在接受全身化疗后,原发肿瘤降期明显,肝转移灶缩小,全身评估未见新增转移灶,在接受同期或分期病灶切除后,是否予以局部放疗目前临床循证依据有限。若新辅助治疗后,肝转移灶控制理想,但原发灶降期不满意,可考虑行术前原发灶放疗同步氟尿嘧啶化疗增敏,以使原发灶降期,并可考虑放疗后休息期间再增加1次XELOX方案化疗。对于此患者若同步放化疗期间仍有远处转移灶存在,同步化疗方案中是否需要增加奥沙利铂剂量,增加对全身肿瘤的控制,提高术后部分缓解率和完全缓解率,目前循证依据有限,需视患者的肿瘤负荷和放化疗耐受程度等情况决定。

图3 拟行治疗过程示意图
经多学科协作治疗组专家讨论后达成如下共识:根据患者病史、体格检查、辅助检查和病理情况,目前临床诊断直肠癌肝转移,cT3N1M1a,ⅣA期。患者直肠原发灶固定,外侵明显,难以达到R0切除,而肝转移灶目前提示单发,评估为潜在可切除病灶。该患者的治疗目的为通过转化性治疗,争取手术达到R0切除。患者目前无明显梗阻、严重出血、穿孔征象,宜先选择全身化疗为主的综合治疗,希望能使直肠病灶降期,同时控制远处转移灶,并观察肿瘤对所选化疗药物的敏感性。
拟行治疗方案:结合患者经济条件、治疗意愿、年龄及毒性预期,宜选择氟尿嘧啶类药物与奥沙利铂联合的二药方案,拟行2周期全身化疗后再次评估原发灶及转移灶的切除可能。若原发灶降期明显,可考虑行直肠癌和肝转移瘤同期或分期切除术,术后行辅助化疗或辅助同步放、化疗。若原发灶降期不满意,需针对直肠肿瘤进行术前同步放、化疗,使用氟尿嘧啶类药物增敏,并在放疗后休息期间增加1个疗程XELOX方案化疗。放、化疗结束后需再次评估肿瘤切除可能,若可切除,在放疗结束6~8周后行同期或分期手术,术后再行辅助化疗。若为分期手术,考虑采取“肝优先”原则。若患者接受全身化疗后,评估发现原发灶或转移肿瘤进展,则放弃手术治疗,更改二线方案化疗。(图3)
三、诊治过程
1.全身化疗:2011年6月13日至2011年8月15日,患者接受XELOX方案化疗3周期:奥沙利铂130 mg/m2第1天;卡培他滨1 000 mg/m2每日2次持续14天,每3周重复
2.肿瘤评估:原发灶降期不明显,肝转移灶部分缓解(图4~5)。
3.术前同步放、化疗:2011年8月22日至2011年9月26日,患者接受盆腔三野10 MV-X线适形放疗至DT 45 Gy/25F,然后缩野针对原发病灶加量DT 5.4 Gy/3F至总剂量DT 50.4 Gy/28F,同步予希罗达825 mg/m2(体表面积)每天2次每周5天增敏,放疗后休息3周。2011年10月18日行XELOX方案化疗1疗程:第1天奥沙利铂130 mg/m2(体表面积)第1天;卡培他滨1 000 mg/m2(体表面积)每日2次持续14 d。

图4 直肠癌患者全身化疗后肝转移灶CT检查图像
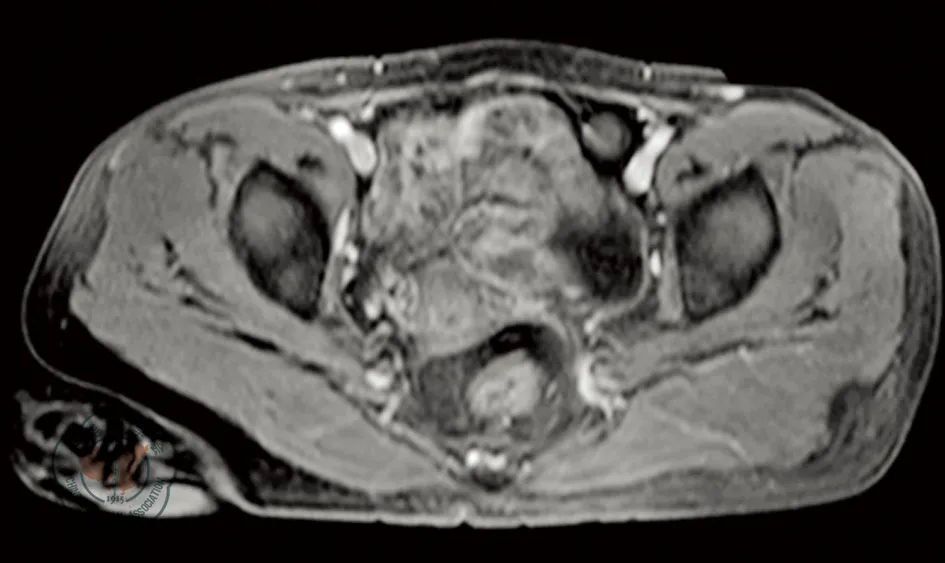
图5 直肠癌患者同步放化疗盆腔MRI检查图像
4.同期切除病灶:化疗结束后休息4周,2011年12月5日患者接受手术:直肠癌根治术加右肝转移瘤切除术。术中见肝脏转移灶位于右肝后叶,2 cm×2 cm大小,手术过程顺利。术后病理报告:直肠粘膜层和浅肌层内见少量重度异型增生腺体伴溃疡形成及炎症细胞浸润,纤维组织增生(符合放、化疗后改变),10个淋巴结慢性炎;肝脏切除标本未见明确肿瘤细胞。术后病理分期:T0N0M0。
5.术后辅助化疗:2011年12月29日至2012年4月9日,患者接受XELOX方案5周期:第1天奥沙利铂 130 mg/m2(体表面积);卡培他滨1 000 mg/m2(体表面积)每日2次,持续14 d,每3周重复给药。
6.术后随访:所有治疗完成后,随访至今,未见局部复发及远处转移。
专家点评:直肠癌肝转移患者最佳治疗方案的选择,临床面临较多困难和较大分歧,目前尚无大型临床试验循证依据提供对此类患者的诊治参考。因此,多学科协作治疗团队为其制定高质量、个体化、最适合的治疗方案就显得尤为重要。但在制定诊疗方案前,一定要明确讨论病例的治疗目的,即治疗是以根治为目的还是以姑息治疗为主,并围绕此目的,有机结合多学科的治疗手段,探寻最佳治疗策略及治疗方案,并能够制定完整的“诊治路线图”,从整体及宏观上把握诊治路径,并明确相关的评估节点和细节。
目前多项临床试验已证实,对于肠癌肝转移患者,若能在进行积极有效的转化治疗后,施行原发灶及肝转移灶的R0切除可使患者获益,这已成为国内专家的共识。选择高效的化疗方案,依据临床实际情况和患者及家属的治疗意愿、经济条件,合理、恰当、循证地选择分子靶向药物联合治疗,可以极大地提高病灶的R0切除可能,延长患者的生存时间。
放射治疗已经成为直肠癌治疗不可或缺的一部分。对于Ⅱ~Ⅲ期患者,术前新辅助放、化疗或术后辅助放、化疗已经成为临床循证Ⅰ类证据。但对于Ⅳ期直肠癌患者的诊治,放射治疗的作用及介入时机,目前临床循证依据十分有限。
以多学科医师参与、面对面探讨疑难患者诊治方案为特点的多学科协作治疗制度的建立和运行,是目前肿瘤规范、综合、个体化治疗的趋势之一。多学科协作治疗制度的运行,不仅为患者解决了实际问题,提高患者的治疗效果,还加强了多个学科之间的交流,促进了临床和科研的发展,为医院在肿瘤综合治疗方面树立了品牌,提高了知名度。今后多学科协作治疗模式还将在制度、远程会诊、对外交流合作等方面不断努力,以便更好地服务于临床,造福患者。(点评专家:浙江省肿瘤医院院长毛伟敏教授)
[1] Nordlinger B,Sorbye H,Glimelius B,et al.Perioperative chemotherapy withFOLFOX4 and surgery versus surgery alone for resectable liver metastases fromcolorectal cancer(EORTC Intergroup trial 40983):a randomised controlled trial.Lancet,2008,371(9617):1007-1016.
[2] Adam R,Delvart V,Pascal G,et al.Rescue Surgery for Unresectable Colorectal Liver Metastases Downstaged by Chemotherapy.Ann Surg,2004,240(4):644-657.
[3] Kopetz S,Chang GJ,Overman MJ,et al.Improved survival in metastatic colorectal cancer is associated with adoption of hepatic resection and improved chemotherapy.J Clin Oncol,2009,27(22):3677-3683.
[4] Van Cutsem E,Kohne CH,Lang I,et al.Cetuximab Plus Irinotecan,Fluorouracil,and Leucovorin As First-Line Treatment for Metastatic Colorectal Cancer:Updated Analysis of Overall Survival According to Tumor KRAS and BRAF Mutation Status.J Clin Oncol,2011,29(15):2011-2019.
[5] Bokemeyer C,Van Cutsem E,Rougier P,et al.Addition of cetuximab to chemotherapy as first-line treatment for KRAS wild-type metastatic colorectal cancer:pooled analysis of the CRYSTAL and OPUS randomised clinical trials.Eur J Cancer,2012,48(10):1466-1475.
鞠海星,朱玉萍,朱利明,等.多学科协作治疗直肠癌伴同时性肝转移患者一例[J/CD].中华结直肠疾病电子杂志,2013,2(2):77-79.
10.3877/cma.j.issn.2095-3224.2013.02.08
310022 杭州,浙江省肿瘤医院结直肠外科
李德川,Email:dechuanli@126.com
2013-01-20)
(本文编辑:马天翼)

