辽东楤木根皮醇提取物和人参茎叶总皂苷对过度训练大鼠海马BDGF和NGF mRNA表达的影响
常 波,贾斯媛,史娇娇,魏 伟,周丹丹
(1.沈阳体育学院运动人体科学学院,辽宁沈阳110102;2.沈阳体育学院研究生部,辽宁沈阳110102)
随着竞技体育水平的不断提高,人体的运动极限不断被打破,这在一定程度上要归功于超负荷的训练。运动对机体来说是一个应激刺激,根据应激反应原理,在一定范围内刺激的强度与机体的应激反应、适应性变化和机能水平的提高呈正相关。但在追求最大应激反应的过程中有时会越过人体的生理极限,造成机体在一定时间内无法恢复的过度疲劳,不仅影响到正常的比赛和训练,还威胁到运动员的健康。
多数学者认为运动性疲劳的发生机理与运动的类型有关,短时间剧烈运动时出现的疲劳,往往与肌肉中能源物质的消耗及乳酸等代谢产物的堆积这些外周因素有关,而长时间中等、大强度的运动产生的疲劳,则以中枢神经系统出现保护性抑制的中枢因素为主。中枢神经系统中的神经递质和神经调质参与这类疲劳的发生。其中,海马与下丘脑-垂体-肾上腺轴、性腺轴有着密切的关系,与运动员的运动能力和机体的恢复密切相关。本研究探讨辽东楤木根皮醇提取物和人参茎叶总皂苷对过度训练大鼠海马及其一些生长因子的影响,探讨过度疲劳发生的机制,寻找预防的手段。
1 实验对象与方法
1.1 实验对象
根据随机设计原则,将实验大鼠按体重随机分为五组,给药前用蒸馏水配制成临床等剂量的人参、楤木药液,分别按20.83mg人参/kg体重,18.75mg楤木/kg体重,31.25mg楤木/kg体重进行给药。NC、EC组每天灌服蒸馏水,PG组每天灌服人参药液,LA、HA组每天分别灌服低剂量和高剂量的楤木药液,灌胃量均为1ml/100g体重。EC、PG、HA和LA组按朱全等[9]建立的超负荷训练大鼠游泳模型略加改进进行训练(表1)。

表1 大鼠分组及给药方案

表2 大鼠运动方案
大鼠在长100cm、宽60cm、高70cm的玻璃泳缸中游泳,水深50cm,每只大鼠游泳面积大于300cm2,水温控制在(34±2)℃,在大鼠游泳过程中出现力竭时(力竭标准为大鼠从水面下沉,经10s后仍不能返回水面),将其捞出,休息一定时间(5~30min)后,放入泳缸中继续完成游泳负荷。及时清理泳缸中的大鼠粪便以保证水质,大鼠每次游泳出来后马上放于浴霸照射下取暖,烘干体毛。
1.2 实验方法
1.2.1 血红蛋白和尿素氮的测定 利用放免法采用南京建成生物工程研究所提供的试剂盒进行测定。
1.2.2 尿总蛋白、睾酮和皮质酮的测定 利用放免法采用解放军总医院科技开发中心放免研究所试剂盒测定。
1.2.3 mRNA基因表达基本步骤 组织取样:运动组分别在力竭游泳运动后即刻断头处死大鼠,对照组随后断头处死。分别取大鼠海马组织,分别加入到含有1mlTrizol的EP管中,-70℃冰箱中保存。
RNA的提取:将适量海马组织分别加入1ml Trizol试剂中,剪碎组织块,室温静置5min后,加入0.2ml氯仿,震荡混匀,室温静置5min 后,11 000r/min,4℃离心15min,将0.45ml上清液转移至新的离心管中,加入0.45ml异丙醇,-20℃冰箱中过夜。第二天,11 000r/min,4℃离心15min,弃上清,留沉淀,加入1ml75%乙醇清洗沉淀,11 000r/min,4℃离心15min,弃上清,留沉淀,吸水纸吸干,注意切勿将沉淀吸出,然后干燥。用DEPC水溶解,瞬间离心后,-20℃冰箱中存放。
RNA纯度的鉴定:1μl RNA溶解于79μl DEPC水中,混匀,用紫外分光光度计测样本在260nm和280nm的光吸收值(A),从A260/A280的比值即可判断样品的纯度。PCR扩增的寡核苷酸引物由沈阳联星生物技术有限公司合成(表3)。根据参考文献和基因文库(J03808)设计。
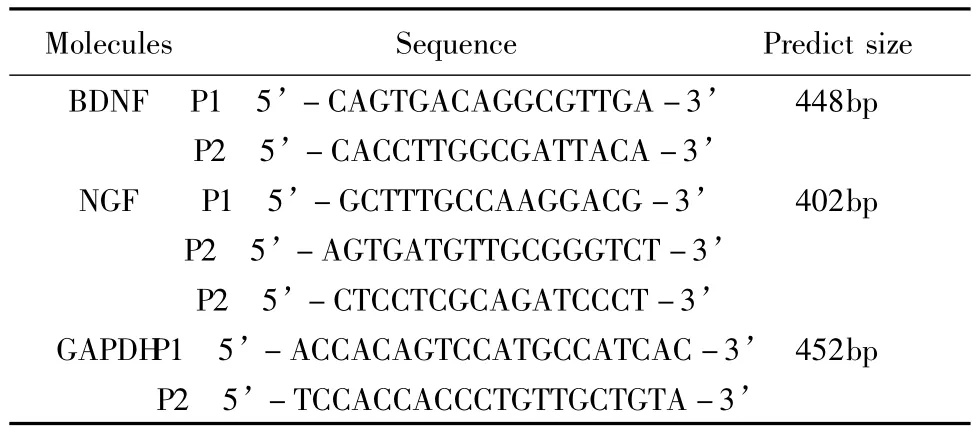
表3 用于PCR扩增的寡核苷酸引物
RT-PCR反应:①反转录反应:按下列组成配制反转录反应液:MgCl2 2μl,10 × RT Buffer 1μl,RNase Free dH2O 3.75μl,d NTP Mixture(各 10mM)1μl,RNase Inhibitor 0.25μl,AMV ReverseTranscriptase 0.5μl,Radom 9mers 0.5μl,实验样品 RNA 1μl。Total 10μl/sample。按下面条件进行反转录反应:30℃ 10min,42℃ 30min,99℃ 5min,5℃5min,1cycle。②PCR反应:按下列组成配制PCR反应液:5×PCR Buffer 10μl,灭菌蒸馏水 28.75μl,TaKaRa Ex Taq HS 0.25μl,上游特异性 PCR引物0.5μl,下游特异性 PCR引物0.5μl。Total 40μl/Sample。将PCR反应液加入到反转录反应结束后的PCR反应管中,轻轻混匀。按以下条件进行PCR 反应:94℃ 2min 1cycle,94℃ 30sec,50℃ ~ 65℃ 30sec,72℃ 1min,35 cycles。退火温度根据引物来设定。反应结束后,取PCR反应液(5-10μl)进行琼脂糖凝胶电泳,确认PCR反应产物。如果此PCR产物需用于以后实验,须将PCR产物冷冻保存。
PCR产物电泳:取5μl的PCR产物,加入4μl上样缓冲液,于1.8%琼脂糖凝胶,130伏电压下进行电泳。电泳30min后,用EB染色5min,在紫外灯下用电泳凝胶成像分析系统观察拍照。用Scion Image进行图像光密度扫描和分析。各指标mRNA的量用各自的PCR产物量分别与内参GAPDH的PCR产物量的比值来表示。
1.2.4 数理统计法 所获数据用SPSS 10.0数据软件包进行处理,采用平均数±标准差(±s)表示,组间采用单因素方差分析判断总体显著性差异(P<0.05和P<0.01)。
2 实验结果
2.1 辽东楤木根皮醇提取物和人参茎叶总皂苷对6周递增负荷游泳训练后各组大鼠的一般观察及血、尿生化指标变化
前三周各组大鼠状态无差异。从第四周开始,运动对照组大鼠状态明显不如其他三组大鼠,表现为运动能力下降:运动中出现力竭的大鼠数量比服药组的多,需要休息的时间也长,游后精疲力竭、喘息不止、很长时间才能弄干身上的毛;运动后运动对照组大鼠掉毛现象严重,有的甚至是整块掉毛、毛色晦暗、体型瘦弱、神态疲惫、易受惊吓。而服药组大鼠掉毛现象不明显,毛色光亮,无明显的疲惫神态,游泳后很快能弄干身上的毛。

表4 6周递增负荷游泳后各组大鼠血睾酮、皮质酮、睾酮/皮质酮值(ng/ml)

表5 6周递增负荷游泳后各组大鼠血尿素氮、尿蛋白和血红蛋白值
2.2 辽东楤木根皮醇提取物和人参茎叶总皂苷对过度训练大鼠海马BDGF(脑源生长因子),NGF(神经生长因子)mRNA表达的影响

表6 各组大鼠海马BDGF、NGF mRNA表达的变化
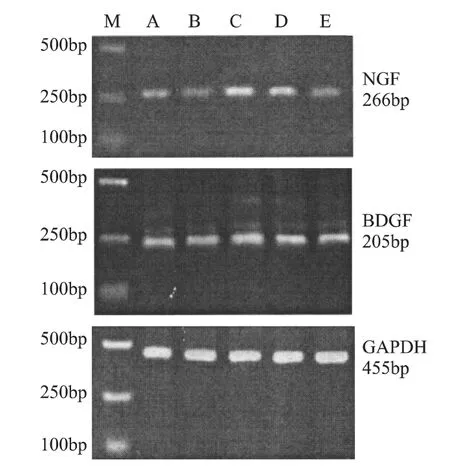
图1 海马NGF、BDGF的mRNA表达图谱
3 讨论
3.1 过度训练及过度疲劳训练模型的建立
有学者认为过度训练即训练和恢复、运动与运动能力、应激与应激耐受力之间的失衡状态。过度训练所表现的各种症状称为过度训练症候群(overtraining syndrome,OTS)。其呈现高度的个体化特点,不同运动员之间的差别很大。根据不同运动员过度训练的表现可分为交感型过度训练症候群和副交感型过度训练症候群。
在本实验中发现运动组大鼠经过6周递增负荷游泳后,普遍出现毛色等一般状况恶化和运动能力下降。末次运动24h后血尿生化检查表明:运动组大鼠T、T/C比值和Hb较正常组分别下降73.94%,86.97%和20.14%,C较正常组升高97.73%,分别超过30%、30%、20%和20%的人类过度训练诊断参考标准。同时,运动组大鼠BUN和TP较正常组分别升高107.19%和202.69%。根据上述一般情况观察和血尿生化检查结果综合评定,结合朱全、郑陆等提出大鼠过度训练判断标准,以及冯炜权教授根据运动员在过度训练后血液和尿液中生化指标的变化提出了诊断过度训练的参考值,这些指标反映了机体的代谢状况和运动能力,如血睾酮、血睾酮/皮质酮及血尿素氮反映了机体的代谢情况进行判定,大鼠经过6周递增负荷训练已经达到过度训练状态。
3.2 辽东楤木根皮醇提取物和人参茎叶总皂苷对过度训练大鼠海马BDGF,NGF mRNA表达的影响
脑源生长因子(brain derived growth factor,BDGF)是具有防止神经元死亡功能的一种蛋白质,是神经营养因子(NT)家族的一员,是一种对中枢和外周神经系统有营养活性的小分子多肽或蛋白质。一些研究表明,运动对中枢或外周神经BDGF表达有一定影响。
研究发现,数天的自主性转轮运动均能使海马神经元的BDGFmRNA和TrkB受体表达明显增强,但并不能引起皮层BDGFmRNA和蛋白表达的变化。Farmer J等人研究显示,大鼠短期的自主性转轮运动能使齿状回神经元BDGFmRNA和谷氨酸受体mRNA表达增加。Russo-Neustadtp研究大鼠强迫游泳2d,使海马的 BDGFmRNA的表达受到抑制。Gold等研究发现,30min的急性运动可明显提高肌肉萎缩硬化病人的BDGF表达水平。BDGFmRNA的表达与跑步距离呈正相关。
Paul等研究发现,3~4周的跑轮运动能增加大鼠海马与皮层BDGFmRNA和蛋白的表达。Emery等学者认为,长时间运动能增强BDGF表达,并能改善情绪和增强应变能力,防止随年龄增长而导致的人和大鼠认知功能的降低。也有国外学者发现,长期有氧游泳运动能增加大鼠海马和齿状回BDGFmRNA表达,一般运动2天后通过原位杂交技术便能检测到,可维持20天,但BDGFmRNA在青年鼠和老年鼠海马表达区域不同,青年鼠主要表达在CA3、CA4,而老年鼠则在CA1、CA2,可能是运动对海马的刺激随着年龄增长海马生理功能发生了迁移。
由于BDGF可促进胆碱能神经元、脊神经节、结状神经节神经元和发育中的黑质或纹状体内γ-氨基丁酸能神经元的存活,而有氧运动可增强BDGFmRNA和蛋白表达,推测有氧运动在促进神经元的存活方面具有一定的积极作用。
BDGF主要由皮层、海马和纹状体等区域的神经细胞分泌,一种对神经有广泛性营养作用的碱性蛋白。能够改变神经元的形态、维持多类神经元的存活、促进树突和轴突的生长。
已有研究发现,机体在各种应激作用后可引起神经细胞排列层次破坏,分布散乱稀疏,树突萎缩、且与邻周细胞脱离,细胞形态改变、内质网扩张、线粒体肿胀、中枢神经元脆弱性增加及细胞数量明显减少,尤其是海马CA3区神经元变化较为明显。
乔德才等报道,运动疲劳引起大鼠海马和纹状体BDGF和胶质纤维酸性蛋白(GFAP)表达水平上调,认为BDGF与GFAP参与了运动疲劳产生的神经生物学调控过程。BDGF的高表达可能是机体在大运动量训练时避免神经元过度损伤的一种自我保护性反应。
通常海马神经元 BDGFmRNA的表达由谷氨酸Glu和GABA调控,Glu的非NMDA受体参与介导海马区神经元BDGF表达与释放的调节,且BDGF受体TrkBmRNA与谷氨酸脱羧酶共存。高Glu的存在可诱导存活神经元BDGF的高表达,从而促进损伤神经元的修复与再生。
有学者实验证实,在应激前及应激早期经海CA3区给予BDGF,改善了因应激引起的海马神经元组织学变化,可见BDGF对应激引起的神经元损伤具有营养和保护作用。
满君等人实验发现,过度运动导致海马神经元的形态改变。光镜下可观察到海马神经元排列松散、紊乱,与周围神经元的联络减少,部分细胞固缩、呈不规则形状变化。电镜下可见细胞核偏位,细胞核内陷,染色质聚集,线粒体肿胀且出现空泡,轴突出现空泡。
高颀等发现,6周递增负荷游泳运动使海马神经元BDGF的表达发生变化,主要表现为形态改变神经元BDGF表达增加,提示过度运动可导致海马神经元的损伤,机体通过BDGF的表达增加来抵抗长期大运动量的训练导致的神经元损伤,是一种自我保护反应。
Sunanda报道每天6h,共21天束缚应激使海马CA3神经元萎缩。有学者在对分别经过1天、7天、7天以上过度运动的大鼠研究中,发现7天以上疲劳运动组海马神经元BDGF表达增高,且表达量与疲劳程度有关。
慢性应激引起海马细胞损伤的确切机制目前尚不清楚。已有报道提示,应激引起神经元损伤可能与慢性应激使糖皮质激素的基础值维持在高水平以及应激时脑内谷氨酸水平显著升高有关。
脑源性神经营养因子(BDGF)是一种主要由脑组织合成、能够维持中枢神经系统多种神经元存活及促进神经纤维生长的碱性蛋白。大脑皮质、海马及纹状体为 BDGF的主要分布区域。BDGF能提高神经元的生物活性,减少损伤后神经元的自然死亡。BDGF不但对多种神经元的发育分化和生长再生具有维持和促进作用,也能通过为损伤神经元提供营养而挽救中枢神经系统损伤的神经元。以上研究表明,过度运动使海马神经元BDGF的表达发生变化,主要表现为形态改变的海马神经元的BDGF表达增加。
有关运动影响BDGFmRNA基因表达机制的报道较少,一些BDGF研究表明,神经系统的BDGFmRNA表达受控于cAMP反应元件结合蛋白依赖的机制。有学者报道,运动使大鼠海马磷酸化CREB增加,而CREB调节转录的活性主要是受cAMP通道和钙离子通道两大信使系统中的蛋白激酶和(或)钙调蛋白激酶协同调控的,所以,运动对CREB活性的影响可能与这两种信号传导系统激活有关。
具有中枢神经系统营养因子作用的神经生长因子能促进受损神经元的再生,使神经元的病理状态得到改善。
一些研究表明,NGF能保护培养大鼠海马及皮层神经元免受缺氧、缺糖、谷氨酸毒性和氧化损害。NGF通过增加过氧化氢酶和超氧化物歧化酶等自由基清除剂的活性,对减轻神经元损伤有重要作用。
兴奋性氨基酸(excitatory amino acics,EAA)可引起一系列的变化导致神经元坏死和凋亡。而NGF对谷氨酸引起的海马神经元钙离子浓度的升高和神经元的坏死有明显的抑制作用。
越来越多证据表明,NGF可以防止和抑制细胞内Ca2+浓度的升高。NGF缺乏可诱导神经细胞凋亡。神经生长因子对神经元的保护作用可能部分是通过抑制神经元发生凋亡的过程来实现的。
我们的研究发现,过度训练组海马NGF mRNA表达下降,而BDGF mRNA表达显著增加(P<0.05),提示过度训练对海马神经元造成损伤,作为调节发育过程神经元的存活,阻止成年神经元损伤后神经元的死亡,改善神经元的病理状态的特异蛋白质NGF mRNA表达下降,导致对海马神经元的保护作用下降,可能会引起神经元凋亡或损伤加重,进而导致HPA轴过分激活,负反馈条件受到抑制;BDGFmRNA表达增加可能是机体避免神经元过度受损的一种保护性反应。人参提取物和低剂量辽东楤木提取物可以显著地改善神经元受损状况,对其的保护作用增强,可能与其提高抗氧化酶活性,提高海马组织抗氧化能力有关。
神经营养因子可有效延缓由于靶细胞损伤而引起的神经元立即死亡,在损伤后可维持一定数量的神经元的存活。
可见,在运动应激中,HPA轴和HPG轴相互作用,相互制约,共同参与机体的整体调节,这是为什么出现运动性高皮质醇,低血睾酮血症的原因所在。所以,长时间大强度、大运动量训练经常会出现运动性高皮质醇血症、运动性免疫抑制导致上呼吸道感染,女运动员出现运动性闭经以及运动性低血睾酮血症和运动性贫血和运动性蛋白尿等运动性疾病。而辽东楤木根皮醇提取物和人参茎叶总皂苷对过度训练(慢性应激)的发生、发展有一定的预防作用。为提高运动员运动负荷的适应,加快机体的恢复,避免出现过度疲劳综合症的发生具有重要的理论依据。
4 结论
过度训练组海马NGF mRNA表达下降,而BDGF mRNA表达均显著增加,提示过度训练可对海马神经元造成损伤,NGF mRNA表达下降,可引起海马神经元的保护作用下降,可能会导致神经元凋亡或损伤加重,进而导致HPA轴过分激活,负反馈条件受到抑制;BDGFmRNA表达增加可能是机体避免神经元过度受损的一种保护性反应。
[1] 田 野.运动生理学高级教程 (研究生教学用书)[M].北京:高等教育出版社,2003.
[2] 朱 全,浦钧宗,张 敏.游泳方法建立大鼠模拟过度训练模型[J].中国运动医学杂志,1998(2):137-140.
[3] 朱 全,浦钧宗.大鼠游泳训练在运动实验中的应用方法[J].中国运动医学杂志,1996(2):125-130.
[4] 冯炜权.运动疲劳及过度训练的生化诊断—运动生物化学动态三[J].北京体育大学学报,2000,23(4):498-502.
[5] 李 玲.脑源性神经营养因子与脑缺血缺氧的研究进展[J].国外医学儿科学分册,2001,28(3):155-157
[6] Vaynman S,Ying Z,Gomezpinilla F.Interplay between brainderived neurotrophic factor and signal transduction modulators in theregulation of the effects of exercise on synaptic plasticity[J].Neuroscienc,2003,122(3):647-657.
[7] 侯莉娟,刘晓莉,乔德才.大鼠游泳运动疲劳模型建立的研究[J].实验动物科学与管理,2005,22(1):1- 3.
[8] Paul A A.,Victoria MP,Christieen GC,et al.The Time-course of induction of brain-derived neurotrophic factor mRNA and protein in the rat hippocampus following voluntary exercise[J].Neuroscience,2004,124:71-79.
[9] Chen H,Chen H F,Huang A M,et al.Exercise upregulated rat hippocampal brain inderived neruotrophic factor in a time and intensity-dependent manner[J].FASEB J,2005,19(4):2331-2338.
[10] 乔德才,侯莉娟.运动疲劳对大鼠海马和纹状体BDGF、GFAP蛋白表达的诱导作用[J].北京体育大学学报,2007,30(6):781-783.
[11] 满 君,田 野,高 颀.过度运动对海马神经元形态及脑源性神经营养因子表达的影响[J].中国运动医学杂志,2004,23(5):510-512.
[12] 姜晓丹.脑源性神经营养因子与中枢神经修复再生[J].临床神经病杂志,2000,13(4):254-255.
[13] Berchtold NC,Kesslak J P,Cotman CW.Hippocampal brain derived neurotrophic factor gene regulation by exercise and the medial septum[J].J Neurosci es,2002,68(5):511-521.
[14] Raivich G,Hellweg R,K reutzberg GW.NGF receptor mediated reduction in axonal NFG uptake and retrograde transport following sciatic nerve injury and during regeneration[J].Neuron,1991,7(2):151.
[15] Vellucci SV,Parrott RF,Mimmack ML.Down-regulation of BDGF m RNA,with no effect on trkB or glucocorticoid receptor m RNA,in the porcine hippocampus after acute dexamethasone treatment[J].Res Vet Sci,2001,70:157-163.
[16] 黄 涛,徐 波,杨毅飞,等.介导运动对脑高级功能—学习记忆能力的促进作用[J].体育科学,2006,26(9):822-825.
[17] 余瑞元,王燕峰,徐长法.CREB研究进展[J].中国生物工程杂志,2003,23(1):39-42.
[18] Djeda SR,Hill DF,Katz KH,et al.The genes encoding nerve growth factor and its receptor are expressed in the developing female rat hypothalamus[J].Mol Brain Res,1991(9):47- 55.
[19] Taku S,Tatsuo M,Kintomo T,et al.Amelioration of delayed neuronal death in the hippocampus by nerve growth factor[J].J Neurosci,1991,11:2914-2919.

