甲型H1N1流感病毒血凝素单克隆抗体轻链和重链可变区基因的巢式PCR扩增及序列分析
李慧瑾,李研,孙晶莹,高锦伟,赵向绒,封青,谭天天,胡巧侠,李元,胡军
陕西省人民医院 中心实验室,陕西 西安 710068
新型甲型H1N1流感是一种由人、猪、禽三源重组的新型病毒株引起的急性呼吸道传染性疾病,具有人群普遍易感、发病快、传播蔓延迅速、并发症严重等特点[1-4]。甲型H1N1流感已给全球人类的健康和经济发展带来了较大的负面影响。接种甲流疫苗是预防甲流大流行的有效手段之一,但接种疫苗后少数不良事件的发生,仍使人们对疫苗的安全性产生了质疑[5-8]。目前接种的甲流疫苗主要成分为甲型H1N1流感病毒血凝素蛋白。如果能对甲型流感病毒血凝素蛋白结构进行深入研究,对分析抗原决定簇的氨基酸位点、后续甲流疫苗的改造及提高甲流疫苗的安全性具有重要意义。我们针对甲型H1N1流感病毒血凝素单克隆抗体,应用巢式PCR方法,从分泌流感抗体的杂交瘤细胞中扩增抗体的轻链和重链可变区基因并进行测序,为下一步分析抗体与抗原的结合靶位提供基础及实验依据。
1 材料与方法
1.1 材料
大肠杆菌DH5α菌株由本实验室保存;6株甲型H1N1流感病毒血凝素单克隆抗体A1-6、A1-8、A1-12、H1-4、H1-13和H1-28由本实验室制备,抗体轻链亚型均为κ链;总RNA提取试剂盒、逆转录试剂盒、质粒提取试剂盒和DNA凝胶回收试剂盒购自北京天根生物公司;ExTaq聚合酶、rTaq聚合酶、限制性内切酶、pMD19-T载体、DNA marker购自大连TaKaRa公司;IPTG、X-Gal、氨苄西林购自 Sigma公司;Fluor Chem FC2凝胶成像系统购自Alpha Inno⁃tech公司;引物合成和测序由北京六合华大基因科技股份有限公司完成。
1.2 总RNA的提取制备及cDNA的合成
将分泌上述抗体的杂交瘤细胞株进行培养,收集生长状态良好的杂交瘤细胞,细胞数约为1×106/mL。提取总RNA,以提取的RNA为模板,用天根公司的cDNA第一链试剂盒合成cDNA。
1.3 抗体轻链和重链可变区基因的引物设计
比对鼠抗体Kabat数据库中所有小鼠免疫球蛋白κ轻链和重链可变区核苷酸序列,针对6个家族的轻链,设计扩增轻链可变区(VL)的扩增引物共7对,上游从FWR1区起始,设计P1~P7,下游至FWR4区,设计通用引物P8。根据5个家族的重链基因,设计扩增重链可变区(VH)的引物5对,上游引物始于FWR1区,分别为P9~P13,下游至FWR4区,设计引物P14。扩增引物序列及家族分类见表1。设计轻链鉴定引物 5对,分别为 P1-P15、P2-P16、P3-17、P4-17、P5-P18、P7-P19,上游从FWR1区起始,下游至FWR3区的第55~63位氨基酸残基。轻链鉴定引物的家族分类及序列见表2。设计重链鉴定引物5对 ,分 别 为 P20-P14、P21-P14、P22-14、P23-14、P24-P14,上游从FWR3区第66~72位氨基酸残基起始,下游至FWR4区。重链鉴定引物的家族分类及序列见表3。
1.4 抗体轻链和重链可变区基因的克隆
以提取的cDNA为模板,用设计的兼并引物P1~P8扩增抗体的轻链可变区基因,用P9~P14扩增重链可变区基因。轻链和重链可变区基因PCR反应体系和扩增条件一致。PCR体系包括10×Ex缓冲液(添加Mg2+)2.5 μL,dNTP(各 2.5 μmol/L)2 μL,上、下游引物(20 μmol/L)各 1 μL,ExTaq聚合酶 0.3 μL,cDNA 1 μL,蒸馏水 17.2 μL,总体积 25 μL。PCR 反应条件:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,共30个循环;72℃ 10 min。
用对应的鉴定引物,采用巢式PCR方法鉴定PCR扩增的轻链可变区基因(轻链鉴定阳性目的条带约180 bp,重链鉴定为阳性的条带约150 bp),然后将PCR得到的轻链可变区基因和重链可变区基因片段胶回收,与pMD19-T载体连接,连接产物转化大肠杆菌DH5α感受态细胞,挑取6~8个克隆进行菌液PCR及提质粒酶切鉴定。
1.5 菌落PCR鉴定目的基因片段
PCR扩增目的条带(94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环,最后72℃延伸10 min),取10 μL反应液,以1.5 g/L琼脂糖凝胶电泳鉴定PCR产物。
1.6 DNA序列测定与分析
将鉴定阳性的克隆送北京华大基因公司进行序列测定。用DNAMAN和BLAST软件对测序结果进行比对分析。

表1 轻链和重链可变区基因扩增引物

表2 轻链可变区基因鉴定引物

表3 重链可变区基因鉴定引物
2 结果
2.1 抗体轻链和重链可变区基因的克隆
分别以RT-PCR合成的cDNA为模板,利用针对抗体轻链和重链可变区的12对引物,对6株抗体进行PCR扩增,最终成功地从各分泌杂交瘤的细胞系中扩增出目的基因。各抗体扩增成功对应的引物见表4。扩增产物经1.5%琼脂糖凝胶电泳鉴定,结果如图1所示,VL基因约320 bp,VH基因约350 bp。
2.2 抗体VL和VH基因克隆及筛选
将抗体VL和VH基因分别克隆至pMD19-T载体,经菌落PCR及提取质粒后酶切鉴定,获得与目的片段大小对应的条带。
2.3 抗体VL和VH基因的序列分析
扩增的抗体轻链基因各选择4~6个阳性克隆、重链基因各选3~4个阳性克隆测序,将测序结果与NCBI BLAST Ig数据库比对分析,结果表明6株抗体的轻链和重链可变区基因均符合小鼠免疫球蛋白可变区基因特征。以A1-12序列为例(图2),其VL基因全长339 bp,编码113个氨基酸残基;VH基因全长354 bp,编码118个氨基酸残基。轻链的第23和93位、重链的第21和94位分别为半胱氨酸,各形成一个链内二硫键,该组二硫键对抗体可变区形成立体结构起重要作用。图2中分别标出了抗体相应的FWR区和CDR区。进一步分析表明,A1-12VL和A1-12VH均属于第Ⅲ亚型。

表4 PCR扩增各抗体轻链和重链可变区引物
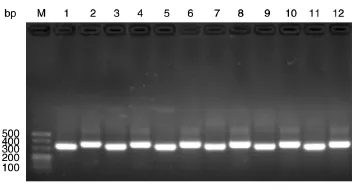
图1 6株抗体轻链和重链可变区基因的PCR产物
3 讨论
抗体基因的扩增方法有多种,关键是引物设计,如基于前导肽序列及J序列设计引物、按照基因家族分类针对保守序列设计家族性引物等[9]。我们将Kabat数据库中所有鼠免疫球蛋白κ轻链和重链可变区基因序列进行比对分析,根据基因家族分类并分析各家族的抗体序列的保守性,以FWR1和FWR4保守序列为基础,针对6个家族的轻链可变区基因设计12对引物,针对5个家族的重链可变区基因设计10对引物。实验结果表明,用12对扩增引物从6株特异性杂交瘤细胞中扩增抗体基因均能得到很好的结果。我们还用该组引物克隆到多株其他鼠源性单克隆抗体的轻链和重链可变区基因。因此,该组引物可作为鼠源性单克隆抗体轻链和重链可变区基因PCR扩增的通用引物,使有些单克隆抗体基因,尤其是轻链可变区基因克隆难的问题得以解决。

图2 A1-12抗体的轻链和重链可变区基因序列
根据克隆选择学说,带有各种受体的免疫活性细胞克隆早已存在,抗原的作用只是选择并激活相应的克隆,也就是说,一种杂交瘤细胞只分泌一种特异的有功能性的单克隆抗体。我们以细胞总RNA反转录的cDNA为模板,PCR扩增获得特异性的VL和VH基因片段。在VL基因扩增时,虽然均扩增出特异条带,但部分基因的条带大小和目的片段相同,而测序结果发现序列中位于FWR1区第23位的半胱氨酸突变为酪氨酸。有报道,将骨髓瘤细胞SP2/0总RNA提取后反转录为cDNA,用不同引物扩增轻链可变区基因,获得的轻链可变区基因序列只有1个半胱氨酸,无法由链内二硫键连接形成可变区的立体结构[10]。本实验为避免轻链PCR获得大量的假基因,针对各家族设计了相应引物,对PCR获得的可变区基因再用鉴定引物进行PCR鉴定,此种巢式PCR方法可减少扩增轻链假基因的比例。
研究表明,接种甲流疫苗是有效的[5-6],可以增强易感人群的免疫力,从而形成预防甲流的有效免疫屏障,但仍有疫苗安全性的质疑。在本研究中,我们克隆出6株甲型H1N1流感血凝素单克隆抗体的轻链和重链可变区基因,为后期流感病毒抗原与抗体结合位点的分析、疫苗的安全性分析,以及表达人源性基因工程抗体提供了实验数据。
[1]Michaelis M,Doerr H W,Cinatl J Jr.Novel swine-origin in⁃fluenza A virus in humans:another pandemic knocking at the door[J].Med Microbial Immunol,2009,198(3):175-183.
[2]Hauge S H,Dudman S G,Borgen K,et al.Disease caused by the new influenza A(H1N1)virus[J].Tidsskr Nor Laegefo⁃ren,2009,129(17):1736-1739.
[3]Naffakh N,van derWerfS.April2009:an outbreak of swine-origin influenza A(H1N1)virus with evidence for hu⁃man-to-human transmission[J].Microbe Infect,2009,11(8-9):25-28.
[4]PeirisJS,Poon L L,Guan Y.Emergence ofa novel swine-origin influenzaA virus(S-OIV)H1N1 virusin hu⁃mans[J].J Clin Virol,2009,45(3):169-173.
[5]Wu J,Xu F,Lu L,et al.Safety and effectiveness of a 2009 H1N1 vaccine in Beijing[J].N Engl J Med,2010,363(25):2416-2423.
[6]Baras B,de Waal L,Stittelaar K J,et al.Pandemic H1N1 vaccine requires the use of an adjuvant to protect against challenge in naïve ferrets[J].Vaccine,2011,29(11):2120-2126.
[7]Greenberg M E,Lai M H,Hartel G F,et al.Response to a monovalent 2009 influenza A(H1N1)vaccine[J].N Engl J Med,2009,361(25):2405-2413.
[8]Greenberg M E,Lai M H,Hartel G F,et al.Adverse events following influenza A(H1N1)2009 monovalent vaccines report⁃ed to the vaccine adverse eventsreporting system,United States,October 1,2009-January 31,2010[J].Vaccine,2010,28(45):7248-7255.
[9]刘喜富,萧飒,顾征,等.抗人CD3单抗轻、重链可变区基因的克隆及序列分析[J].生物工程学报,1996,12:116-120.
[10]李妍妍,杨笛,卞智萍,等.鼠抗人cTnI单克隆抗体Fab段基因克隆和序列分析[J].第四军医大学学报,2008,29(9):785-787.

