左旋肉碱的合成与应用
向忠权,蒲国荣,韦志明,孙果宋,陈小鹏
(1.广西大学化学化工学院,广西 南宁 530004;2.广西化工研究院,广西 南宁 530001)
左旋肉碱也叫左旋肉毒碱﹑左卡尼汀,是一种营养﹑医药型精细化学品,极易吸潮。左旋肉碱的营养价值和医用价值以及良好的市场前景,吸引了世界各国科学家对其进行广泛和深入的研究。1905 年,俄国化学家Gulewitsch 和Krimberg 在肉浸汁中发现肉碱;1927 年,Tomi 和Sendju 确定其化学结构为L-3-羟基 -4-三甲铵基丁酸;1947 年,Fraenkel 用炭分离酵母液时发现一种能影响昆虫生长的化学物质,并命名为维生素Bt;1952 年,美国伊利洛斯州立大学的Carter 等人确证维生素Bt 即是左旋肉碱。1953 年Fritz 发现左旋肉碱能加速细胞对脂肪的消耗作用。1958 年芝加哥国际营养会议将其划为特定条件下必需的营养素。20 世纪80 年代肉碱开始作为商品在国外上市,由于右旋肉碱的毒副作用,1993 年起美国FDA 禁止销售右旋肉碱和混旋肉碱。1996 年我国第16 次食品添加剂标准化技术委员会通过决议,允许饮料﹑乳饮料﹑饼干和固体饮料中添加左旋肉碱[1]。2010 年3 月16 日中华人民共和国卫生部发布年第4 号公告,批准左旋肉碱为扩大使用范围及使用量的食品营养强化剂[2]。
目前世界上只有瑞士﹑意大利﹑日本等为左旋肉碱的主要生产国。我国大部分L-肉碱需求还是依靠进口,价格昂贵,亟待研发新进展,以填补国内空白。因此,不断开发低成本﹑高合成率﹑易于实现工业化生产的左旋肉碱合成新路线,显得尤为重要。
左旋肉碱的制备方法很多,其制备可通过从动物肉浸膏中提取﹑生物合成和化学合成等方法。提取法产量低,纯化步骤多,成本高且难以形成规模化生产。化学合成法主要采取2 种途径[3]:(1)先制取出外消旋肉碱,利用拆分剂析出左旋体;(2)以不同的化学物质为原料进行合成。生物合成法制备左旋肉碱主要有两种方法,一是微生物发酵法,二是利用酶法转化。本文综述近10 年来专利文献所介绍的左旋肉碱合成方法,并对左旋肉碱的应用做简要介绍。
1 左旋肉碱的合成
1.1 消旋体拆分法
早期化学合成的肉碱是外消旋体,是以环氧氯丙烷为原料,经过氨化﹑酸化﹑氰化﹑水解及去离子化得到的[4](图1)。

图1 环氧氯丙烷制混旋肉碱Fig.1 epichlorohydrin Preparation DL-carnitine
后来发现右旋肉碱会对肉碱乙酰转移酶和肉碱脂肪酰转移酶有竞争性抑制作用,研究人员开始采用消旋体拆分法制备左旋肉碱。Lorenz 等[5]用D-(+)-樟脑磺酸﹑二苯甲酰-D-酒石酸对DL-肉碱进行拆分,Takenaka 等[6]利用(-)-扁桃酸,Iannella, V.等[7]与Kikuchi 等[8]利用二苯甲酰-L-酒石酸对外消旋体4进行拆分制得左旋肉碱。为解决拆分后剩余的右旋体的利用问题,王从敏等[9]开发出一条以右旋肉碱为原料制左旋肉碱的工艺路线,在10%~20%的盐酸环境中,以二苯甲酰-L-酒石酸为催化剂,在乙醇﹑丙醇等极性溶剂中制取混旋肉碱,肉碱的收率达90%以上。胥波等[10]则将拆分出的右旋肉碱先氧化再还原得到拆分前体,进行回收套用(图2)。
Tsuyoshi 等[11]利用D-樟脑磺酸对外消旋体3 进行拆分,得到的左旋体经水解﹑去离子化制取左旋肉碱,陈志卫等[12]则将拆分出 3 的左旋体用过氧化氢水解,后经中和,安伯莱特(Amberlite)阴离子交换树脂交换,浓缩,重结晶,得到收率高于70%的左旋肉碱产品。
为提高原子的经济性,Gianness F 等[13]开发出一条工艺路线,将外消旋体3 拆分得到的右旋体经几步转化后制得左旋肉碱(图3)。
张红素[14]采用D-(+)-酒石酸对2 的外消旋体进行拆分,Voeffray R 等采用L-(+)-酒石酸对2 的外消旋体进行拆分,再经氰化﹑水解等步骤进一步制得左旋肉碱。
Schaus S.E.等[15]发现(S)-salen-Co 催化剂能将外消旋化的环氧氯丙烷水解成左旋环氧氯丙烷,ee值达97%,产率为44%。沈大东等[16]开发出手性salen-Co Ⅲ为催化剂,水解动力学拆分外消旋环氧氯丙烷,得到高光学纯度的(S)-(+)-环氧氯丙烷,再经季胺化﹑氰化﹑水解及离子交换制得L-(-)-肉碱,总收率达70%[以(S)-(+)-环氧氯丙烷计]。顾书华等[17]通过严格控制反应过程中各步骤的杂质含量,使生产出的左旋肉碱ee 值达97%以上。目前工业上主要采用这一方法制取左旋肉碱(图4)。此外,国内外有多个研究小组对salen 催化剂进行了广泛和深入研究[18],开发出单核salen 催化剂[19],双核和聚合salen 催化剂[20],负载型salen 催化剂,使合成左旋环氧氯丙烷的产率达45%,ee 值达99%。其中,单核salen 催化剂已工业化生产。Salen Co Ⅲ催化剂价格昂贵,开发产率高﹑低成本的Salen 催化剂仍是今后研究的重点。
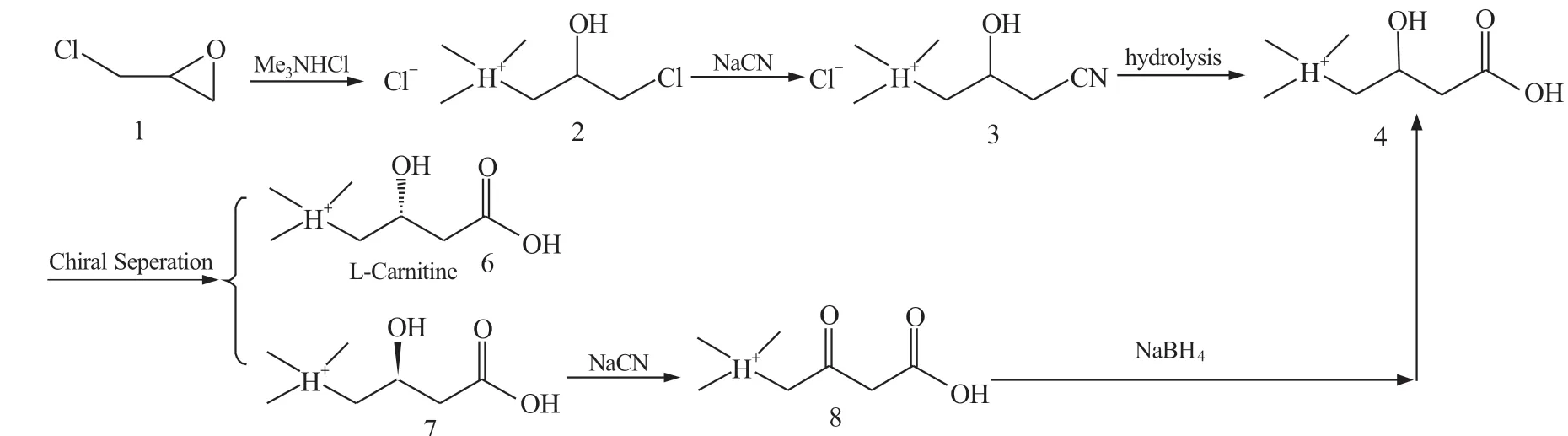
图2 氧化还原消旋法制备拆分前体Fig.2 Resolution precursor preparation by oxidationreduction racemization
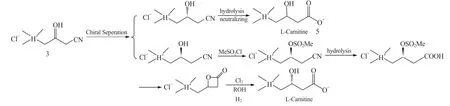
图3 右旋肉碱前体转化成左旋肉碱Fig.3 Precursor of D-carnitine conversion to L-cainitine
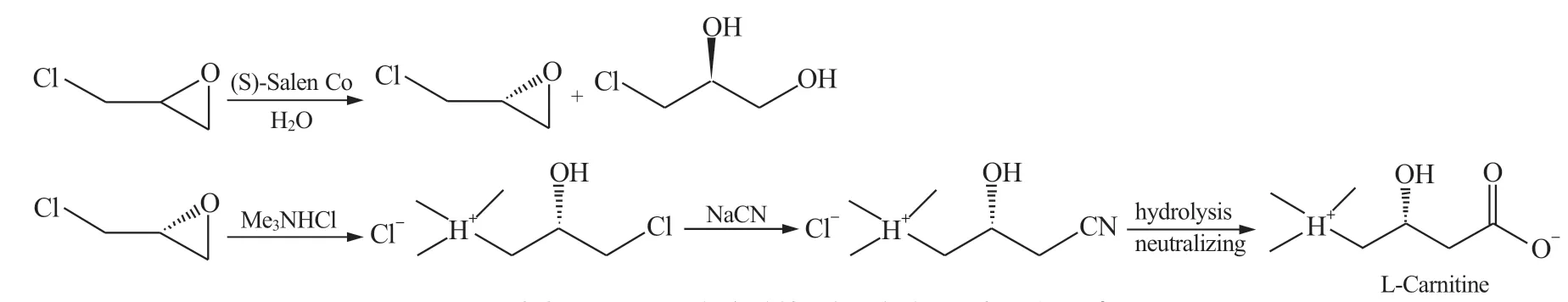
图4 (S)-Salen Co 催化剂拆分环氧氯丙烷制左旋肉碱Fig.4 (S)-Salen Co resolution epichlorohydrin Preparation L-carnitine
钱国庆等[21]对Salen Co 催化剂拆分环氧氯丙烷的副产物的急毒性进行研究发现,(R/S)-3-氯 -1,2-丙二醇对人可能会显示神经毒性,为解决此问题,杨云旭等[22]开发出一条以手性拆分外消旋环氧氯丙烷制取L-肉碱时的副产物(R)-(-)-氯代甘油为手性起始原料制取左旋肉碱的工艺,先使(R)-(-)-氯代甘油和亚硫酰氯反应,生成环状亚磺酸酯中间体;此环状中间体和KCN 或NaCN 发生开环反应,生成氯代丁基腈;氯代丁基腈在三甲胺溶液中反应,制得氰盐;氰盐在酸性溶液里水解,并经离子交换脱去氯离子,制得最终产物L-肉碱(图5)。
目前使用左旋环氧氯丙烷制备左旋肉碱的方法使用到有剧毒的氰化钠,在倡导发展绿色化学的今天,开发环境友好,原子经济性高的合成工艺是必要的。
此外,李全等[23]以氯乙酸乙酯为原料,经格氏化﹑还原﹑胺化﹑水解等步骤得到混旋肉碱,再用左旋二苯甲酰酒石酸为拆分剂拆分得到左旋肉碱(图6)。该工艺避免了氰化物的使用,但产品收率较低。
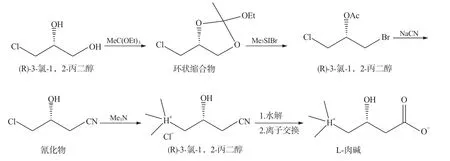
图5 (R)-(-)-氯代甘油制左旋肉碱Fig.5 (R)-3-chloro-1,2-propanediol Preparation L-carnitine

图6 氯乙酸乙酯制备左旋肉碱Fig.6 Ethyl chloroacetate Preparation L-carnitine
1.2 手性原料化学合成法
手性原料化学合成法主要采用自然界中存在并易获取的手性物质为原料,直接合成左旋肉碱。与拆分法相比,全过程原子经济性较高。
McCarthy J.R.等[24]以(S)-羟基-γ-丁内酯为原料,经两步反应即可制得左旋肉碱,ee 值达95%以上(图7)。(S)-羟基-γ-丁内酯可以乳糖﹑果糖等己糖为原料经分解酯化﹑官能团保护﹑酸化制得[25]。
Byun. I.S.等[26]在McCarthy. J.R.等所开发工艺的基础上,以(S)-3-羟基-γ-丁内酯为原料,经开环反应﹑手性中心反转的环氧化反应﹑三甲胺亲核取代反应制取左旋肉碱,经纯化后得左旋肉碱的收率为55%(图8)。该反应在水溶液中进行,各反应步骤中纯度和收率相对较高,中间产物无需纯化,可以在单釜中完成多步反应,原料易得,制备过程中避免了有毒物质的使用,是一条比较有工业化前景的路线。

图7 (S)-羟基-γ-丁内酯制左旋肉碱ⅠFig.7 (S)-3-hydroxybutyrolactone Preparation L-carnitineⅠ
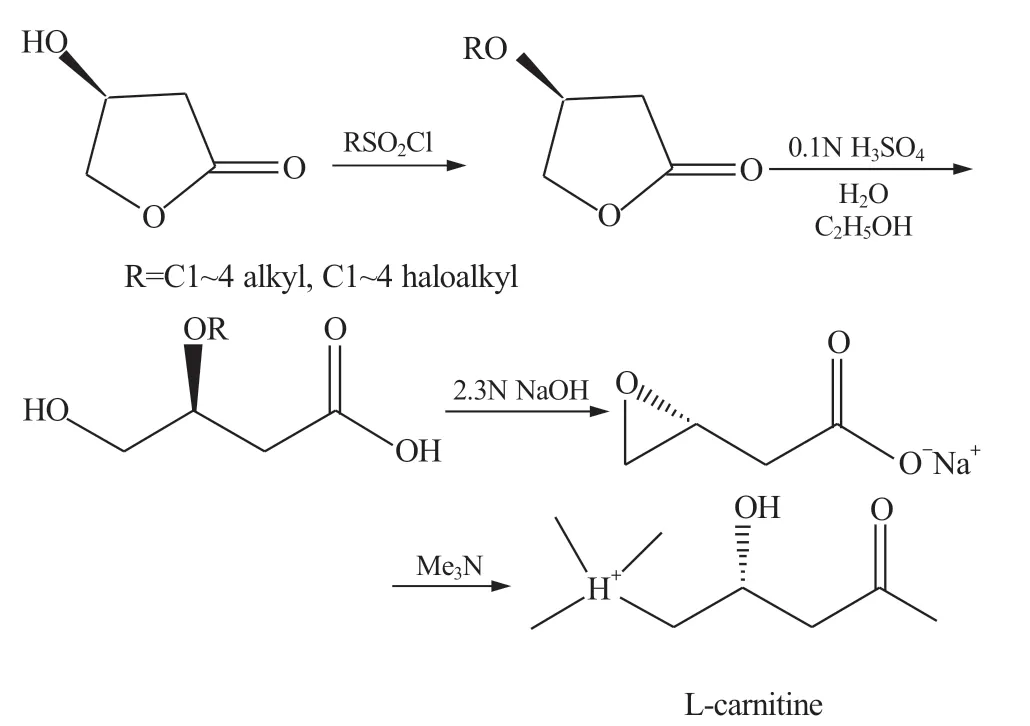
图8 (S)-羟基-γ-丁内酯制左旋肉碱ⅡFig.8 (S)-3-hydroxybutyrolactone Preparation L-carnitine Ⅱ
Fiorini M.等[27]使用D-甘露醇为原料,经9 步反应制得左旋肉碱,反应过程中使用到重金属四乙酰基铅,且反应步骤多,产品得率低,无工业化价值。
Bellamy.F.D 等[28]以苹果酸为原料,经6 步反应制得左旋肉碱(图9),收率为39%,光学纯度依赖于苹果酸的光学纯度。如能获得高光学纯度的L-苹果酸,并能提高收率,这也是一条可以考虑的路线。
1.3 不对称合成法
不对称合成直接将潜手性的物质转化成目标产物,避免了手性拆分,提高了原料的利用率。不对称合成法制左旋肉碱主要以4-氯 -3-羰基丁酸烷基酯或4-氯 -3-羰基丁酰胺为原料,不对称催化制取中间产物(R)-4-氯 -3-羟基丁酸烷基酯或4-氯 -3-羰基丁酰胺,再将(R)-4-氯 -3-羟基丁酸烷基酯或4-氯 -3-羰基丁酰胺经三甲胺化﹑酸化﹑水解等步骤制取左旋肉碱(图10)。
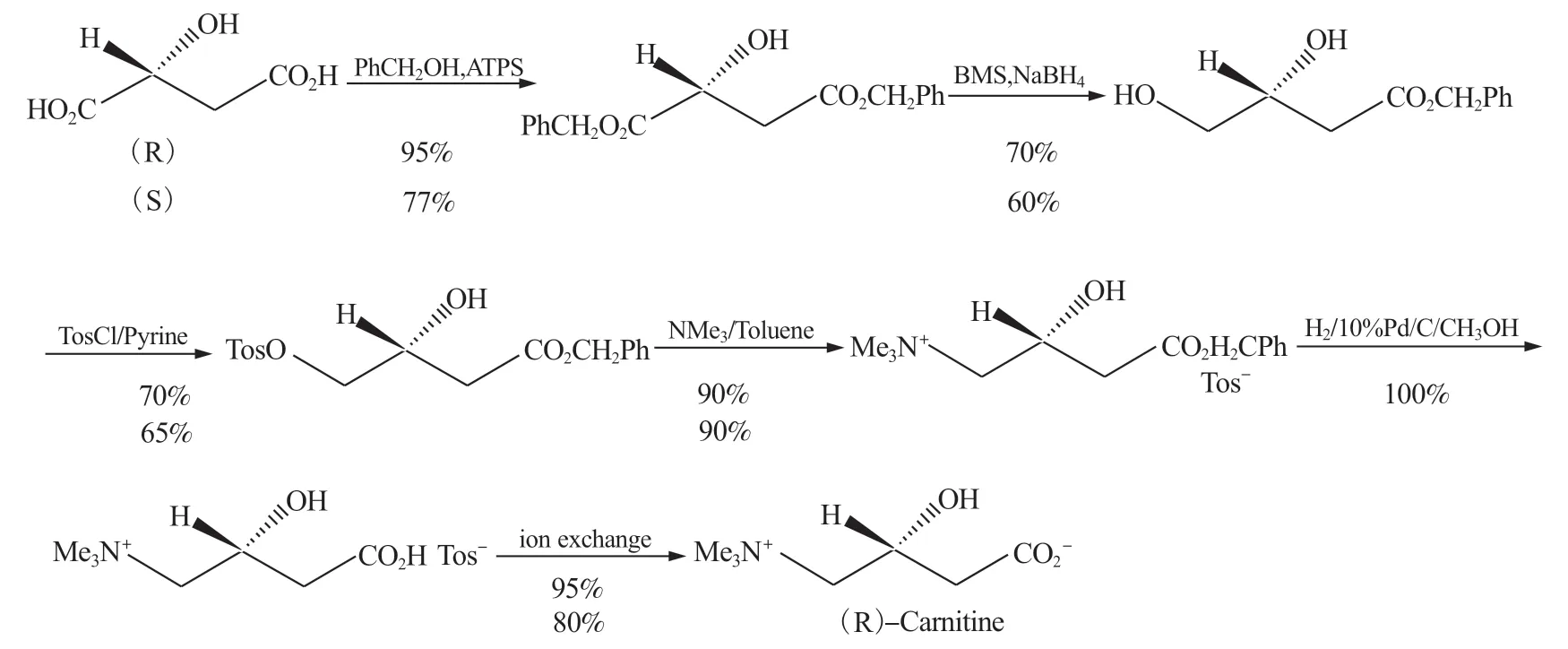
图9 苹果酸制左旋肉碱Fig.9 Malic acid Preparation L-carnitine

图10 不对称还原法制左旋肉碱ⅠFig.10 Asymmetric hydrogenation Preparation L-carnitine Ⅰ
Noyori R.等[29]开发了一系列高效的手性还原催化剂,开发出转化率和选择性均较高的反应路线,如以Ru(OCOCH3)2((-)-BINAP)为催化剂,在100℃,9.8MPa 下不对称催化还原4-氯 -3-羰基丁酸烷基酯,反应15min 即制得高光学活性高产率(ee 97%,产率97% )的中间体(R)-4-氯 -3-羟基丁酸乙酯,再将(R)-4-氯 -3-羟基丁酸乙酯经三甲胺胺化﹑酸化﹑纯化等步骤制得左旋肉碱,收率为46%。
针对该反应压力过高的情况,韦志明等[30]改进了工艺条件,采用[RuCl(cymene)(S-BIN-AP)Cl[氯代[(S)-(-)-2,2′-双(二苯基膦)-1,1′-联萘](p-伞花素)氯化钌(Ⅱ))]为催化剂,在1MPa 以下即可在短时间内获得中间体(R)-4-氯 -3-羟基丁酸乙酯,再经胺化﹑水解等步骤制得左旋肉碱。
丁迪M.O.等[31]使用自制的{[Ru(对-异丙苯)I(+)TMBTP]I}催化剂,0.5MPa 下催化底物4-氯 -3-羰基丁酸乙酯制取(R)-4-氯 -3-羟基丁酸乙酯,ee 值为97%,再将(R)-4-氯 -3-羟基丁酸乙酯在三甲胺水溶液中于80℃下密闭保持24h 制得左旋肉碱,经纯化后得左旋肉碱的产率为70%。
陈新滋等[32]则针对第二步反应时收率低的情况,改进工艺条件,在第二步反应时采用相转移﹑碱性催化剂和低温反应条件,将肉碱的收率提高到70%以上。
胡建荣[33]针对目前Ru 系催化剂较为昂贵的情况,使用较为便宜的L-酒石酸修饰Ni-B/SiO2作为催化剂,在1MPa 下催化底物氯乙酰乙酸乙酯制取(R)-4-氯 -3-羟基丁酸乙酯,再在氢氧化钠存在条件下,将(R)-4-氯 -3-羟基丁酸乙酯和三甲胺反应生成左旋肉碱,左旋肉碱收率达70%以上,ee 值为97%,降低了成本(图11)。
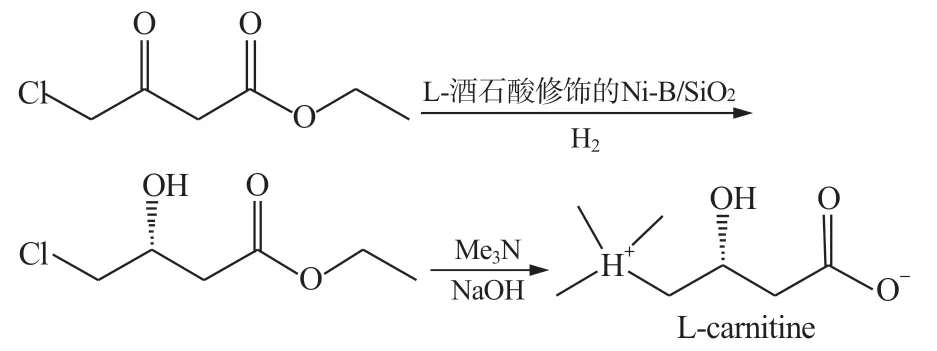
图11 不对称还原法制左旋肉碱ⅡFig.11 Asymmetric hydrogenation Preparation L-carnitine Ⅱ
1.4 酶转化法
酶转化法制取左旋肉碱主要有3 种方法:(1)DL-肉碱及其衍生物拆分法;(2)D-肉碱酶转化法;(3)巴豆甜菜碱酶转化法。这几种方法主要是以化学法合成的混旋肉碱或副产物D-肉碱为原料,通过筛选获得产酶菌株如变形杆菌﹑大肠杆菌﹑假单胞杆菌﹑霉菌﹑酵母菌等,再与底物一起培养转化生成左旋肉碱,是制备左旋肉碱的重要途径之一,其工艺路线如图12 所示。
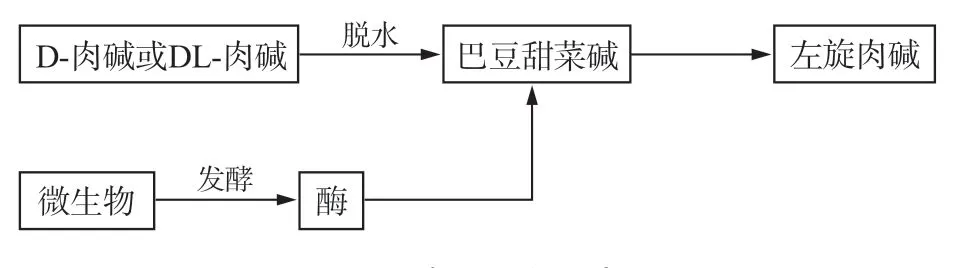
图12 酶法制左旋肉碱Fig.12 Enzymatic preparation of L-carnitine
多年来各国研究人员进行了大量的研究实验,报道了多种产酶菌株,如Proteus mirabilis AJ-2772[34]﹑DSM6230[35]﹑Escherichia coliK12S[36]﹑Pesudomonas YS-240[37]等,但都存在转化率低﹑巴豆甜菜碱与左旋肉碱分离困难等问题。近年来,研究人员在提高转化率,解决分离问题上取得了一定进展。
王强等[38]用巴豆甜菜碱和肉碱脱水酶催化,在含有[Bmim]PF6离子液体的水溶液中制备酰基-L-肉碱,后经水解合成左旋肉碱,收率高于70%。
陈群等[39]从土壤样品中分离得到一种假单胞杆菌,采用微波诱变的方法对其进行筛选得到高产酶菌株,再进行增殖培养,然后将菌株细胞微囊固定化后加入反应底物巴豆甜菜碱,在超声波辅助条件下进行酶解反应得到左旋肉碱,其转化率达80%。
克莱伯 H-P.等[40]在连续操作的细胞反应器中,通过固定化的大肠杆菌044K74 将巴豆甜菜碱及其衍生物转化为左旋肉碱,转化率达60%。
Thomas Elssner 等[41]获得一种γ-三甲基丁内铵辅酶A 和巴豆甜菜碱辅酶A,用于催化底物巴豆甜菜碱和右旋肉碱生产左旋肉碱。
孙志浩等[42]以大肠杆菌为出发株,经紫外线﹑Co-60 诱变得到不同化的左旋肉碱产酶菌株(CGMCC 0276),经诱导培养后离心收集菌体,以菌体游离细胞或固定化细胞为酶源,以巴豆甜菜碱为底物,酶转化制得左旋肉碱反应液,取反应清液经活性炭脱色,加热膜分离去除蛋白,滤液过阴离子交换柱,加亚硫酸盐去除巴豆甜菜碱,稀释后上阳离子交换柱层析,层析液真空浓缩,加异丁醇共沸回流,蒸发回收异丁醇,真空蒸发烘干得粗品,再经重结晶﹑脱色等纯化处理制得精品左旋肉碱内酯。
目前L-肉碱的生物合成尚处在研究阶段,未形成工业化生产。用微生物转化法生产的产量和底物转化率都相对较低。选育具有高转化能力的微生物菌株以转化较廉价的底物是今后生物法生产L-肉碱的发展方向。
1.5 基因重组法
基因重组法指通过基因重组技术获得具有高转化活性的微生物,并结合传统的发酵工艺来开发生产肉碱。
1995 年Knut D E 等[43]将大肠杆菌中caiD﹑caiE 基因克隆, 获得基因工程菌E.coli K38,它携带有质粒pT 7-5KE32,在该质粒的T7RNA 聚合酶启动子下游含有caiD﹑caiE 基因,该工程菌表达的肉碱消旋酶占细菌总蛋白的10%~15%,活性显著提高,用它来转化DL-肉碱或拆分后的废物D-肉碱,具有良好的效果。同年,Eichler 等[44]又将大肠杆菌中分别编码肉碱水解酶及未知因子的caiB 和caiE基因克隆,并用所获得的重组微生物来转化巴豆甜菜碱生产L-肉碱,效果也很好,很有前景。
2007 年李炳旭等[45]发现了一种属于肠杆菌科的微生物(保藏号KCCM-10638),其中包括编码来源于粗糙脉胞菌的N-三甲基赖氨酸羟化酶活性的多核苷酸,编码来源于粗糙脉胞菌的3-羟基-6-N-三甲基赖氨酸醛缩酶活性的多核苷酸,编码来源于粗糙脉胞菌的γ-三甲基氨基醛脱氢酶活性的多核苷酸和编码来源于粗糙脉胞菌的γ-丁酰甜菜碱羟化酶活性的多核苷酸。催化底物ε-N-三甲基赖氨酸,β-羟基-N-三甲基赖氨酸,γ-N-三甲基氨基丁醛,γ-丁酰甜菜碱及其混合物生成左旋肉碱。
目前将基因工程技术应用于L-肉碱生产的研究报道尚不多见。利用基因工程技术构建具有L-肉碱高转化率的工程菌,并用于L-肉碱的工业化生产,其前景看好。
2 左旋肉碱的应用
左旋肉碱是一种非常重要的营养素,其主要功能是以脂酰肉碱的形式将长链脂肪酸从线粒体膜外运送至膜内,从而促进脂肪酸的β-氧化,并调节线粒体内酰基CoA/疏基CoA 比率,且具有酰基化解毒作用。左旋肉碱同时也能有效降低运动后血中乳酸的浓度。正是这些特性使左旋肉碱在食品添加剂﹑饲料添加剂和药物方面有广泛应用。
2.1 作为食品添加剂
人体所需要的左旋肉碱有2 种来源,一是靠人体以赖氨酸﹑蛋氨酸为原料在肝中合成,另一来源是从食物摄取,尤其是肉类和乳制品。健康成人只要膳食合理,一般不需要补充左旋肉碱,而婴儿及患有左旋肉碱缺乏症的人需要额外补充左旋肉碱。
婴儿体内左旋肉碱的合成能力只有成人的15%,不能满足其正常的代谢需要,并且婴儿生长发育速度快,所需的左旋肉碱的量大,母乳中左旋肉碱的含量较高,一般情况下能满足婴儿生长发育的需要。但现在随着社会环境的变化,许多母亲由于各种原因不能母乳喂养婴儿,往往选用奶粉喂养婴儿,因此需在奶粉中加入适量的左旋肉碱[46]。
国内外的研究者还发现对运动员补充适量的左旋肉碱可以极大地提高运动员的最大耗氧量和运动时的能量输出,而且明显地减少二氧化碳的产生和血浆中乳酸的浓度。因此可在运动功能食品中加入适量的左旋肉碱[47]。
由于左旋肉碱具有促进脂类代谢和间接促进能量生成的作用,肥胖人员通过补充左旋肉碱,并辅以适当运动,会有较好的减肥效果[48]。所以左旋肉碱也是减肥健美食品添加剂。
临床表明左旋肉碱具有抗心肌缺血,抗心率失常,降血脂等作用[49],随着年龄的增大,体内的左旋肉碱不断减少,导致心肌细胞活力减退,故老年人需要补充左旋肉碱,可在老年保健食品中添加左旋肉碱。
2.2 作为饲料添加剂
研究表明左旋肉碱有促进生猪的生长[50],提高瘦肉率[51],提高鸡的产蛋率[52],加快鱼虾的生长速度[53]等作用。随着工厂化集约式养殖业的发展,必然要求畜禽高繁殖率及快速生长,常规饲料中的左旋肉碱含量往往不能满足新生哺乳幼畜﹑ 应激状况下的禽畜的需要,需额外在饲料中加入左旋肉碱,才能发挥其最大的生长潜能。
2.3 作为药物
左旋肉碱可用于治疗尿毒症贫血[54],缓解内毒素血症和保护肝功能[51],减轻CO 中毒后心肌损伤和横纹肌损伤[55],改善精子活力,提高配偶妊娠机率等[56]。
3 结语
左旋肉碱作为一种安全有效的营养素,可用于奶制品添加剂﹑运动功能食品添加剂﹑减肥保健食品添加剂﹑饲料添加剂,还可以用于治疗疾病,因此有着巨大的市场需求。开发环境友好的合成新技术,提高原料的利用率,提高产能,降低成本,是今后合成研究的重点。
[1] 张凤清,张丽君,周长民.左旋肉碱的制备方法[J].当代化工,2008,37(3):316-318.
[2] 姜琳琳,张慧苹.左旋肉碱的应用[J].赤峰学院学报 (自然科学版),2008(2):7.
[3] 虞斌,张海宏,赵利军.左旋肉碱的化学合成[J].化学工程师,2011,25(4):37-43.
[4] Wiegand K E. Carnitine nitrile halide preparation[P]. US 4070394, 1978-01-24.
[5] Lorenz I. Production of pure D-and L-carnitine[P]. US 3151149, 1964-09-29.
[6] Takenaka, Shigekazu. Production of L-(-) and D-(+)-carnitine[P]. JP 59231048A, 1984-12-25.
[7] Iannella V. Process for the preparation of L-carnitine hydrochloride of L-(-)-carnitine inner salt [P]. US 4933490, 1990-06-12.
[8] Kikuchi, Haruhiko, Kamifukuoka, et al. Verfahren zur Herstellung von L-Carnitin und Salzen davon [P]. DE 3536093, 1985-10-09.
[9] 王从敏,李浩然,马璐,等.肉碱的合成工艺[P]. CN 1634870A, 2005-07-06.
[10] 胥波,程国侯. R-卡尼丁的合成和改进[J].化学世界,2000(9):459-472.
[11] Tsuyoshi M, Masao K, Sellchi A, et al. production-of-opticallyactive-cyanocarnitine-salt[P]. JP 62286959, 1987-12-12.
[12] 陈志卫,苏为科,毕建豪,等.一种左旋肉碱的合成方法[P].CN 102020575A, 2011-04-20.
[13] Gianness F, Bolognesi M L, Tinti M O. Process for manufacturing L-(-)-Carnitine from a waste product having opposite configuratioin[P]. EP 0609643, 1996-07-24.
[14] 张红素. L-肉毒碱的合成与应用[J].贵州化工,2001,26(4):15-16.
[15] Schaus S E, Brandes B D, Larrow J F, et al. Highly selective hydrolytic kinetic resolution of terminal epoxides catalyzed by chiral (salen) CoIII complexes. Practical synthesis of enantioenriched terminal epoxides and 1, 2-diols[J]. Journal of the American Chemical Society,2002,124(7):1307-1315.
[16] 沈大冬,朱锦桃. L-(-)-肉碱的合成[J].中国医药工业杂志,2007,37(12):801-802.
[17] 顾书华,王学成,李庆宜.一种制备高纯度左旋卡尼汀的方法[P]. CN 101723843A, 2010-06-09.
[18] 卢定强,涂清波,凌岫泉,等.手性环氧氯丙烷的制备及其药物应用[J].有机化学,2009,29(8):1209-1216.
[19] Larrow J F, Jacobsen E N. Asymmetric processes catalyzed by chiral (salen) metal complexes[J]. Organometallics in Process Chemistry,2004:123-152.
[20] Zhu X, Venkatasubbaiah K, Weck M, et al. Kinetic Evaluation of Cooperative [Co (salen)] Catalysts in the Hydrolytic Kinetic Resolution of rac-Epichlorohydrin[J]. Chem. Cat. Chem.,2010(10):1252-1259.
[21] 钱国庆,张皓,张国州,等. R, S 及 R/S 型 3-氯 -1, 2-丙二醇的急性毒性研究[J].卫生研究,2007,36(2):137-140.
[22] 杨云旭,王伟力.一种以(R)-(-)-氯代甘油为手性起始原料合成L-肉碱的制备方法[P].CN 101823974A, 2010-09-08.
[23] 李全,沈旭.左旋肉毒碱盐酸盐新的合成方法(Ⅱ)[J].中国药物化学杂志,1995(4):276-278.
[24] Mccarthy J R, Beach S. Process for the preparation of Lcarnitine[P].US 5473104, 1995-12-05.
[25] 章小波,蒋永祥,汪劲松. (S)-3-羟基丁内酯的合成[J].精细化工中间体,2004(3):25-26.
[26] Byun I, Kim K, Bong C. Process for the prepration of Lcarnitine[P]. WO 1999/005092, 1999-04-02.
[27] Fiorini M, Valentini C. Method for preparing L-carnitine[P].US 4413142, 1983-11-01.
[28] Bellamy F D, Bondoux M, Dodey P. A new short and efficient synthesis of both enantiomers of carnitine [J]. Tetrahedron Letters,1990,31(50):7323-7326.
[29] Noyori R, Kitamura M, Ohkuma T, et al. Process for preparing carnitine[P]. EP 0339764, 1988-02-19.
[30] 孙果宋,韦志明,阮恒,等.一种制备左旋肉碱的方法[P]. CN 102633664A, 2012-08-15.
[31] 丁迪 M. O.,皮克罗 O.,邦尼法西奥 F.,等.生产L-肉碱的工业方法[P]. CN 1326435A, 2001-12-12.
[32] 陈新滋,陈建.一种制备L-肉碱的方法[P]. CN 1727328A,2006-02-01.
[33] 胡建荣.一种左卡尼汀化合物及其新制法[P]. CN 101875616A, 2010-11-03.
[34] Yokozeki K, Takahashi S, Hirose Y, et al. Asymmetric Production of L-Carnitine from trans-Crotonbetaine by Proteus mirabilis (Microbiology ffamp; Fermentation Industry)[J]. Agricultural and biological chemistry,1988,52(10): 2415-2421.
[35] Joers U, Bommarius A S. Studies on kinetics and application of L-carnitine-amidase for the production of L-carnitine[J].Biocatal Biotansform,1995,12(1):27-36.
[36] 范立强,袁勤生.微生物转换法——DL-肉碱解旋的新思路[J].中国药学杂志,1999,34(5):335-337.
[37] Moil N, Mitsuzumi H. Screening of carnitine-dehydrogenase having a low Km value for L-cainitine[J]. J.Ferment.Bioeng.,1993,75(6):395-396.
[38] 王强,田金强,张钟元.一种制备酰基-L-肉碱或和L-肉碱的方法[P]. CN 101921814A,2010-12-22.
[39] 陈群,吴菁.一种左旋肉碱的制备方法[P]. CN 101712969A,2010-05-26.
[40] 克莱伯 H-P.,卡诺瓦斯-迪亚兹 M.,奥邦 J. M.,等.由巴豆基甜菜碱制备L-肉碱的方法[P]. CN 98810854.2,2000-12-27.
[41] Thomas Elssner Leipzig D E, Hans-Peter Kleber Grossdeuben D E. Coenzymes useful for the synthesis of L-carnitine [P]. US 6562608 B2, 2003-05-13.
[42] 孙志浩,郑璞,王蕾,等. L-肉碱的酶法生产[J]. 精细与专用化学品,2008(4):15-17.
[43] Knut D E, Dr M M, D K H P. New carnitine racemase from E.coli and related plasmids [P]. DE 4402127, 1995-07-27.
[44] Eichler K, Mandrand-Berthelo M, Klebe H. DNA fragments encoding E.coli L-carnitine dehydratase and CaiE protein[P]. FR 2715167A1, 1995-07-21.
[45] 李炳旭,姜欢求,朴英熏,等.含有与L-肉碱生物合成相关基因的肠杆菌科属生物和使用该微生物生产L-肉碱的方法[P]. CN 11068925A, 2007-11-07.
[46] 毕伟建,黄金发.左旋肉碱在食品中的应用[J].广西轻工业,2010(8):16-17.
[47] 王京钟,王筱桂. L-左旋肉碱对人体运动能力的影响[J].中国食品添加剂,2003(5):40-43.
[48] 胡飞燕.左旋肉碱配合有氧健身运动对肥胖女性的影响[J].江苏教育学院学报(自然科学版),2008(3):37-39.
[49] 冉玉力,韩玲,谭华.左旋肉碱对维持性血液透析老年患者营养不良及心功能不全的影响[J].武警医学,2012, 23(2):147-149.
[50] 毕伟建,黄金发.左旋肉碱在猪生产中的作用[J].广西轻工业,2010(7):14-15.
[51] 巫传玲.左旋肉碱的应用[J].西南军医,2010,12(6):1184-1185.
[52] 陆建安.饲用左旋肉碱的制备与应用[J].饲料博览,2004(2):33-34.
[53] Arslan C. L-Carnitine and its use as a feed additive in poultry feeding a review[J]. Revue De Medecine Veterinaire,2006,157(3):134.
[54] Bonomini M, Zammit V, Pusey C D, et al. Pharmacological use of l-carnitine in uremic anemia: Has its full potential been exploited?[J]. Pharmacological Research,2011,63(3):157-164.
[55] 孙中吉,杨朝斌,王辉,等.左旋肉碱对一氧化碳中毒后血清心肌损伤标志物水平的影响[J].中国危重病急救医学,2012,23(12):739-742.
[56] 王亚轩,杨书文,瞿长宝,等.左旋肉碱治疗弱精子症患者的疗效观察[J].中华男科学杂志,2010(5):420-422.

