过氧化氢-邻氨基酚体系催化显色光度法测定微量铜
韦文业,施先义
(广西现代技术学院资源工程系,广西 河池 547000)
微量铜的测定有萃取法[1]、二溴茜素紫法[2]、苯基荧光酮法[3]、火焰原子吸收分光光度法[4]等。这些方法中,萃取法操作繁琐,而且所用的有机萃取剂通常有一定的危害。火焰原子吸收分光光度法需要使用到昂贵的仪器设备,同时,操作繁杂,所需分析成本比较高。催化褪色光度法[5 7]是在普通分光光度法的基础上发展起来的新型高灵敏度分光光度法,具有操作简便,仪器设备价格低廉,灵敏度高,准确性高,不使用有机萃取剂,便于推广应用等优点,是近年来极具发展前景的新型分析方法。催化显色光度法近年来有少量的研究[8],但几乎都是在常温下进行。本文以乙酸-乙酸钠缓冲溶液(pH=5.6)为介质,在冰水浴下,微量Cu(Ⅱ)催化过氧化氢氧化邻氨基酚显色,反应结束后,加入硫酸溶液终止反应,从而建立催化显色光度法测定微量铜的新方法,用于工业污水中微量铜的测定,获得满意的结果。
1 实验部分
1.1 主要仪器与试剂
722N 可见分光光度计,PHS-3C 酸度计。
Cu(Ⅱ)标准溶液(1000mg·L-1):准确称取3.9290g 硫酸铜(CuSO4·5H2O)溶于适量水,移入1000mL 容量瓶中,稀释至刻度线,摇匀,配成贮备液,使用时逐级稀释至所需浓度。
邻氨基酚溶液(1mg·mL-1):称取0.1000g 邻氨基酚(用无水乙醇重结晶法提纯)于小烧杯中,用标准溶液溶解后移入100mL容量瓶中,并用该标准溶液稀释至刻度,置于冰水浴中,不使用时放在冰水浴中于冰箱中保存,此溶液变色后不能使用。
乙酸-乙酸钠缓冲溶液(pH=5.6):称取100g三水合乙酸钠用水溶解后,加入5mL 冰醋酸,用水稀释至500mL,并在pH 酸度计上校正。
硫酸标准溶液(0.1mol·L-1),氢氧化钠标准溶液(0.1mol·L-1),过氧化氢(30%),硫酸溶液(10mol·L-1)。以上所用试剂除注明外均为分析纯,水为用蒸馏水制得的去离子水。
1.3 实验方法
取2 支具玻璃塞的10mL 比色管,放于冰水浴中。其中一支加入Cu(Ⅱ)标准溶液(催化反应),另一支不加(非催化反应,作为空白试验),然后分别加入2.0mL pH=5.6的乙酸-乙酸钠缓冲溶液,1.0mL邻氨基酚溶液,加入适量的氢氧化钠标准溶液(加入量根据硫酸标准溶液浓度和氢氧化钠标准溶液浓度之间的关系,以刚好中和邻氨基酚溶液中硫酸的量为准),加水至10.0mL,摇匀,加入0.20mL 过氧化氢,摇匀,以秒表计时放置反应10min(以上溶液均放置于冰水浴中,反应环境均为0 5℃)。快速加入0.5mL 的硫酸溶液,摇匀。流水浴至室温,分别倒入1cm 比色皿中,以空白为参比,在波长463nm 处测量吸光度A。
2 结果与讨论
2.1 吸收光谱
按实验方法配制不同的溶液,在波长400 600nm 之间测定吸光度,并绘制相应的吸收光谱如图1。

图1 吸收光谱图
从图1 中可知,当体系没有Cu(Ⅱ)存在时,过氧化氢难以氧化邻氨基酚显色(曲线1),而有Cu(Ⅱ)离子存在下,吸光度显著增大(曲线2),说明Cu(Ⅱ) 能够强烈催化过氧化氢氧化邻氨基酚显色,同时曲线1 和曲线2 在463nm 处都有最大吸收峰,因此,本实验选择463nm 作为测定波长。
2.2 酸度的影响
按试验方法,改变乙酸-乙酸钠缓冲溶液的pH值,进行吸光度的测定,试验结果如图2。
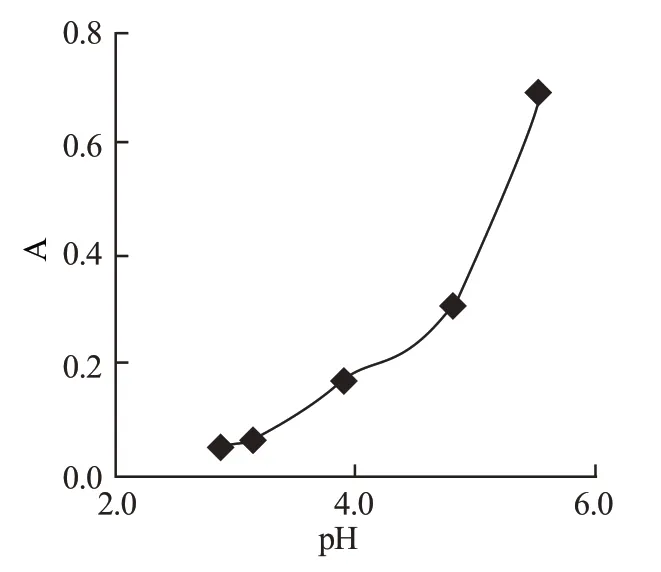
图2 酸度的影响
从图中可以看出,pH 值小于4 时反应进行得比较缓慢,pH 大于4 后,反应速度明显加快。因此选用pH=5.6 的缓冲溶液作为控制溶液的酸度。由于邻氨基酚溶液是用稀硫酸溶液配制,为了使缓冲溶液达到控制酸度的目的,必须用稀氢氧化钠溶液中和。实验结果表明,缓冲溶液用量少,达不到控制酸度的目的,用量太多,终止反应需要较多的硫酸溶液来破坏缓冲体系,当缓冲溶液pH 值为5.6,用量为2.0mL 时实验较正常。
2.3 H2O2 溶液用量的影响
按实验方法,改变H2O2溶液的用量进行吸光度的测定。实验结果如图3。

图3 H2O2 溶液用量的影响
从图3 可知,使用30% H2O2溶液作为氧化剂,随着过氧化氢用量的增大,吸光度亦不断增大。实验结果表明,过氧化氢用量过大,吸光度也太大,导致无法实验。本实验选用30% H2O2溶液的用量为0.20mL 比较理想。
2.4 反应时间的选择
按实验方法,改变反应时间,测定吸光度A,实验结果如图4。
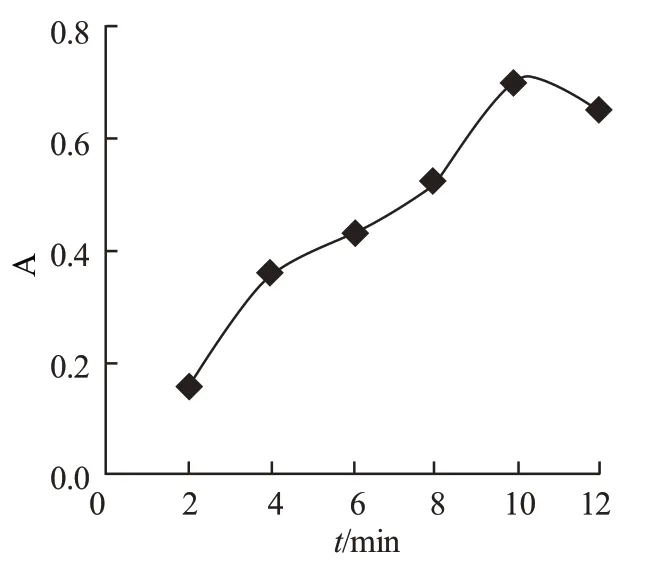
图4 反应时间的选择
从图中看出,反应在10min 前,A 随着时间的增加而迅速增大,反应在10min 得到的A 值最大,反应10min 后,A 值下降。本实验选择反应时间为10min。
2.5 反应温度的影响
反应温度对A 值有很大的影响,A 值是随着温度的增加而增大的,在常温下进行,催化反应和非催化反应都能进行,催化反应进行得更快些,且不同的温度下有不同的工作曲线。显然,工作曲线与样品测定时的温度必须一致,这样带来诸多不便。如果温度在30℃以上,催化反应和非催化反应都进行得非常快,无法控制操作。研究结果表明,在冰水浴的条件下(0 5℃)进行,非催化反应基本不进行,基本与时间没有关系,而催化反应随着时间的延长A 值增大。因此,实验选择温度在冰水浴(0 5℃)下进行,操作简便。
2.6 氢氧化钠标准溶液的使用
为了用较少的缓冲溶液就能有效地控制溶液的pH 值为5.6,在加入缓冲溶液前先对邻氨基酚溶液中的硫酸进行中和,所以采用加入氢氧化钠标准溶液的方法,加入量根据加入邻氨基酚溶液中的硫酸标准溶液的浓度而定,以刚好中和为止。
2.7 终止反应的选择
2.8 共存离子的干扰
对于浓度为10μg·mL-1的Cu(Ⅱ)的实验条件,下列共存离子不干扰:1000μg·mL-1的NO3-、NH4+、Mg+、K+、Cl-、Ca2+。在实际样品中的共存离子一般不会超过1000μg·mL-1,因此,多数情况下可以直接测定铜的含量,无需分离。Fe3+离子对体系干扰严重,可加入氟化钾将其掩蔽。
2.9 工作曲线
按实验方法,移取不同量的Cu(Ⅱ)标准溶 液 使 用 液(100μg·mL-1),Cu(Ⅱ)的 浓 度 在0 100μg·(10mL)-1范围内呈线性关系,其线性回归方程为:A=0.007c+0.0129,c 为比色管中Cu(Ⅱ)的浓度,单位为μg·(10mL)-1,相关系数为0.9974。
3 样品的测定
从环保监测站取得某含铜废水,该废水透明,但有沉淀,过滤处理后得到样品。准确吸取经处理得到的样品溶液2.0mL 于10mL 比色管中,按实验方法测定。测定结果为17.8μg·mL-1(n=6),RSD 为3.21%。加标回收率在90.6% 109.9%之间。
4 结论
用硫酸标准溶液溶解配制的邻氨基酚放置在冰水浴中保存比较稳定,在2 3d 的时间内都可以使用。
在冰水浴中进行操作反应,非催化反应基本上不进行,温度恒定,容易控制,工作曲线稳定。
优化条件:吸收波长463nm,反应pH 值5.6,反应时间10min,反应温度0 5℃(冰水浴),终止反应在强酸性条件下进行。
[1] 郑直,王影,王英华.离子液体萃取分光光度法测定铜[J].分析化学,2009,37(S1):310.
[2] 汤轶男,房贻龄,侯波.以二溴茜素紫为显色剂吸收比-分光光度法测定地面水中痕量铜(Ⅱ)[J].理化检验(化学分册),2009,45(7):768-771.
[3] 李荣勤,李靖.苯基荧光酮分光光度法测定微量铜[J].齐齐哈尔大学学报,2008,24(5):79-81.
[4] 张丽娟,范国强.晋毅,等. 微波消解原子吸收分光光度法测定六味地黄丸中的砷、铜[J].现代仪器,2011,17(1):40-42.
[5] 孙雪花,韦伟.王月霞.微波消解-催化褪色光度法测定农产品中痕量铜[J].分析科学学报,2009,25(4):48l-483.
[6] 魏秀萍.催化分光光度法测定催化剂中的痕量铜[J].南开大学学报(自然科学版),2007,24(5):11-14.
[7] 严小平.催化动力学褪色分光光度法测定痕量铜(Ⅰ)及其在食品中的应用[J].光谱实验室,2010,27(6):2167-2169.
[8] 施先义,邓必阳,梁少俊.催化显色光度法测定痕量铜[J].广西师范大学学报(自然科学版),2002,20(2):65-68.

