大肠埃希菌生物被膜体外模型的建立及黄连水提物对其抑制作用的初步研究
张春艳,包永睿,2,孟宪生,2* ,王 帅,2
(1.辽宁中医药大学药学院,辽宁大连 116600;2.辽宁省现代中药研究工程实验室,辽宁 大连 116600)
大肠埃希菌是医院内感染常见的条件致病菌,不仅可黏附于医疗装置(如留置导尿管、气管内插管等)形成生物被膜(BF)相关的慢性感染[1],而且还能在膀胱上皮细胞内形成生物膜,造成泌尿道持续感染[2],具有抵抗力强、耐药性强等特点[3]。本实验以大肠埃希菌生物被膜为研究对象,从生物被膜及大肠埃希菌的生物学特征出发,探讨中药有效成分对大肠埃希菌生物被膜的作用,旨在通过在体外建立E.coli-BF(大肠埃希菌生物被膜模型),观察黄连水提物对E.coli-BF可能的抑制作用,以期为中药治疗大肠埃希菌引起的相关感染提供依据。国内关于生物被膜的研究多是以一次性吸痰管、输液管、盖玻片及医用硅胶膜为载体,尚未见以Φ30培养皿为载体进行研究的相关报道,Φ30培养皿体外BF模型的建立,经过简单的银染后在显微摄影系统下即可观察BF形态,与以往实验采用的扫描电镜法相比,操作简单、节约成本。96孔板体外BF模型的建立,由于结晶紫染色属于活细胞与死细胞均能被染色,而MTT比色法是活细胞染色方法,所以MTT法更能准确反映出药物对生物被膜的作用效果,且方法操作简便、结果稳定可靠。将2种方法结合,既能在形态上观察生物被膜的形成情况,又能在数据上提供科学依据,使实验更具有完整性、创新性、合理性,为以后生物被膜的研究奠定基础。有些学者已做了细菌生物被膜在气管插管上的形成及抑制作用研究[4-5],但黄连对大肠埃希菌生物被膜的作用尚少见报道。本实验探讨黄连水煎液对体外大肠埃希菌生物被膜抗菌活性的影响,并确定了最佳给药时间及给药浓度,为进一步研究黄连水提物抗菌成分及BF相关感染的防治提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株 大肠埃希菌DH5α由大连波利顿公司提供。
1.1.2 仪器 Φ30培养皿(由上海五一玻璃仪器厂提供);96孔板(美国costar公司产品);盖玻片(江苏世泰实验器材有限公司);6孔板(美国costar公司产品);NUAIRETM US AUTOFLOW型CO2培养箱(德国 NUAIRE公司);HD2-BCN-1360B型生物洁净工作台(哈尔滨东联电子技术开发有限公司);Milli-Q超纯水处理装置(美国Millipore公司);OLYMPUS显微摄影系统(日本OLYMPUSBX51配DP72);SUNBRISE酶标仪(瑞士Tecan公司);GHP-9000系列隔水式恒温箱(上海益恒实验仪器有限公司)。
1.1.3 药物与试剂 黄连水煎液按文献[6]方法制备,生药浓度为2 mg/mL,4℃保存,有效使用期为2周;2.5%戊二醛(天津市科密欧化学试剂有限公司,批号20120629);氯化钙(天津市福晨化学试剂厂,批号20090410);硝酸银(国药集团化学试剂有限公司,批号20090925);硫代硫酸钠(天津市科密欧化学试剂有限公司,批号20110713);对苯二酚(天津市科密欧化学试剂有限公司,批号20110609);二甲基亚砜(DMSO)(北京索莱宝科技有限公司,批号20120627),四甲基偶氮唑盐(MTT)(美国GIBCO公司);LB培养液(g/L):氯化钠5,酵母粉5,蛋白胨10,自配;pH 7.4 磷酸盐缓冲液(g/L):磷酸二氢钾6.8,氢氧化钠1.164,自配;生理盐水:氯化钠0.09 g/L,自配。
1.2 方法
1.2.1 大肠埃希菌BF模型的建立 参照文献[7]方法并进行改进,将大肠埃希菌的单克隆细菌增殖培养的菌液稀释20倍,分别置于Φ30培养皿和96孔板中。取2个经过灭菌的Φ30培养皿,一个培养皿中加入4 mL稀释菌液,另一个加入4 mL LB培养液作为空白对照,置于37℃恒温培养箱培养24 h,取出,银染法观察大肠埃希菌BF形成过程[8]:生理盐水充分漂洗去除浮游菌;2.5%戊二醛PBS溶液固定1 h;蒸馏水清洗1 min;饱和氯化钙溶液结合15 min;蒸馏水漂洗1 min;5%硝酸银溶液反应15 min;1%对苯二酚溶液显色2 min;蒸馏水漂洗1 min;5%硫代硫酸钠溶液固定2 min;蒸馏水漂洗1 min;光学显微镜20×10倍下观察是否有大肠埃希菌生物膜在培养皿上的形成情况。96孔板四周为LB培养基,B~D行每孔加入100 μL稀释菌液,E~G行每孔加入100 μL LB培养基,作为空白对照组,置于37℃恒温培养箱培养24 h,取出,每孔加人20 μL MTT溶液,重新置于37℃恒温培养4 h,将菌液吸出,每孔加入150 μL二甲基亚砜溶液,放在微量振荡器上振摇10 min,在492 nm处扫描,测定OD值。
1.2.2 影响大肠埃希菌BF生长的因素 ①菌液浓度:分别将大肠埃希菌的单克隆细菌增殖培养的菌液稀释 5、l0、15、20、25、30、35 倍,96 孔板的四周每孔加入100 μL LB培养液,设置2~8列,每1列为1个浓度梯度,每孔加入200 μL稀释菌液,置于37℃恒温培养箱培养24 h,MTT法染色后在492 nm处扫描测定OD值;②培养时间:取6张96孔板,吸取稀释20倍的大肠埃希菌的单克隆细菌增殖培养的菌液加入96孔板,每孔200 μL,四周每孔加入100 μL LB 培养液,考虑到实验操作时间的可行性,选定将大肠埃希菌分别培养 6、12、18、24、30、36 h,每张板为一个时间梯度,MTT染色后在492 nm处扫描测定其OD值,考察BF的生长情况;③不同载体:将大肠埃希菌的单克隆细菌增殖培养的菌液稀释20倍分别接种于盖玻片、6孔板、96孔板、Φ30培养皿,培养24 h,银染后利用光学显微摄影系统观察BF形态。
1.2.3 银染法观察黄连水煎液作用于BF不同时间的抑制效果 将大肠埃希菌的单克隆细菌增殖培养的菌液稀释20倍,同时设置2个培养组,每组5个水平,1组为给药组,1组为空白对照,向每个培养皿中加入菌液4 mL,置于37℃恒温培养箱中培养24 h,空白组加入LB培养液4 mL,给药组加入黄连水煎液4 mL,重新置于37℃恒温培养箱中培养6 h后分别取出1个空白对照组和1个给药组的培养皿,经过银染法,在光学显微摄影系统下观察。每隔6 h取1次空白对照组和给药组经过银染后通过显微摄影系统观察黄连水煎液对大肠埃希菌生物被膜的抑制作用。
1.2.4 不同浓度黄连水提物对 E.coli-BF的抑制作用 在96孔板中建立大肠埃希菌生物被膜体外模型,96孔板的四周加入100 μL的LB培养基,待用。设置A行为空白对照组,B~G行每行每5个孔为1组复孔,每1组复孔设为1个给药浓度,共 10个给药浓度,分别为 20、40、60、80、100、120、140、160、180、200 mg/mL,置于 37 ℃ 恒温培养箱中培养24 h,MTT法染色,测其492 nm处的OD值。
1.2.5 数据处理 采用 SPSS17.0软件对相关数据进行统计分析,组间数据比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 大肠埃希菌BF模型的建立结果判断
2.1.1 Φ30培养皿大肠埃希菌体外模型的建立在显微摄影系统下观察发现加入稀释菌液的培养皿被浓厚的黑染絮状膜样物质覆盖,空白组基本无黑染絮状膜样物质,说明Φ30培养皿可以成功构建大肠埃希菌体外模型,见图1。

图1 Φ30培养皿大肠埃希菌体外模型(200×)Fig.1 Φ30 petri dishes of E.coli-BF in vitro modle(200×)
2.1.2 96孔板大肠埃希菌体外模型的建立通过MTT染色后492 nm处扫描测定OD值,加入稀释菌液的模型组的平均OD值为4.191;加入LB培养液的空白组的平均OD值为0.069,此结果说明96孔板可以成功构建大肠埃希菌体外模型。
2.2 影响大肠埃希菌BF生长的因素结果判断
2.2.1 菌液浓度 将大肠埃希菌的单克隆细菌增殖培养的菌液稀释5、10、15、20、25、30、35 倍分别培养24 h,稀释20倍培养液的大肠埃希菌生物膜生长状况最佳,且稳定,见图2。

图2 菌液浓度对大肠埃希菌BF生长的影响(200×)Fig.2 Effect of bacterial concentration on E.coli-BF formation(200×)
2.2.2 培养时间 将大肠埃希菌的单克隆细菌增殖培养的菌液稀释 20倍,分别培养6、12、18、24、30、36 h,培养24 h 的大肠埃希菌生物膜生长最佳并且到36 h一直保持稳定,由于实验时间的允许性及菌落自我凋亡的代谢周期,选择24 h为最佳的传代、铺板及给药时间,见图3。
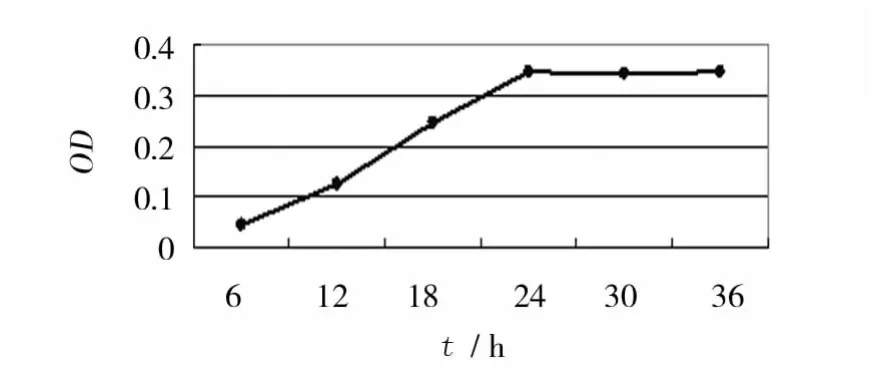
图3 培养时间对大肠埃希菌BF生长的影响(200×)Fig.3 Effect of incubation time on E.coli-BF formation(200×)
2.2.3 不同载体 将大肠埃希菌的单克隆细菌增殖培养的菌液稀释20倍,分别接种于盖玻片、6孔板、96孔板、Φ30培养皿,培养24 h,发现以上载体均被大肠埃希菌生物被膜覆盖。载玻片的黑染絮状膜样物质较稀少;6孔板、96孔板、Φ30培养皿均被浓厚的黑染絮状膜样物质覆盖,可以作为通过MTT染色后用酶标仪测定OD值方法的载体;但由于6孔板、96孔板容易污染显微镜头,所以选择Φ30培养皿作为通过银染法利用显微摄影系统观察生物膜生长情况的载体。
2.3 黄连水煎液影响大肠埃希菌 BF光学显微摄影系统下的结果判断
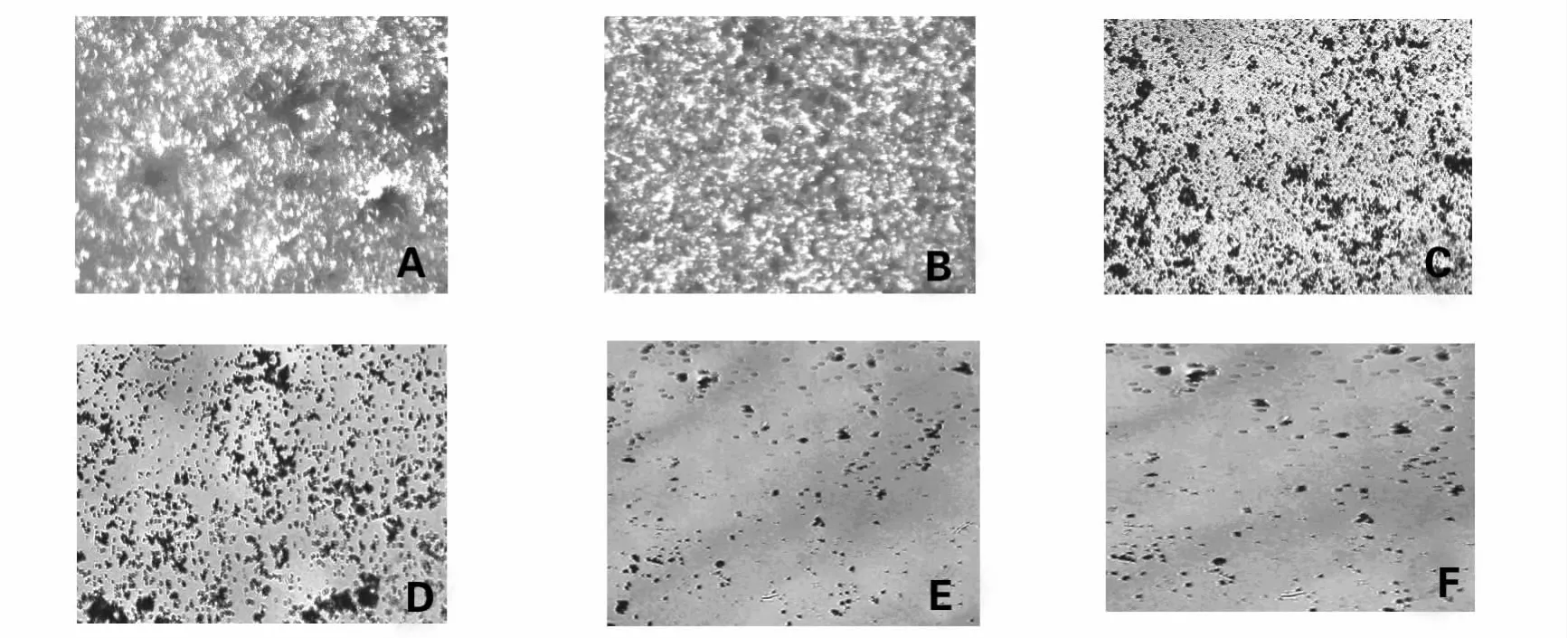
图4 不同药物作用时间对大肠埃希菌生物被膜的抑制作用(200×)Fig.4 Effect of differnent treatments on E.coli-BF formation(200 × )
光学显微镜下观察结果见图4,A为空白对照组银染后光学显微镜照片,整个视野可见被浓厚的黑染絮状膜样物质覆盖,层次多,致密;黑染絮状膜样物为BF。B~F为给药不同时间银染后光学显微镜照片,给药24 h后整个视野可见散落的黑点或黑斑,无黑染的絮状膜样物,此结果说明黄连水煎液对大肠埃希菌作用24 h后即可产生很好的抑制作用,考虑到时间的问题,选择24 h作为药物作用时间即可。
2.4 不同浓度的黄连水煎液对大肠埃希菌生物被膜抑制作用的结果判断
由图5可知,当药物浓度达到80 mg/mL时开始对大肠埃希菌生物被膜有抑制作用,抑制率为20.8%(P <0.05﹚,药物浓度为 180 mg/mL时抑制率达到70.23%(P<0.05﹚,药物浓度高于180 mg/mL抑制率并无明显增大,所以选择180 mg/mL为最佳的给药浓度。此结果说明生药浓度为80 mg/mL的黄连水煎液即可抑制和破坏早期及成熟BF,生药浓度为180 mg/mL的黄连水煎液对大肠埃希菌生物膜的抑制作用已很好。
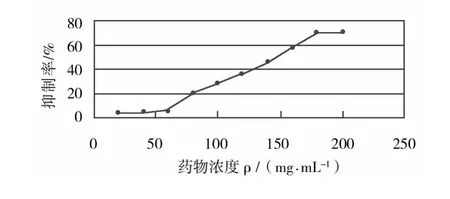
图5 不同药物浓度对大肠埃希菌生物被膜的抑制作用(200×)Fig.5 Effect of different drug concention on E.coli-BF formation(200×)
3 讨论
由于生物膜的存在,使得膜内的细菌逃逸抗生素的杀伤作用成为潜在的感染源[9-10],导致了广泛耐药性[11]。药物的耐药问题被世界卫生组织认为是21世纪最大的健康问题之一,革兰阴性菌腹膜炎是引起腹透患者死亡和治疗失败的常见原因,大肠埃希菌则是腹透相关性腹膜炎的最常见的革兰阴性菌,寻找能够抑制BF生长的药物已成为重要课题。
过去的实验工作中,有人已经成功利用试管法在体外建立大肠埃希菌生物被膜模型[12]。本研究首次提出利用Φ30培养皿构建大肠埃希菌生物膜体外模型,通过银染法在显微摄影系统下可以很清晰地观察到大肠埃希菌在LB培养液中培养24 h即可在培养皿表面形成生物被膜,这一变化形成得很快,进一步提示临床工作中医患对大肠埃希菌相关性腹膜炎的及时发现、及时处理,对于改善预后、预防复发具有重要意义。本实验改变以往采用结晶紫对微生物的染色方法,采用MTT法,操作简单、稳定、节约成本。结晶紫染色法会使活细胞和死细胞均被染色,不能准确说明药效,使实验产生误差,而MTT法对此问题进行了改善,比结晶紫染色更能准确说明活菌形成BF的能力以及药物对BF的影响。
本实验首次将黄连水煎液运用到生物被膜感染的研究,并通过此模型考察了不同作用时间及不同生药浓度的黄连水煎液对BF形成的影响。实验结果显示,黄连水煎液对大肠埃希菌作用24 h后即可产生很好的抑制作用,且随着药物浓度的增加,药物作用效果越明显,量效呈一定的线性关系,生药浓度为180 mg/mL时达到最佳,抑制率达到70.23%。180 mg/mL的黄连水煎液对大肠埃希菌生物被膜有明显的抑制和破坏作用,提示其对大肠埃希菌生物被膜的发育有明显的影响,通过研究黄连水煎液对大肠埃希菌的抑制作用,为进一步研发抵抗大肠埃希菌耐药菌株的新药奠定良好基础。
[1]Kobayashi H.Airway biofilm disease[J].Int J Antimierob A-gents,2001,17(5):351.
[2]Donlann R M.Biofilms:microbial life on surfaces[J].Emerg InfectDis,2002,8(9):881.
[3]PatelR.Biofilms and antimicrobial resistance[J].ClinOrthop Relat Res,2005,(437):41.
[4]Hyde JA,Darouiche RO,Costerton JW.Strategies for prophylaxis against prosthetic valve endocarditis:A review article[J].J Heart ValveDis,1998,7(3):316.
[5]Bauer TT,Torres A,Rasche K.Biofilm formaiton in endotracheal tubes:Associa-tion betweenpneumonia and the persistence of pathogents[J].Monaldi Arch ChestDis,2002,57(1):84.
[6]李明玥.黄连提取工艺的研究[J].黑龙江医药,2012,25(4):557.
[7]徐多多,潘志,高阳,等.细菌生物膜模型的建立及注射用双黄连对细菌生物膜形成的影响[J].长春中医药大学学报,2009,25(5):667.
[8]梁俐,王成玉,邹龙涛,等.银染法观察大肠杆菌生物被膜变化初探[J].内科,2012,7(2):95.
[9]Chicurel M.Bacteiral biofilms and infections.Slimebusters[J].Nature,2000,408(6810):284.
[10]Nagata T,Mukae H,Kadota J,et al.Effect of Erythromycin on Chronic Respiratory Infection Caused by Pseudomonas aeruginosa with Biofilm Formation in an ExperimentalMurineModel[J].Antimicrob Agents Chemother,2004,48(6):2251.
[11]陈波曼,余加林.细菌生物膜形成和耐药机制研究进展[J].中国抗生素杂志,2005,30(10):1.
[12]陈朝喜,朱恒乾,廖晓萍,等.大肠埃希菌生物被膜体外模型的建立及其应用[J].动物医学进展杂志,2011,32(3):8.