PbO2电极的改性及非均相电催化氧化废水中的硝基苯
刘 淼,冷 粟,陈嵩岳,刘 歆,陈力可,刘 南,焦昕倩,全福民
(吉林大学 环境与资源学院,地下水资源与环境教育部重点实验室,长春130012)
硝基苯(NB)是生产医药和染料等的重要原料,因其高毒性及难降解被列为优先控制的环境污染物.电解法处理废水中硝基苯的原理是利用阴极将硝基苯还原为苯胺[1],但对生成的苯胺仍需进行后续处理[2].电催化氧化需催化活性高且导电性好的阳极材料[3].PbO2具有析氧过电位高、耐腐蚀性好、导电性能优越、化学性质稳定、使用寿命长及价格低廉等特点[4],在无机和有机化合物的电解生产、化工生产和水污染物处理等领域应用广泛.由于实际应用中镀制的活性β-PbO2具有多孔、内应力大及易损耗等缺点,因此研究人员制备了F-,Bi3+,Fe3+及聚四氟乙烯微粒(PTFE)等掺杂的β-PbO2阳极,改善了阳极的稳定性和电催化活性.非均相催化又称为多相催化,是指反应物与催化剂处于不同物理相的催化过程.多相催化的核心是固体催化剂[5].本文通过扫描电镜(SEM)表征Ti/PbO2电极和F-,La3+共掺杂PbO2电极(Ti/F-La-PbO2)的表面结构,结合X射线衍射(XRD)测试、加速电解寿命测试和降解废水中硝基苯的电催化活性,考察不同掺杂对PbO2电极晶相、稳定性和电催化活性的影响.并以Ti/F-La-PbO2为电极,处理水体中的有机污染物硝基苯,将多相催化氧化技术引入电化学体系中,构成多相电催化氧化体系,在催化剂的作用下,强化电化学反应中产生氧化剂的氧化效率,提高电化学降解高浓度和生物难降解有机物的效率.
1 实 验
1.1 实验仪器与试剂
SSX-550型扫描电子显微镜(日本岛津公司);D5005型X射线粉末衍射仪(德国西门子公司);WYJ-3003L型直流电源(杭州苹果仪器仪表有限公司).
乙二醇、柠檬酸、四氯化锡、硫酸、草酸、三氧化二锑和丙酮等试剂均为国产分析纯.
1.2 制备PbO2电极
1.2.1 预处理Ti基体 将规格为35mm×55mm×2mm的Ti基体用砂纸打磨抛光,在质量分数为10%的硫酸溶液中浸煮0.5h,取出,用蒸馏水洗净,再用沸腾的质量分数为10%的草酸溶液刻蚀2h,清洗后,保存在质量分数为1%的草酸溶液中待用.
1.2.2 制备中间层 在处理好的Ti基体上,采用高温热氧化法制备Sb-SnO2中间层[6].
1.2.3 制备外层 将涂有中间层的电极和石墨分别作为阳极和阴极在电镀液中电沉积4h,前20min电流密度为0.04A/cm2,余下时间的电流密度为0.08A/cm2,温度为55~60℃.其中电镀液组成为Pb(NO3)2450g/L,Cu(NO3)2150g/L,NaF 1.2g/L,HNO350g/L,在电镀液中加入适量硝酸镧以提高电极板的降解效率.
1.3 电极表征及性能测试
通过SEM表征电极的表面层形貌,机械剥离电极表面镀层,采用X射线衍射仪分析材料晶型.采用高电流密度下加速电解的实验方法考察电极预期使用寿命.用WYJ-3003L型恒压/恒流电源,以制备的PbO2电极为阳极,石墨为阴极,电极间距为10.0mm,测定电极在60.0℃,2.0mol/L H2SO4水溶液中电流密度恒为2.0A/cm2时的寿命.以槽电压对时间的变化监控阳极电势,以镀层脱落并伴随槽电压迅速上升作为评价电极失活的判据[7].
采用还原-偶氮光度法测定降解样品中NB的质量浓度,于545nm波长处测量吸光度.采用GB11914-89法测定化学耗氧量(COD).COD和NB去除率公式为η=(ρ0-ρt)/ρ0,式中:ρ0表示原水溶液中COD和NB的质量浓度;ρt表示t时刻的COD和NB的质量浓度.
1.4 催化剂的制备及表征
将0.21g三氯化铁(FeCl3·6H2O)晶体溶于蒸馏水中,10g氧化镁粉末加至已配好的三氯化铁溶液中,搅拌均匀后置于坩埚中,于400℃马弗炉内煅烧2h.冷却后取出坩埚,将Fe3+/MgO固体在研钵中研磨至粒度均匀的粉末,置于干燥箱中待用.
通过SEM表征催化剂的表面形貌,用XRD确定电极涂层的晶体结构.实验条件为:Cu阳极,石墨单色器,电压40kV,电流30mA,狭缝DS=1°,SS=1°,RS=0.3mm,扫描范围10°~90°,扫描速率3°/min.
1.5 废水中硝基苯的电解氧化
在200mL含有硝基苯的废水中加入无水硫酸钠作为电解质,用硫酸和氢氧化钠调节pH值,以Ti/F-La-PbO2为阳极,石墨为阴极,水样中加入自制催化剂进行电解.通过电解时间、电流强度、溶液pH值、催化剂用量和搅拌速率等因素考察催化剂对废水去除硝基苯效果的影响.
2 结果与讨论
2.1 电极表面形貌及涂层分析
2.1.1 SEM表征 图1为电沉积电极Ti/F-PbO2和Ti/F-La-PbO2的SEM照片.由图1可见,未掺镧元素的电极表面粗糙且有较多宽大的裂缝,掺杂镧元素的电极表面裂缝减少,排布规则平整,表明在电镀液中掺入少量的添加剂可改变电极表面的晶体沉积,使镀层对钛基体覆盖较好,在电解过程中阻止氧向基体扩散,缓解电极活性层的脱落;同时使电极表面晶体细化增加了电极的表面积.

图1 电沉积电极Ti/F-PbO2(A),(B)和Ti/F-La-PbO2(C),(D)的SEM 照片Fig.1 SEM photographs of Ti/F-PbO2(A),(B)and Ti/F-La-PbO2electrodes(C),(D)
2.1.2 XRD测试 图2为 Ti/PbO2,Ti/F-PbO2和 Ti/F-La-PbO2电极活性层的 XRD谱.由图2可见:在2θ=24.5°,32°,36.7°,48.5°等处均出现PbO2的强峰;在电镀液中得到的PbO2晶型均以β-PbO2为主,属于单胞正方晶系;在F-掺杂和F-,La3+共掺杂谱中未出现其他峰.不同掺杂均影响晶体生长的晶面取向.因为F-(133pm)和O2-(140pm)有相似的离子半径,F-易于取代O2-进入β-PbO2晶格,电沉积过程中La3+也易于取代Pb4+进入β-PbO2晶格,所以在β-PbO2晶体的生长过程中,F-掺杂和F-,La3+共掺杂对PbO2晶体生长的晶面取向影响较大.
2.1.3 电极的稳定性 应用加速电解测试评估 Ti/PbO2,Ti/F-PbO2和 Ti/F-La-PbO2电极的使用寿命,结果如图3所示.由图3可见,3种电极的槽电压随电解时间的变化关系可分为3个阶段:活化阶段、稳定阶段和失活阶段[8].与 Ti/PbO2电极相比,Ti/F-PbO2电极寿命提高较多,Ti/F-La-PbO2电极寿命提高较少.在20~40h加速电解稳定阶段中,3种电极对应的槽电压为Ti/F-PbO2>Ti/PbO2>Ti/F-La-PbO2.在相同电解条件下,槽电压大小对应于电极阳极电荷转移电阻的大小.即F-掺杂增加了电极的电荷转移电阻,这种影响与F-掺杂降低了PbO2中自由电子的浓度有关[9];F-和La3+共掺杂降低了阳极的电荷转移电阻.

图2 PbO2的XRD谱Fig.2 XRD patterns of PbO2electrodes

图3 不同电极的槽电压随加速电解时间的变化关系Fig.3 Changes of cell potentials of different electrodes with accelerated electrolysis time
2.1.4 电极的电催化性能 在硝基苯初始质量浓度为324.92mg/L,COD初始质量浓度为698mg/L,电解电流为0.4A,处理水量200mL,pH=4.0,搅拌速率为300r/min的条件下,分别采用Ti/PbO2,Ti/F-PbO2和Ti/F-La-PbO2电极进行硝基苯废水降解实验,考察不同电极的电催化性能.图4为不同电极降解硝基苯溶液时COD和硝基苯去除率随时间的变化曲线.由图4(A)可见,在0~2hCOD的降解速率较慢,2~4hCOD的降解速率较快.这是因为在初始阶段体系内的硝基苯质量浓度较高并被大量去除,主要生成具有还原性的苯胺,溶液中还原性物质的增加导致COD去除率较低.随着反应的进行,硝基苯的质量浓度降低较快,大部分苯胺被氧化,从而提高了COD的去除率.由图4(B)可见,3种电极在0~2h对硝基苯的降解较快,2~4h降解较慢.这是因为在初始阶段体系内的硝基苯质量浓度较高,能快速扩散至电极表面并发生反应;随着反应的进行,大部分硝基苯被去除,单位时间内扩散至电极表面的硝基苯减少,中间产物的竞争反应增多,导致硝基苯的降解速率降低.

图4 COD(A)和硝基苯(B)在不同阳极上降解时去除率随时间的变化关系Fig.4 Changes degradations of COD(A)and NB(B)at different electrodes with time
2.2 催化剂的表征及电解实验
2.2.1 催化剂的表征 图5为MgO粉末和催化剂Fe3+/MgO粉末的SEM照片.由图5可见,在掺杂Fe3+的MgO粉末中,Fe3+呈针状或颗粒状均匀嵌入MgO表面,其颗粒明显大于单纯的MgO颗粒.
图6为Fe3+/MgO和 MgO粉末的XRD谱.由图6可见,在2θ=18.68°,38.16°,43.02°,58.24°等处均出现特征峰,其中以Fe的氧化物特征峰为主,MgO的特征峰较少,表明高温煅烧时Fe与Mg的外围空穴受激发,使Fe以各种离子价态嵌入Mg的氧化物中,在Mg氧化物表面形成各种Fe氧化物,从而形成比表面积更大且具备催化性质的晶体.
2.2.2 电解实验
2.2.2.1 电解时间对水样去除效果的影响 在硝基苯初始质量浓度为324.92mg/L,COD初始质量浓度为698mg/L,以掺镧电极作为工作电极,电解电流为0.4A,处理水量200mL,pH=4.0,催化剂投加量为0.1mg/L,搅拌速率为300r/min的条件下,考察电解时间对COD及硝基苯去除率的影响,实验结果如图7所示.由图7可见,COD及硝基苯的去除率均随电解时间的增加而增大,电解6h后,硝基苯去除率趋于平缓,电解10h的去除率最大.这是因为在相同的反应条件下,单位体积废水的电解时间增大使反应器内的氧化还原反应进行得更充分,表现为去除率增大.当污染物的去除率达到上限时,多余的电能转化为内能,表现为废水温度增高[10-11].加入催化剂可提高反应速率,使污染物的去除率在较短时间内达到预期效果.因此,该电解反应的最佳时间为4h,COD和硝基苯的去除率分别为67%和81%.

图5 MgO粉末(A),(B)和催化剂Fe3+/MgO粉末(C),(D)的SEM 照片Fig.5 SEM photographs of MgO(A),(B)and Fe3+/MgO (C),(D)

图6 Fe3+/MgO及MgO粉末的XRD谱Fig.6 XRD patterns of MgO and Fe3+/MgO

图7 20℃下反应时间对COD(A)和NB(B)去除率的影响Fig.7 Effect of electrolysis time on degradations of COD(A)and nitrobenzene(B)at 20℃
2.2.2.2 电解电流对水样去除效果的影响 在COD和硝基苯初始质量浓度分别为698mg/L和324.92mg/L,以Ti/F-La-PbO2电极作为工作电极,电解时间为4h,处理水量200mL,pH=4,催化剂投加量为0.1mg/L,搅拌速率为300r/min,进水温度为20℃的条件下,考察电解电流对COD和硝基苯去除率的影响,实验结果如图8所示.由图8可见,COD和NB的去除率均随电流的增大而增大.当电流由0.4A升至0.6A时,硝基苯去除率明显提高;当电流大于0.6A时,硝基苯去除率随电流的增加提高缓慢,由于大电流使电解副反应加剧,导致电压增大,温度升高,电流效率降低[12].在相同的电流条件下加入催化剂,COD和硝基苯的去除率均明显增加,表明加入催化剂提高了电流效率及电解产生自由基的利用率.综合考虑电流效率、电压效率和体系能耗等因素,本文选取电流为0.6A,COD和NB的去除率分别为79%和93%.
2.2.2.3 溶液pH值对水样去除效果的影响 在COD和硝基苯初始质量浓度分别为698mg/L和324.92mg/L,以Ti/F-La-PbO2电极作为工作电极,电解时间为4h,电解电流为0.6A,处理水量200mL,催化剂投加量为0.1mg/L,搅拌速率为300r/min,进水温度为20℃的条件下,考察体系pH值对COD和硝基苯去除率的影响,实验结果如图9所示.

图8 电流对COD(A)和NB(B)去除率的影响Fig.8 Effect of current intensity on degradations of COD(A)and nitrobenzene(B)

图9 溶液pH值对COD(A)和NB(B)去除率的影响Fig.9 Effect of pH on degradations of COD(A)and nitrobenzene(B)
由图9(A)可见,中性条件下废水的COD去除率最大,酸性和碱性条件下COD的去除率较小.由

可知:酸性条件使式(1)中反应左移,不利于·OH的产生,阳极电解效率较低,导致酸性条件低于中性条件下COD的去除率;碱性条件提高了阴极的还原作用,硝基苯生成具有还原性的苯胺,溶液中还原性物质的增加导致COD去除率较小.由图9(B)可见,碱性条件下硝基苯的去除率最大,因为碱性条件提高了阴极的还原作用,阴极的给电子和析氢作用促使硝基苯在阴极逐步还原生成亚硝基苯、羟氨基苯和苯胺[13]:

邵春雷等[2]认为在酸性条件下,H+增加使反应式(3)的平衡向右移动,阴极生成苯胺效率增加;在碱性条件下,更多的硝基苯还原生成苯胺.Xu等[14]发现在碱性条件下,电解生成苯胺的效率明显优于酸性或中性条件,与本文结果相符.即PbO2电极电解硝基苯在中性条件下COD去除率最大,碱性条件下硝基苯去除率最大.
由图9可见,加入催化剂可使COD和硝基苯的去除率明显增大,这是因为加入催化剂后,电解产生·OH的利用效率大幅增加,溶液对pH值的缓冲能力增强,使得溶液中COD和硝基苯的去除率受pH影响较小所致.根据实验所用废水中硝基苯的性质,本文将废水pH值调节为4.0.
2.2.2.4 催化剂用量对水样去除效果的影响 在COD和硝基苯初始质量浓度分别为698mg/L和324.92mg/L,以Ti/F-La-PbO2电极作为工作电极,电解时间为4h,电解电流为0.6A,溶液pH=4.0,处理水量200mL,搅拌速率为300r/min,进水温度为20℃的条件下,考察体系中催化剂用量对COD及硝基苯去除率的影响,实验结果如图10所示.
由图10可见,加入催化剂可使COD和硝基苯的去除率明显增大.COD和硝基苯的去除率随催化剂用量的增加而增大,当催化剂用量大于0.2g/mL时,去除率增大较小.这是因为催化剂用量较小可增加单位催化剂的催化效率,从而提高去除效率,但由于反应体系空间较小,因此催化剂加入过多会降低单位催化剂的催化效率,导致去除效率降低.当催化剂用量为0.2g/mL时,COD与硝基苯的去除率分别为83.81%和96.23%.

图10 催化剂用量对COD(A)和NB(B)去除率的影响Fig.10 Effect of the amount of catalyst on degradations of COD(A)and nitrobenzene(B)
非均相电催化氧化硝基苯是复杂的多相反应,为简化动力学模型做如下假设:1)只在气-液和液-固相的表面反应,以阳极氧化降解硝基苯为主;2)电化学过程中的溶液体积和物质分散度不发生变化[15].根据实验中硝基苯质量浓度与时间t的关系,将-lnρ/ρ0对时间t做图,如图11所示.由图11可见,-lnρ/ρ0与t呈线性关系.因此硝基苯的降解符合一级反应动力学方程,即-lnρ/ρ0=kt.速率常数及线性关系列于表1.

图11 不同催化剂加入量的动力学曲线Fig.11 Kinetics curves of different amount of catalyst
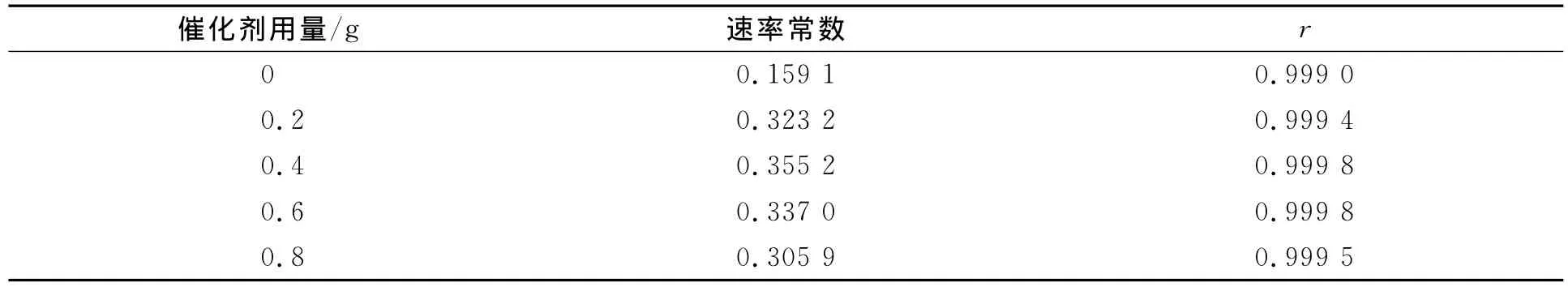
表1 不同催化剂加入量的动力学参数Table 1 Different kinetic parameters in the presence of different amounts of catalyst
在室温20℃,电流0.6A,pH=4,搅拌速率为300r/min的条件下电解4h,电解体系中有无催化剂对COD和硝基苯的去除率结果列于表2.

表2 电解体系中有无催化剂的效果比较Table 2 Comparation of electrolytic effects with or without catalyst
综上,本文采用热分解-电镀法制备 Ti/PbO2,Ti/F-PbO2和 Ti/F-La-PbO2电极,并研究了F-掺杂和F-,La3+共掺杂对PbO2电极电化学稳定性和电催化降解活性的影响以及加入催化剂对废水处理效果的影响,可得如下结论:1)F-掺杂延长了Ti/F-PbO2电极的寿命,La3+掺杂可减小电极的电荷转移电阻;2)F-和La3+掺杂提高了电极电催化降解活性,其电催化效果为 Ti/F-La-PbO2>Ti/F-PbO2>Ti/PbO2;3)加入Fe3+/MgO催化剂的非均相电解体系比普通电解体系的反应速率快,在反应时间充足的条件下,Fe3+/MgO催化剂可使硝基苯降解产物进一步氧化,提高废水COD的去除效果;4)在电解过程中,加入催化剂可提高电流的利用效率,增加溶液对pH值的缓冲能力;5)适当的催化剂用量可增加COD和硝基苯的去除率,且符合一级反应动力学.
[1]ZHANG Cun-zhong,YANG Jing,WU Zhong-da.Electro Reduction of Nitrobenzene on Titanium Electrode Implanted with Platinum [J].Materials Science & Engineering:B,2000,68(3):138-142.
[2]SHAO Chun-lei,GU Ding-hong,LU Jing,et al.Research on the Treatment of Nitrobenzene Wastewater by Electrolysis on a Novel Lead Dioxide Anode[J].Research of Environmental Sciences,2006,19(4):65-69.(邵春雷,顾丁红,陆晶,等.新型二氧化铅电极处理硝基苯废水 [J].环境科学研究,2006,19(4):65-69.)
[3]ZHAO Hai-yan,CAO Jiang-lin,CAO Fa-he,et al.Effect of F-,Fe3+-Doping on Performance of Lead Dioxide Anodes[J].Chinese Journal of Inorganic Chemistry,2009,25(1):117-123.(赵海燕,曹江林,曹发和,等.F-和 Fe3+掺杂对Ti基PbO2阳极性能的影响 [J].无机化学学报,2009,25(1):117-123.)
[4]XIE Tian,WANG Bin.Review on Preparation Method of Lead Dioxide Electrode [J].Journal of Chengdu University:Natural Science,2003,22(3):25-30.(谢天,王斌.二氧化铅电极制备方法综述 [J].成都大学学报:自然科学版,2003,22(3):25-30.)
[5]YANG He, XUE Xiang-xin,ZHAO Na,et al.Study Progress on Heterogeneous Photocatalysis of Semiconductors[J].Environmental Protection,2003(6):22-23.(杨合,薛向欣,赵娜,等.半导体多相光催化技术研究进展 [J].环境科学,2003(6):22-23.)
[6]LIU Miao,WANG Li,LIU Bo,et al.Impact on Electrochemical Degradation of Phenol with Different Coated Electrodes and Inhibitors[J].Environmental Science,2007,28(12):2745-2749.(刘淼,王丽,刘波,等.不同涂层电极和抑制剂对电化学氧化降解苯酚的影响 [J].环境科学,2007,28(12):2745-2749.)
[7]LIANG Zhen-hai,ZHANG Fu-yuan,SUN Yan-ping.Study of SnO2+Sb2O4Intermediate Layer in Non-noble Metal Ti/MO2Anode[J].Rare Metal Materials and Engineering,2006,35(10):1605-1609.(梁镇海,张福元,孙彦平.耐酸非贵金属Ti/MO2阳极SnO2+Sb2O4中间层研究 [J].稀有金属材料与工程,2006,35(10):1605-1609.)
[8]CAO Jiang-lin,WU Zu-cheng,LI Hong-xia,et al.Inactivation of PbO2Anodes during Oxygen Evolution in Sulfuric Acid Solution[J].Acta Physi-Chim Sin,2007,23(10):1515-1519.(曹江林,吴祖成,李红霞,等.PbO2阳极在硫酸溶液中的析氧失活行为 [J].物理化学学报,2007,23(10):1515-1519.)
[9]CAO Jiang-lin,ZHAO Hai-yan,CAO Fa-he,et al.The Influence of F-Doping on the Activity of PbO2Film Electrodes in Oxygen Evolution Reaction[J].Electrochim Acta,2007,52(28):7870-7876.
[10]ZHONG Li.New Technique of Wastewater Treatment:Heterogeneous Catalytic Oxidation[J].Guangdong Chemical Industry,1999(5):13-15.(钟理.废水处理新技术:非均相催化氧化过程 [J].广东化工,1999(5):13-15.)
[11]LI Chang-hai,WANG Yuan-rui,ZHAO Li-li.The Constructional Design of the Electrolytic Tank for the Decolourization of Dyeing and Printing Waste Water by Conductive Electro Flocculation [J].Journal of Jilin Institute of Technology,1998,19(3):21-25.(李长海,王元瑞,赵丽丽.导流电凝聚法印染废水脱色电解槽结构设计 [J].吉林工学院学报,1998,19(3):21-25.)
[12]YANG Rui-xia,MAO Cun-feng.A Study on Treatment of Nitrobenzene Wastewater with Electrolysis [J].Journal of Qingdao University:Engineering &Technology Edition,2006,21(2):54-58.(杨瑞霞,毛存峰.电解法处理硝基苯废水研究 [J].青岛大学学报:工程技术版,2006,21(2):54-58.)
[13]Scherer M M,Johnson K M,Westall J C,et al.Mass Transport Effects on the Kinetics of Nitrobenzene Reduction by Iron Metal[J].Envirom Sci Technol,2001,35(13):2804-2811.
[14]XU Wen-ying,GAO Ting-yao,FAN Jin-hong.Reduction of Nitrobenzene by the Catalyzed Fe-Cu Process[J].J Hazard Materi,2005,123(1/2/3):232-241.
[15]HAN Wei-qing,XUE Hong-min,QIAN Tian-jiao,et al.Electrochemical Oxidation of Phenolic Resin Wastewater by Three Dimensional Electrode[J].Environmental Science and Technology,2010,23(6):31-35.(韩卫清,薛红民,钱添皎,等.三维电极电化学氧化酚醛树脂生产废水 [J].环境科技,2010,23(6):31-35.)

