胰岛素瘤动物模型的建立及特性研究*
成兰云, 许世清, 张文健, 娄晋宁, 门秀丽
(1河北联合大学基础医学院病理生理学系,河北 唐山 063000; 2中日友好医院临床医学研究所,北京 100029; 3涿州市医院病理科, 河北 涿州 072750)
·实验技术·
胰岛素瘤动物模型的建立及特性研究*
成兰云1,3, 许世清2, 张文健2, 娄晋宁2, 门秀丽1△
(1河北联合大学基础医学院病理生理学系,河北 唐山 063000;2中日友好医院临床医学研究所,北京 100029;3涿州市医院病理科, 河北 涿州 072750)
目的建立胰岛素瘤的动物模型并分析其特性,为胰岛素瘤的深入研究奠定实验基础。方法首先检测体外培养的大鼠胰岛素瘤细胞株INS-1的激素释放能力,然后将INS-1细胞移植到裸鼠左肾包膜下,或在移植后18 d或在移植前3 d联合腹腔注射链脲佐菌素(STZ)破坏动物自身胰岛。尾静脉采血检测血糖,当血糖<2.8 mmol/L认为胰岛素瘤模型建立。对各种条件建立的模型,观察给予不同刺激物对血糖的影响以及动物血清中胰岛素含量;并对动物胰腺组织和移植细胞的肾脏组织标本进行免疫组化染色检测胰岛素和胰高血糖素。结果胰岛素瘤细胞既表达胰岛素,同时也表达胰高血糖素。裸鼠接种INS-1细胞后3~4周血糖<2.8 mmol/L;移植肾脏明显增大,形成明显肿瘤,直径≥1 cm。细胞移植后腹腔注射STZ的动物,血糖短暂回升,超过正常血糖水平,之后又逐渐下降,约2周后血糖<2.8 mmol/L。正常裸鼠给予STZ后血糖明显升高,移植INS-1细胞后动物血糖逐渐下降,约4周后血糖降至2.8 mmol/L。与正常对照组相比,3种方法建立的胰岛素瘤模型给予高糖后,动物血糖峰值低。高糖加精氨酸或乙酰胆碱刺激后,正常动物血糖峰值较单纯高糖刺激降低,并较快降至正常水平,但3种胰岛素瘤模型组血糖升高均明显超过单纯高糖刺激者。高糖加去甲肾上腺素刺激后,正常动物血糖达到峰值时间延迟,血糖水平下降缓慢,3种胰岛素瘤模型组血糖较单纯高糖刺激组有所升高。与正常对照组相比,3种胰岛素瘤模型血浆基础胰岛素的水平明显升高。结论通过给裸鼠肾包膜下移植INS-1细胞,可建立胰岛素瘤动物模型,且瘤细胞同时表达胰岛素和胰高血糖素,不易被STZ破坏。该模型为进一步探讨胰岛素瘤的发病机制奠定实验基础。
胰岛素瘤; 模型,动物; INS-1细胞; 葡萄糖
胰岛素瘤是来源于胰岛β细胞的肿瘤,是功能性胰腺内分泌肿瘤中最常见的一种[1- 2],具有较强的自主分泌胰岛素能力,临床上多表现为低血糖反复发作并逐渐加重,严重时可危及生命。低血糖导致自主神经过度兴奋症状和神经缺糖症状[3],长期低血糖症状反复发作,将导致大脑和神经系统不可逆的营养不良性退行性改变,可使病人智力低下,行为异常甚至痴呆、丧失劳动力[4- 6]。其诊断依靠Whipple诊断三联征[即典型的低血糖症状发作,发作时血糖低于2.8 mmol/L (500 mg/L),摄入葡萄糖可使症状迅速缓解][7- 8]和实验室检查。临床上此病极易被误诊,有报道超过40%的胰岛素瘤病例初诊为神经系统疾病[9]。因此,提高对胰岛素瘤的认识并及时诊治具有重要意义。由于缺乏合适的动物模型,对胰岛素瘤发病机制的了解甚少,该类肿瘤的生物学特性尚有待研究。本研究采用裸鼠肾包膜下移植大鼠胰岛素瘤细胞株INS-1成功建立了胰岛素瘤的动物模型,并初步观察了肿瘤的特性,为深入研究胰岛素瘤的发病机制和诊断方法奠定实验基础。
材 料 和 方 法
1材料
1.1细胞 INS-1细胞(大鼠胰岛素瘤细胞)、INR-1G9细胞(胰岛α细胞)、r9细胞(INS-1的单细胞克隆)、人胰岛素瘤细胞和HK- 2细胞(人近端肾小管上皮细胞)。
1.2动物nu/nu裸鼠[购自北京维通利华实验动物技术有限公司 ,动物合格证号为SCXK (京)2006-0009],6~8周龄,体重20~25 g,均为雄性,无特定病原体条件下饲养。
1.3主要试剂 RPMI-1640培养基(Gibco),胎牛血清(Gibco),胰蛋白酶(Sigma),链脲佐菌素(streptozocin,STZ;Sigma),葡萄糖(中国大冢制药有限公司),精氨酸(上海信谊药业有限公司 ),去甲肾上腺素(上海禾丰制药有限公司),乙酰胆碱(TGI),胰岛素ELISA试剂盒(Millipore),兔抗胰岛素多克隆抗体(Santa Cruz),羊抗胰高血糖素多克隆抗体(Santa Cruz),总RNA提取试剂盒(Promega),BCA法蛋白测定试剂盒(碧云天公司),ECL化学发光试剂(Millipore)。
2方法
2.1细胞培养 INS-1细胞、INR-1G9细胞、r9细胞和人胰岛素瘤细胞用RPMI-1640培养基(内含10%胎牛血清,1×105U/L青霉素,100 mg/L链霉素, 5.5 mmol/L葡萄糖,10 mmol/L HEPES, 50 μmol/L β-巯基乙醇,1 mmol/L丙酮酸钠),其中r9细胞培养时另外添加100 mg/L G418;HK- 2细胞用DMEM/F12培养基(内含10%胎牛血清,1×105U/L青霉素,100 mg/L链霉素),各种细胞于5% CO2、37 ℃培养箱培养 。待细胞生长至汇合时用0.025%胰蛋白酶/0.025% EDTA 传代。
2.2胰岛素瘤细胞的特性分析
2.2.1RT-PCR 将正常培养的INS-1细胞、r9细胞、INR-1G9细胞、人胰岛素瘤细胞和HK- 2细胞各1×106个,使用总 RNA 提取试剂盒、逆转录试剂盒和PCR试剂盒进行总 RNA 的提取、逆转录和PCR,引物序列见表1。之后进行琼脂糖凝胶电泳,紫外灯下观察条带,凝胶成像系统拍照记录。

表1 PCR 扩增反应引物及产物大小
2.2.2Western blotting 将正常培养的INS-1细胞、r9细胞、INR-1G9细胞、人胰岛素瘤细胞 和HK- 2细胞各5×106个提取总蛋白,采用BCA蛋白浓度测定试剂盒测定蛋白浓度。取30 μg总蛋白进行聚丙烯酰胺凝胶电泳(SDS-PAGE)后,将蛋白转印至PVDF膜,用含5%脱脂奶粉的TBST室温封闭2 h,洗膜后分别加入鼠抗β-actin抗血清、兔抗胰岛素抗血清、羊抗胰高血糖素抗血清4 ℃杂交过夜。洗膜后,用辣根过氧化物酶标记的相应Ⅱ抗杂交。使用ECL化学发光试剂显色,暗室曝光成像。
2.2.3ELISA方法INS-1细胞胰岛素和胰高血糖素释放的检测 INS-1细胞以2×108/L的密度接种于24孔培养板中,应用正常培养基培养3 d后,用含2.5 mmol/L 葡萄糖的培养基平衡5 h,然后用KRBH液 (mmol/L: 140 NaCl, 3.6 KCl, 0.5 NaH2PO4·2H2O, 0.5 MgSO4·7H2O, 1.5 CaCl2, 2 NaHCO3, 10 HEPES, 0.1% BSA)洗2次,再分别换成含下列物质的KRBH液:20 mmol/L 葡萄糖(glucose,G)、20 mmol/L G+20 mmol/L 精氨酸(arginine,Arg)、20 mmol/L G+40 μmol/L 去甲肾上腺素(norepinephrine,NE)或 20 mmol/L G+ 1 mmol/L 乙酰胆碱(acetylcholine,ACh),培养30 min 后收集上清液,用于胰岛素和胰高血糖素的测定。胰岛素的测定采用ELISA方法,胰高血糖素采用放射免疫法测定。
2.3胰岛素瘤动物模型的建立
2.3.1细胞准备 刮取培养的INS-1细胞,用基础培养基洗2次,再加入基础培养基制成细胞悬液,吸入头皮针中,离心,将细胞离心到针端,每只裸鼠移植细胞数约2×107。
2.3.2模型建立方法和动物分组 使用3种方法建立胰岛素瘤模型,具体方法是: (1)单独细胞移植:将上述准备好的INS-1细胞移植到裸鼠左肾包膜下,以假手术组作为对照。(2)细胞移植后联合STZ腹腔注射:同上进行细胞移植,待动物血糖降至4 mmol/L左右时腹腔注射STZ溶液(200 mg/kg);另以同样移植但不注射STZ的和正常裸鼠同时同样方法腹腔注射STZ作为对照。(3)STZ给药后进行细胞移植:将正常裸鼠禁食12 h,给予STZ (200 mg/kg)腹腔注射,72 h后开始测定血糖,血糖连续3 d>20 mmol/L,成为糖尿病鼠;将其分为2组,一组在左肾包膜下移植INS-1细胞(细胞量同上),另一组进行假手术作为对照。以上各组每组4只动物。
2.3.3尾静脉采血监测各组动物血糖 当模型组动物的血糖明显降低至<2.8 mmol/L后,以10%糖水代替普通饮水,继续监测血糖,3 d后开始,各组动物在隔天下午分别给予葡萄糖(4 g/kg)、精氨酸(500 mg/kg)+葡萄糖(4 g/kg)、去甲肾上腺素(8 mg/kg)+ 葡萄糖(4 g/kg)或乙酰胆碱(10 mg/kg)+ 葡萄糖(4 g/kg),分别在0、5、10、15、20、30、40和60 min时测其血糖。
2.4免疫组织化学染色 处死动物,取血,采用ELISA方法测定血清中胰岛素的含量。取胰腺和移植细胞的肾脏固定于10%甲醛,制备石蜡切片。经常规脱蜡、水化,微波热修复,3%过氧化氢溶液封闭内源性过氧化物酶。Ⅰ抗分别使用兔抗小鼠胰岛素抗血清、羊抗小鼠胰高血糖素抗血清,4 ℃孵育过夜,Ⅱ抗使用辣根过氧化物酶标记的羊抗兔IgG抗体或兔抗羊IgG抗体,37 ℃ 30 min,DAB显色,苏木精复染,脱水、透明封片后镜检。
3统计学处理
应用SPSS 17.0软件进行统计学分析。数据以均数±标准差(mean±SD)表示,两组间比较采用独立样本t检验。多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1胰岛素瘤细胞的特性分析
RT-PCR(图1A)和Western blotting(图1B)结果显示,INS-1细胞及INS-1的单克隆细胞株r9细胞均同时表达胰岛素和胰高血糖素,并且人胰岛素瘤细胞也具有同样特点。但作为对照的INR-1G9细胞只表达胰高血糖素,而肾小管上皮细胞HK- 2细胞则两者都不表达。胰岛素释放实验(图1C)结果显示, 给予高糖刺激时,INS-1细胞的胰岛素和胰高血糖素分泌增加,精氨酸和乙酰胆碱对高糖诱导的胰岛素和胰高血糖素释放起到促进作用,而去甲肾上腺素起到抑制作用。
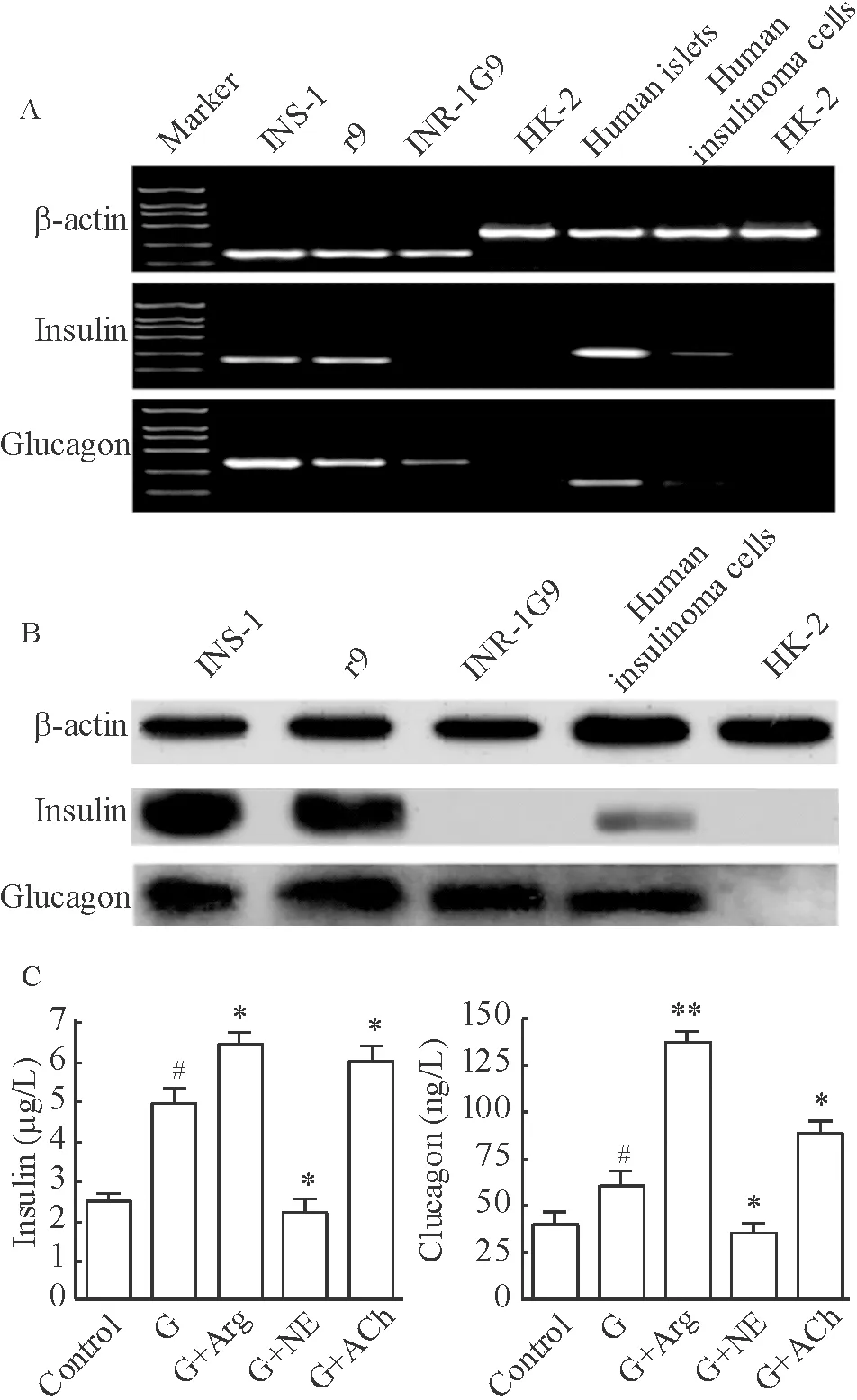
Figure 1. Analysis of insulin and glucagon of insulinoma cells. A: RT-PCR; B: Western blotting; C: ELISA. G: glucose; G+Arg: glucose+arginine; G+NE: glucose+norepinephrine; G+ACh: glucose+acetylcholine. Mean±SD.n=3.#P<0.05vscontrol group;*P<0.05,**P<0.01vsG group.
图1胰岛素瘤细胞的特性分析
2胰岛素瘤动物模型的建立
2.1单纯移植INS-1细胞组血糖变化 与假手术组相比,左肾包膜下移植INS-1细胞的裸鼠,血糖在2周后开始下降,3周时血糖<2.8 mmol/L,此后一直维持该水平,见图2A。
2.2INS-1细胞移植后注射STZ对血糖水平的影响 移植INS-1裸鼠血糖降至正常一半[(4.03±0.49)mmol/L]时(约18 d时)腹腔注射STZ,血糖在STZ给药后3 d开始上升,最高可上升到(16.80±4.84)mmol/L,之后逐渐下降,在注射STZ后约2周时血糖达到<2.8 mmol/L[(2.10±0.44)mmol/L];而仅移植INS-1组的裸鼠血糖逐渐降低,3周时血糖(2.30±0.55)mmol/L,之后一直处于低血糖状态;正常裸鼠腹腔注射STZ后,血糖3~5d时明显上升,出现高血糖[(27.80±1.22)mmol/L],之后一直处于高血糖状态,见图2B。
2.3INS-1细胞移植到糖尿病裸鼠后血糖水平的变化 腹腔注射STZ 3 d后,动物血糖水平均明显升高,达20 mmol/L以上。移植INS-1细胞后,裸鼠血糖逐渐减低,在4周后血糖<2.8 mmol/L,见图2C。
2.4胰岛素瘤的成瘤检查 当裸鼠血糖<2.8 mmol/L后,处死各组的裸鼠,检查移植细胞在肾脏局部成瘤情况,可见与右肾相比,移植细胞的左肾明显增大,形态不规则,表面凹凸不平,形成明显肿瘤,直径≥1 cm,见图2D。
3比较各种胰岛素瘤动物模型糖耐量情况
正常裸鼠(图3A)和3种方法建立的胰岛素瘤模型[单纯移植INS-1细胞(图3B)、移植INS-1细胞后注射STZ(图3C)以及注射STZ后移植INS-1细胞(图3D)]给予高糖后,正常动物血糖在15 min左右上升到20 mmol/L以上,但3种胰岛素瘤模型动物血糖峰值明显降低,在8 mmol/L左右。高糖加精氨酸或乙酰胆碱刺激后,正常动物血糖峰值较单纯高糖刺激的降低,并较快降至正常水平,但3种胰岛素瘤模型组血糖升高均明显超过单纯高糖刺激者。高糖加去甲肾上腺素刺激后,正常动物血糖达到峰值时间延迟,血糖水平下降缓慢,3种胰岛素瘤模型组血糖较单纯高糖刺激组有所升高。
4胰岛素瘤模型血浆基础胰岛素水平
正常裸鼠血浆中胰岛素水平较低[(1.25±0.55)μg/L],与正常对照组相比,3种方法建立的胰岛素瘤动物血浆中胰岛素的水平明显升高,分别为(10.67±0.85)μg/L、(8.13±1.15) μg/L和(4.61±0.85)μg/L,见图4。

Figure 2. Establishment of insulinoma animal models. A: the changes of blood glucose after INS-1 cells were transplanted into the left kidney capsule of nude mice; B: the changes of blood glucose after intraperitoneal injection of STZ in nude mice transplanted with INS-1 cells; C: the changes of blood glucose after INS-1 cells were transplanted into the left kidney capsule of diabetic nude mice; D: tumorigenicity after INS-1 cells were transplanted into the left kidney capsule in different groups of nude mice. 1,3,5,7: the right kidney; 2,4,6,8: the left kidney.Mean±SD.n=4.*P<0.05.**P<0.01vsN or N+STZ group.
图2胰岛素瘤动物模型的建立
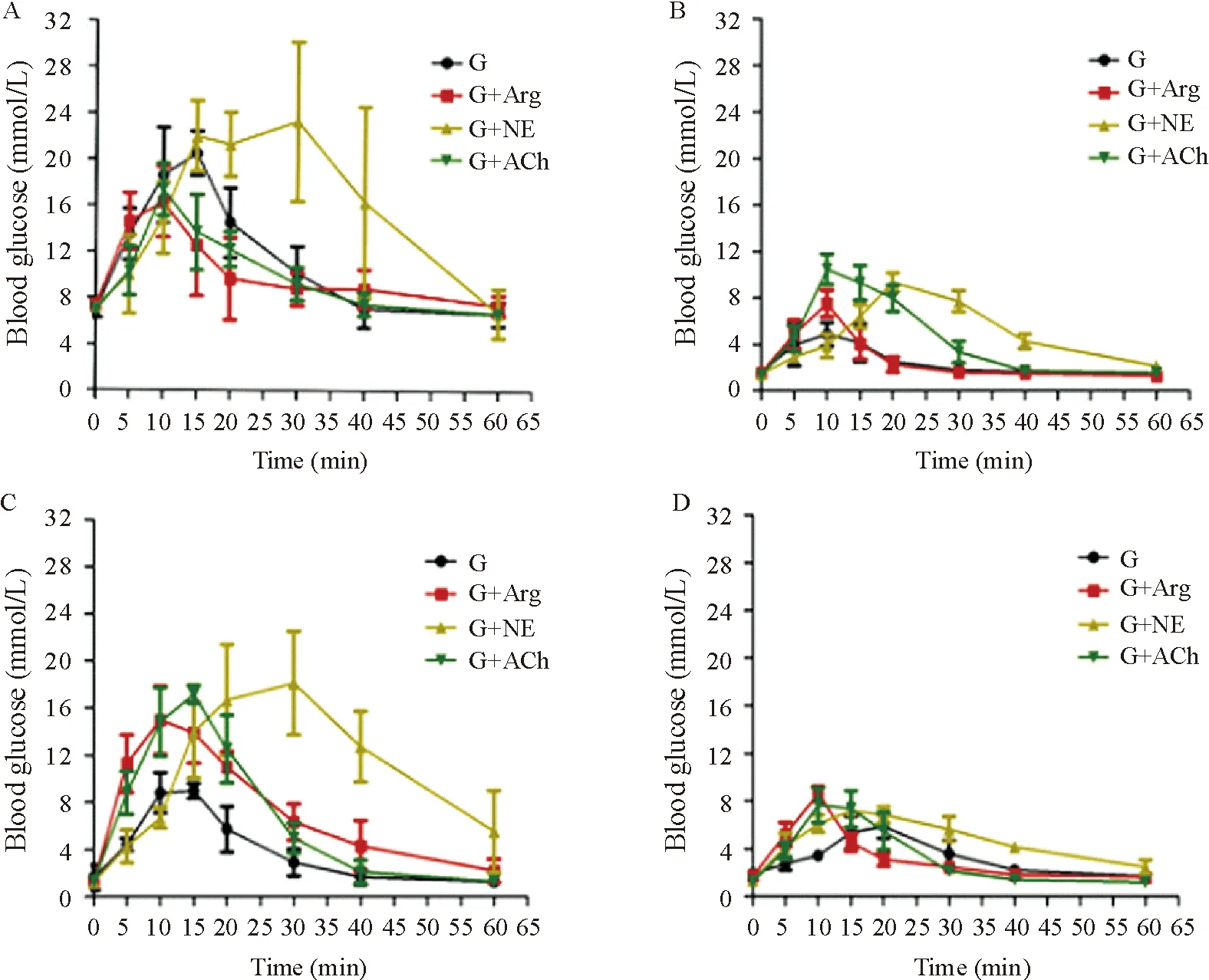
Figure 3. Different animal models of insulinoma response to different stimuli.A: normal nude mice; B: transplantation of INS-1 cells; C: injection of STZ after transplantation of INS-1 insulinoma model; D: transplantation of INS-1 cells after STZ injection. G: glucose; G+Arg: glucose+arginine; G+NE: glucose+norepinephrine; G+ACh: glucose+acetylcholine. Mean±SD.n=4.
图3不同胰岛素瘤动物模型对不同刺激物的反应
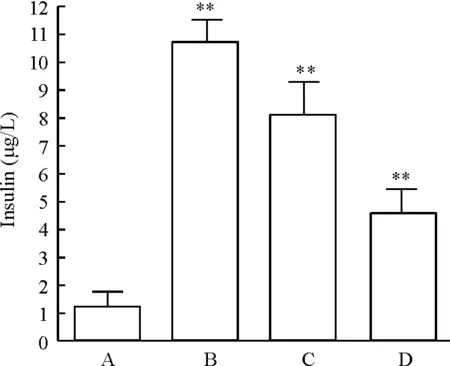
Figure 4. Comparison of plasma basal insulin levels in different insulinoma models. A: normal nude mice; B: transplantation of INS-1 cells; C: injection of STZ after transplantation of INS-1 cells; D: transplantation of INS-1 cells after STZ injection. Mean±SD.n=4.**P<0.01vsA group.
图4比较不同胰岛素瘤模型血浆基础胰岛素水平
5移植瘤的病理学检查
移植INS-1细胞的裸鼠肾脏比正常肾脏明显增大,表面凸凹不平,形成明显肿瘤。组织学检查证实胰岛素瘤的形成(图5A),移植瘤的免疫组织化学染色发现组织中表达胰岛素(图5B)和胰高血糖素(图5C)。
6INS-1细胞移植联合STZ给药建模动物胰岛素和胰高血糖素的表达
正常胰腺表达胰岛素和胰高血糖素,而移植INS-1细胞并腹腔注射STZ裸鼠的胰腺未检测到胰岛素,只检测到胰高血糖素表达;但移植部位的INS-1细胞仍然高表达胰岛素和胰高血糖素,见图6。
讨 论
胰岛素瘤是最常见的胰腺内分泌肿瘤之一,具有胰岛素过度分泌功能,可引起反复发作性低血糖和低糖造成中枢神经系统障碍等一系列临床表现。目前其发病机制不清,临床上极易误诊。本研究利用将INS-1细胞移植到裸鼠体内成功建立了胰岛素瘤的动物模型,并对其特性进行了初步分析,为研究其发病机制和诊断方法奠定实验基础。
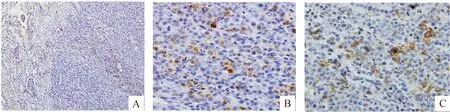
Figure 5. HE and immunohistochemical staining in the insulinoma model of transplantation of INS-1 cells. A: HE staining of the transplanted tumors (×200); B: staining of insulin in the transplanted tumors (×400); C: staining of glucagon in the transplanted tumors (×400).
图5移植INS-1细胞的胰岛素瘤模型的免疫组化染色分析
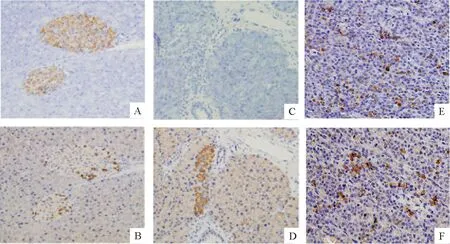
Figure 6. Immunohistochemical staining in the insulinoma model of STZ injection after INS-1 cell transplantation (×200). A,B: normal pancreas; C,D:pancreas from INS-1+STZ mice; E,F:transplanted INS-1 cells.A,C,E:staining of insulin; B,D,F:staining of glucagon.
图6INS-1细胞移植联合STZ注射的胰岛素瘤模型的免疫组化染色
我们首先检测了体外培养的INS-1细胞的胰岛素分泌能力。娄晋宁教授等前期研究发现INS-1细胞只表达胰岛素,而本实验结果显示INS-1细胞不仅表达和释放胰岛素而且表达和释放胰高血糖素。为分析原因,我们还检测了INS-1的单克隆细胞株 r9细胞,以及原代分离的人胰岛素瘤细胞,发现后两者也同时表达胰岛素和胰高血糖素。以往的研究发现,正常情况下,胰岛α细胞对胰岛β细胞的存活和胰岛素分泌具有支持作用[10]。也有报道胰高血糖素对胰岛β细胞的增殖和胰岛素分泌具有促进作用[11],因此同时表达胰高血糖素对胰岛素瘤细胞的存活和功能可能起到重要作用。
为建立胰岛素瘤的动物模型,我们将INS-1细胞移植到裸鼠肾包膜下,在大约3周时动物血糖即降至2.8 mmol/L以下,组织病理学检查也证实移植局部肿瘤形成。为使模型在整体水平反映胰岛素瘤的特性,我们在建模过程中用STZ破坏动物自身胰岛,此时动物血糖的变化可反映胰岛素瘤的功能。在移植INS-1细胞后给予STZ或先给予STZ后再移植INS-1细胞均可使动物血糖降至2.8 mmol/L以下,因此可以认为胰岛素瘤模型建立成功。
随后对所建立的3种胰岛素瘤模型分泌胰岛素特性进行了初步分析,当给予高糖刺激后,正常动物血糖迅速升高后逐渐降低至正常水平,但胰岛素瘤组血糖峰值较低,曲线较低平,与临床胰岛素瘤患者糖耐量曲线低平的特点相符合[12]。给予高糖加精氨酸刺激时,正常动物血糖峰值降低且较快恢复至正常水平,但胰岛素瘤模型组血糖峰值不降反升,结合体外实验发现胰岛素瘤细胞同时表达胰岛素和胰高血糖素,推测是精氨酸刺激使2种激素释放均增加的结果。
精氨酸作为一种非葡萄糖刺激物,带有正电荷,能加强胰岛β细胞膜的去极化,使钙通道开放,钙离子内流,促进已储存的胰岛素释放,可用来评估胰岛β细胞功能[13-15],同时精氨酸和葡萄糖有协同作用。有文献报道:糖尿病及糖耐量受损患者精氨酸负荷后胰高血糖素水平升高,病程较长的1型糖尿病患者精氨酸刺激后胰岛素反应消失,但保持正常的胰高血糖素反应[16],提示精氨酸对胰岛α细胞也具有较强的兴奋作用,促进胰高血糖素分泌。本研究结果也提示精氨酸能促进胰岛素瘤细胞同时释放胰岛素和胰高血糖素。
此外,我们还研究了去甲肾上腺素和乙酰胆碱对INS-1细胞功能的影响。去甲肾上腺素和乙酰胆碱是体内重要的神经递质,也是调节胰岛素分泌的重要物质[17]。乙酰胆碱促进胰岛素分泌[18-19],而去甲肾上腺素抑制胰岛素分泌[20- 21]。本研究结果显示,乙酰胆碱与精氨酸的作用相似,不仅促进胰岛素释放,而且同时促进胰高血糖素的释放;去甲肾上腺素抑制胰岛素分泌的同时还抑制胰高血糖素的释放。
我们进一步发现胰岛素瘤动物血中基础胰岛素水平明显高于正常,这可能是造成动物低血糖和即使给予高糖后血糖峰值也很低的原因。在移植INS-1后再给予STZ,可以破坏动物自身胰岛,但对移植的细胞影响不大,说明胰岛素瘤细胞对STZ具有一定的抵抗作用。
综上所述,通过移植INS-1细胞可以成功建立胰岛素瘤动物模型,该模型具有临床胰岛素瘤的特点,适用于对胰岛素瘤的深入研究。尤其是INS-1细胞移植后注射STZ组将自身胰岛破坏,但对移植细胞影响小,更适用于胰岛素瘤的深入研究。此外,胰岛素瘤细胞不仅表达胰岛素还表达胰高血糖素,同时表达胰高血糖素是否对瘤细胞的成瘤性和功能具有影响还有待进一步研究。
[1] Varas M, Gornals J, Ponseti JM, et al. Pancreatic endocrine tumors or apudomas[J]. Rev Esp Enferm Dig,2011,103(4):184-190.
[2] Öberg K. Pancreatic endocrine tumors[J]. Semin Oncol,2010,37(6): 594- 618.
[3] Grant CS. Insulinoma[J]. Best Pract Res Clin Gastroenterol,2005, 19(5): 783-798.
[4] 李 铸, 孙诚谊, 潘耀振, 等. 胰岛素瘤15例[J]. 肿瘤研究与临床, 2011, 23(5):351-352.
[5] 曾 缨, 王凌云, 郑民缨, 等. 55例胰岛素瘤所致神经精神症状的临床研究[J]. 中国神经精神疾病杂志,2006,32(2):176-178.
[6] Crespel A, Barbaud A, Andrieu JM, et al. Insulinoma presenting as pseudo-drug-resistant focal epilepsy[J]. Rev Neurol (Paris),2009,165(5):493- 495.
[7] Vaidakis D, Karoubalis J, Pappa T, et al. Pancreatic insulinoma: current issues and trends[J]. Hepatobiliary Pancreat Dis Int,2010, 9(3):234- 241.
[8] 赵玉沛, 王 欣, 杨 波, 等. 220例胰岛素瘤诊治分析[J]. 中华外科杂志,2000,38(1):10-13.
[9] 刘国强, 邱法波, 曲玉虎, 等. 胰岛素瘤的流行病学特征及诊治经验调查3 524例[J]. 世界华人消化杂志,2010,18(15):1620-1623.
[10] Bohman S, King AJ. Islet alpha cell number is maintained in microencapsulated islet transplantation[J]. Biochem Biophys Res Commun,2008,377(2):729-733.
[11] Wang T, Xiao XH, Li WH, et al. Effects of glucagon on islet β cell function in patients with diabetes mellitus[J]. Chin Med Sci J,2008,23(2):117-120.
[12] 孔燕国, 盛宏森, 钟守先. 五小时糖耐量试验在胰岛素瘤诊断中的价值[J]. 中华外科杂志,1990,26(6):331-332.
[13] Sun XH, Wang YG, Qi YQ, et al. Evaluation of the impact of genetic background on islet beta-cell function of normal glucose tolerance and newly diagnosed diabetic patients by L-arginine stimulation test[J]. Zhonghua Nei Ke Za Zhi,2010,49(1):19- 23.
[14] 马晓静, 吴松华, 项坤三, 等. 精氨酸刺激试验在不同糖代谢状态人群的临床应用[J]. 中华内分泌代谢杂志,2005,21(3):215- 218.
[15] 刘湘茹, 杨 斌, 胡德龙. 精氨酸刺激试验评估胰岛β细胞功能的临床价值[J]. 中国医师进修杂志,2010,33(19):9-12.
[16] Ahérn B, Taborsky GJ Jr,Havel PJ. Differential impairment of glucagon responses to hypoglycemia,neuroglycopenia,arginine,and carbachol in alloxan-diabetic mice[J]. Metabolism,2002,51(1):12-19.
[17] Campfield LA, Smith FJ. Neural control of insulin secretion: interaction of norepinephrine and acetylcholine[J]. Am J Physiol,1983, 244(5):R629- R634.
[18] Niwa T, Matsukawa Y, Senda T, et al. Acetylcholine activates intracellular movement of insulin granules in pancreatic β-cells via inositol triphosphate-dependent mobilization of intracellular Ca2+[J]. Diabetes, 1998,47(11):1699-1706.
[19] Gromada J, Hφy M, Renström E, et al. CaM kinase II-dependent mobilization of secretory granules underlies acetylcholine-induced stimulation of exocytosis in mouse pancreatic B-cells[J].J Physiol,1999,518(3):745-759.
[20] Sher E, Codignola A, Rogers M, et al. Noradrenaline inhibition of Ca2+channels and secretion in single patch-clamped insulinoma cells[J]. FEBS Lett, 1996, 385(3):176-180.
[21] Liang Y, Cincotta AH. Increased responsiveness to the hyperglycemic, hyperglucagonemic and hyperinsulinemic effects of circulating norepinephrine inob/obmice[J]. Int J Obes Relat Metab Disord, 2001,25(5):698-704.
Establishmentofinsulinomaanimalmodelsandobservationoftumorcharacteristics
CHENG Lan-yun1,3, XU Shi-qing2, ZHANG Wen-jian2, LOU Jin-ning2, MEN Xiu-li1
(1DepartmentofPathophysiology,SchoolofBasicMedicine,HebeiUnitedUniversity,Tangshan063000,China;2InstituteofClinicalMedicine,China-JapanFriendshipHospital,Beijing100029,China;3DepartmentofPathology,ZhuozhouCity’sHospital,Zhuozhou072750,China.E-mail:xiulimen@126.com)
AIM: To establish the animal model of insulinoma and to analyze the properties of insulinoma for further study.METHODSThe hormone-releasing ability of rat insulinoma cell line INS-1 was detectedinvitro. INS-1 cells were transplanted into the left kidney capsule of nude mice. The islets of the animals were destroyed by intraperitoneal injection of streptozocin (STZ) 3 d before transplantation or 2 weeks after transplantation. The venous blood was sampled, and the level of blood glucose less than 2.8 mmol/L was defined as successful establishment of insulinoma model. Different irritants were given to the model animals, and the changes of blood glucose and insulin content in serum were observed. The pancreatic tissues and the renal tissues in the injecting sites were taken from all mice for detecting insulin and glucagon by immunohistochemical staining.RESULTSInsulinoma cells expressed insulin and glucagon at the same time. The blood glucose was less than 2.8 mmol/L 3 to 4 weeks after inoculation of INS-1 cells. Apparent tumor formed in the left kidneys where INS-1 cells were transplanted and the tumor diameters were more than 1 cm. The level of blood glucose transiently increased to higher than the normal level in the mice with tumor cell transplantation after intraperitoneal injection of STZ, and then decreased gradually and returned to less than 2.8 mmol/L after 2 weeks. The level of blood glucose in the normal nude mice after administration of STZ increased significantly. After transplantation of INS-1 cells, the level of blood glucose decreased gradually, and returned to less than 2.8 mmol/L after 4 weeks. After stimulated with high glucose, the blood glucose levels in the mice with 3 methods to establish the insulinoma models showed lower glucose peaks than that in the normal control mice. After stimulated with high glucose plus arginine or acetylcholine in the normal animals, the blood glucose peak was lower than that in the normal animals only stimulated with high glucose, and rapidly recovered to the normal level. However, the levels of blood glucose in the mice with 3 methods to establish the insulinoma models under the same stimulations were significantly higher than that in the mice only stimulated with high glucose. After stimulated with high glucose plus norepinephrine, the blood glucose peak time in the normal animals delayed, and the blood glucose level declined slowly. After stimulated with high glucose plus norepinephrine, the levels of blood glucose in the mice with 3 methods to establish the insulinoma models increased as compared with that in the mice only stimulated with high glucose. Compared with normal control group, serum insulin in insulinoma mice increased significantly.CONCLUSIONThe insulinoma animal model is successfully established by transplantation of INS-1 cells into the renal capsule of nude mice. The insulinoma cells express both insulin and glucagon, and are not easily damaged by STZ.
Insulinoma; Models, animal; INS-1 cells; Glucose
R736.7
A
10.3969/j.issn.1000- 4718.2013.04.034
1000- 4718(2013)04- 0761- 08
2012- 09- 08
2013- 03- 14
国家自然科学基金资助项目(No.30971410)
△通讯作者 Tel: 0315-3725612; E-mail: xiulimen@126.com

