有机光热转换纳米材料的研究进展
张红卫,孔 斌,方时超,张 晨,周治国,杨仕平
(上海师范大学生命与环境科学学院,上海200234)
0 引言
癌症已经取代心脏疾病成为全球死亡的首要原因[1-2].根据世界癌症报告,在2008年约760万人死于癌症,到2020年,癌症发病率可能会进一步增加至50%,增加15万新发病例.目前临床上的癌症疗法是有限的放疗、化疗等手术.但这些方法承担着杀死正常细胞,破坏免疫系统,增加第二癌症发病率的风险[3-5].光热治疗是一种新兴的用于治疗癌症的高选择性和微创技术[6].其治疗作用只发生在肿瘤部位,通过光热治疗(PTT)试剂积累和局部近红外(NIR)的激光照射,有效避免了上述风险.这种技术与传统的技术相比,还具有其他一些潜在的优势,包括过程简便、恢复快、并发症少、住院时间短[7].
肿瘤光热治疗,最近几年越来越为研究者所青睐,这是因为光热治疗高效.而光热治疗,大部分都得借助光热试剂这一介质.研究者发现很多材料在近红外有很好的吸收,并且能很好的将近红外光的能量转变为热能.其光热原理是:材料吸收光子后,一部分能量以光子的形式释放出去,一部分则转变为材料自身的热能,以热量的形式释放出去,故而,材料在近红外有吸收,不一定就是理想的光热试剂,这就需要材料自身有较理想的光热转换效率.其次,光热试剂本身必须具有良好的生物相容性,以及无毒副作用.光热试剂,人们研究较多的主要有金属基材料,碳基材料以及有机材料.这些材料大部分都有良好的光热转换效率,但一部分又存在着不足.
当前可用的光热治疗试剂主要集中在以金、银、钯为基础的新型金属纳米粒子[8],以铜为基础的半导体纳米粒子[9],碳基纳米材料[10]和有机聚合物[11].虽然能够有效治疗癌症,但这些药物尚未达到临床实施,因为其长期安全性受到极大的关注.例如,金属纳米粒子的生物代谢差,与金属本身安全相关的问题,而碳基纳米材料已被证明能够诱使许多毒性反应,例如氧化应激和肺部发炎[12].开发由在生物体中天然存在的物质组成的光热治疗试剂,对其体内应用,将是非常有益的,因为它可以有效地避免异物在患者体内长期保留引起的严重不良影响,并且对这些药物的生物降解也可以通过新陈代谢实现.现今,人们对于光热试剂的研究,大部分都聚焦到有机光热试剂及其复合材料上,因为该类材料在解决传统的问题外,还能够实现材料的多功能化.本文作者主要综述了有机光热转换纳米材料的研究进展.
1 有机光热试剂
1.1 聚吡咯(PPy)类光热试剂
1.1.1 聚吡咯
有机导电聚合物,由于其高生产力和良好的稳定性,已被广泛应用于有机电子产品.另外,又凭借其较强的近红外吸收,聚吡咯纳米粒子也被应用于军事领域等.聚吡咯纳米材料还被用于生物传感,药物输送和神经再生等领域.由于其较强的近红外吸收,Liu等[13]用微乳液法,用聚乙烯醇(PVA)做稳定剂,获得PVA涂层的聚吡咯纳米颗粒,通过体内体外实验,发现材料具有良好的光热治疗效果,如图1.
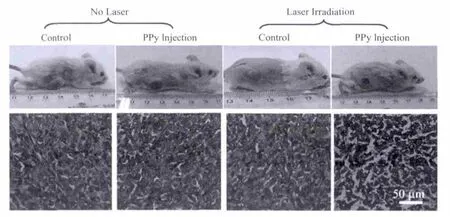
图1 聚吡咯肿瘤注射(剂量2 mg/kg)光热治疗后(治疗周期16 d),小鼠肿瘤及其切片H&E染色效果
1.1.2 PPy@Fe3O4
随后,Liu等[14]又尝试将PPy包裹到Fe3O4表面,再将安霉素接到PEG修饰过的该材料表面,从而达到集核磁、光热、药释于一体的多功能材料,材料合成示意图如图2.该模式下,形成了通过磁场远程控制的靶向光热和药物协同治疗试剂.
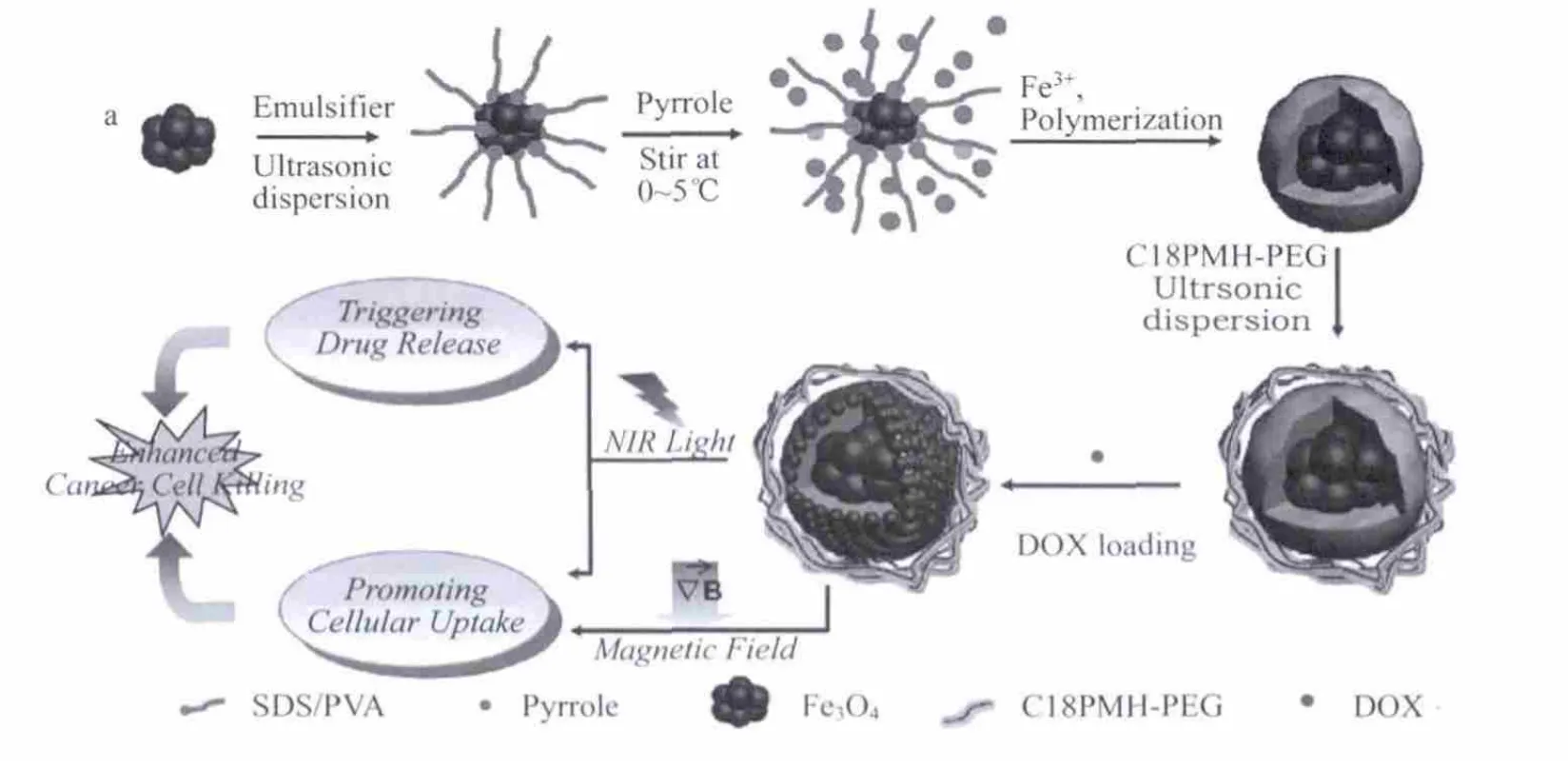
图2 PPy@Fe3 O4的合成示意图及药物释放和光热治疗示意图
1.2 吲哚菁绿(ICG)染料光热试剂
吲哚菁绿染料分子是一个大的π共扼体系,这种基本结构特征决定了染料的主要吸收在600~850 nm范围(图3).由于吲哚菁绿染料在近红外区存在吸收,激光照射后,吲哚菁绿染料电子的能量增加,就会发生电子跃迁,由基态跃迁至单线激发态,当电子由单线激发态回落至基态时,能量就会以光和热能的形式释放出来,因此使得该类化合物具有发射荧光和光热转换的能力.另外它的摩尔消光系数高、荧光量子产率高、稳定性较好、熔点低以及最大吸收波长可调谐范围大等特点,同时,ICG是美国FDA批准的唯一的可以用于临床诊断的具有近红外光学特性的分子.
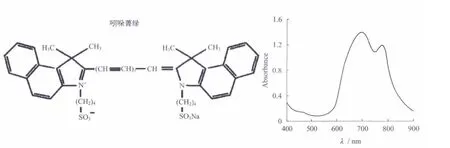
图3 吲哚菁绿的结构示意图和紫外近红外的吸收图
但是ICG具有浓度依赖的聚集,较差的稳定性,非特异性的蛋白结合以及缺少靶向,ICG在生物体内会快速降解,半衰期只有2~4 min[15].故而需要改善吲哚菁绿染料的水溶性和生物兼容性问题[16].Yu等用聚烯丙胺盐酸盐包覆ICG,通过控制温度和溶剂的量得到不同尺寸的胶囊,该类材料分散性、稳定性得到大大改善,有利于光热成像和治疗(图4).
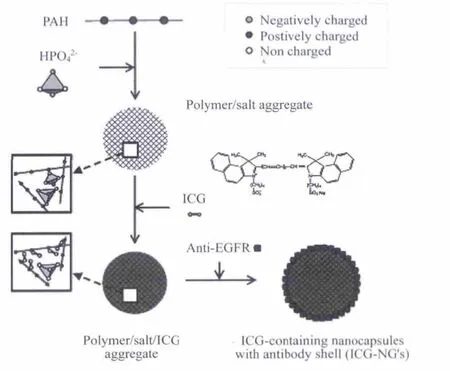
图4 聚烯丙胺盐酸盐包覆ICG的流程示意图
1.3 聚苯胺类光热试剂
聚苯胺是一类用于研究细胞增殖的电活性物质,因而具有非常好的生物兼容性.并且其吸收峰容易受到掺杂剂(如强酸、路易士酸、过渡金属以及碱粒子等)的影响而发生移动,因为这些掺杂能在聚苯胺的价带与导带之间产生一个能带,从而迫使电子发生移动,降低了激发态能级,所以当聚苯胺的上亚胺基团转变成亚胺盐时,其吸收峰将红移到近红外区域.而这种具有近红外吸收的聚苯胺的亚胺盐就可以很好的用于光热治疗.基于聚苯胺的这种性能,Yang等[17]开发了一种新型的聚苯胺光热试剂.相对于聚苯胺亚胺,聚苯胺亚胺盐的近红外吸收有了明显红移,最强吸收峰有570 nm红移到了780 nm左右,在整个近红外区域都有了明显吸收,并且其光热转换效果明显增强.将该光热试剂用于治疗老鼠体内的肿瘤,组织学检测实验证明具有非常好的效果(图5).
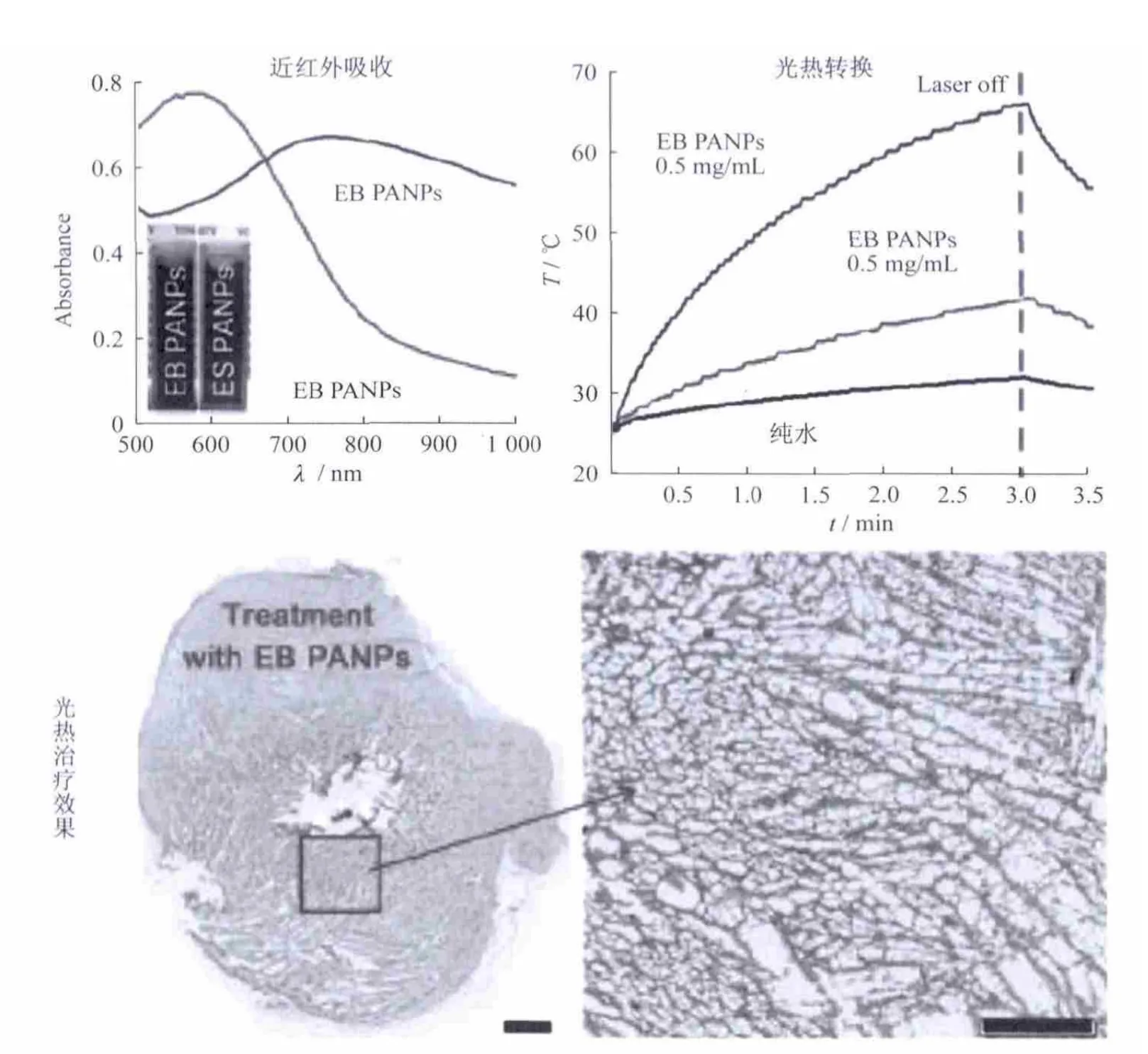
图5 聚苯胺光热转换试剂的吸收、光热转换以及光热治疗效果
1.4 多巴胺黑色素光热试剂
黑色素是一种众所周知的生物聚合物,广泛的分布在几乎所有的动物体内,它具有一些独特的功能.包括免受紫外线伤害,对于人体具有抗菌、体温调节、自由基淬灭和对神经系统的保护等功能.另外,它的吸收可以延长到近红外区,故而,Lu等人[18]将多巴胺黑色素应用于肿瘤光热治疗,他们发现多巴胺黑色素具有良好的光热效果,光热转换效率为40%,要远远高于以往报道的光热试剂的转换效率,从而在低激光功率密度和短的照射时间条件下并未损害健康组织.并且,研究中发现材料在生物体内表现出生物降解,并没有表现出毒副作用,光热治疗效果如图6.
1.5 噻吩类光热试剂
Liu等[19]开发了一种新型的有机光热治疗制剂,在聚(3,4-乙撑二氧噻吩):聚(4-苯乙烯磺酸盐)(PEDOT:PSS)的基础上,一层一层涂上电荷并与支链聚乙二醇(PEG)共轭,所得到的PEDOT:PSS-PEG纳米粒子在生理环境中非常稳定.又进一步利用PEDOT:PSS-PEG作为PTT剂进行体内的癌症治疗,在一个较低的激光功率密度光照射下,使用全身给药,小鼠肿瘤模型的治疗疗效良好.血液测试和细致的组织学检查显示:40 d内PEDOT:PSS-PEG纳米粒子对小鼠没有明显的毒性.这项工作是导电聚合物纳米粒子在动物体内的第一次非常有效的PTT治疗,推动了人们对开发有机纳米材料进行癌症诊断应用的进一步探索.
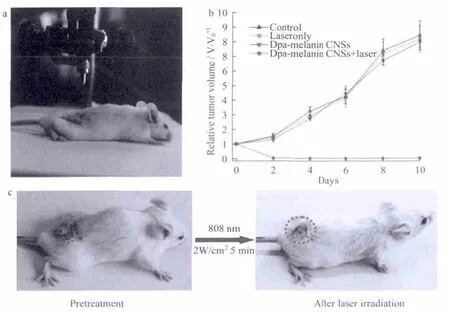
图6 多巴胺黑色素治疗小鼠效果图
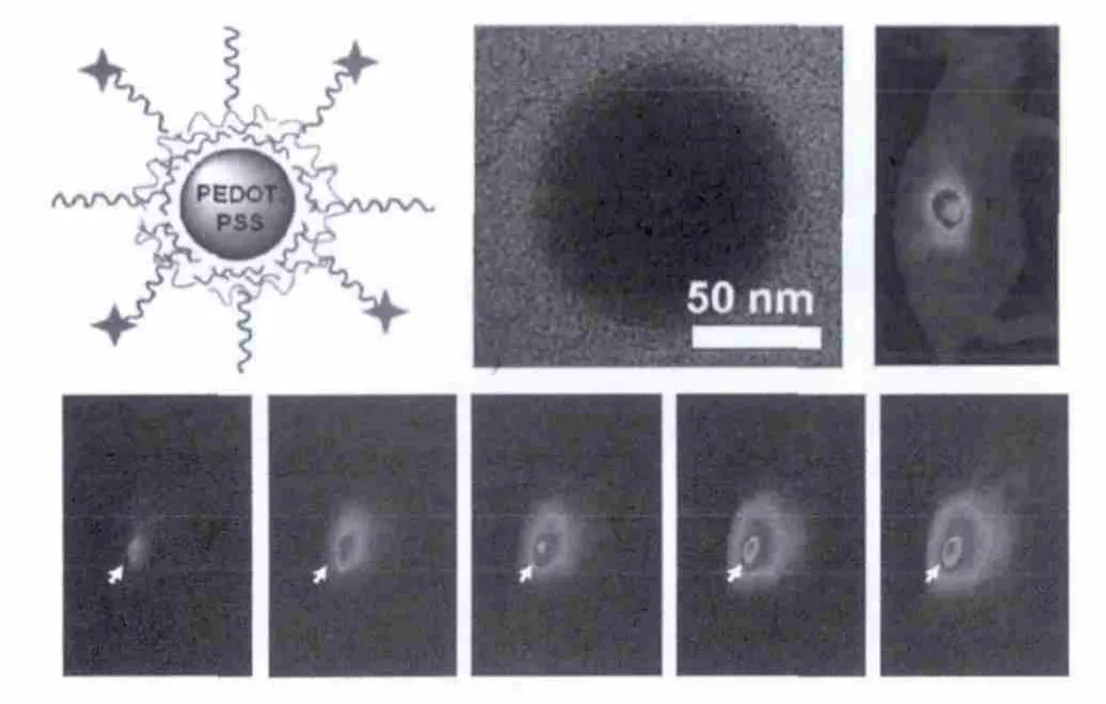
图7 PEDOT:PSS-PEG结构示意图、TEM图及其肿瘤模型不同时间段的光热成像图
2 有机光热转换材料的生物应用
2.1 光热治疗
有机光热转换材料作为一种重要的光热转换材料,具有很多独特的应用,其中最重要的就是用于光热治疗.700~1100 nm的近红外区域是重要的“生物窗口”.生物体本身对这个区域的光吸收很少,因此这个区域的光具有非常好的生物组织穿透性.而有机光热转换材料对近红外光有明显的吸收作用,而且由于有机材料的电子具有明显的等离子共振效应,因此被近红外光激发的碳材料能产生明显的热效应,使周围的介质温度迅速升高.如果将有机材料直接注射到肿瘤内或者通过静脉注射的方式将带有靶向基团的碳基光热转换材料输送到肿瘤位置,然后通过激光照射肿瘤位置使肿瘤位置温度迅速升高,可以迅速地破坏肿瘤组织,而对周围正常组织的创伤非常小.
Zheng等[20]通过卟啉双层自组装形成了纳米囊泡,这种纳米囊泡具有可调谐的大消光系数,与其结构相关的荧光自猝灭和独特的光声光热性能.纳米囊泡的近红外荧光可以在解离时恢复,为低背景荧光成像创造机会.由于纳米囊泡的有机性质,在静脉注射剂量为1000 mg·kg-1的小鼠中,卟啉纳米囊泡可被小鼠体内酶降解,并且其急性毒性最小.在类似方式的脂质体中,卟啉纳米囊泡的较大水溶芯可以被动或主动加载.全身给药后,卟啉纳米囊泡可在异种移植的裸鼠肿瘤中积累,激光照射后诱导肿瘤的光热消融,如图8.具有光学性能和生物相容性的卟啉纳米囊泡已被证明是有生物成像和治疗多模态潜力的有机纳米粒子.这进一步证明了有机纳米材料在肿瘤治疗上具有非常好的应用前景.
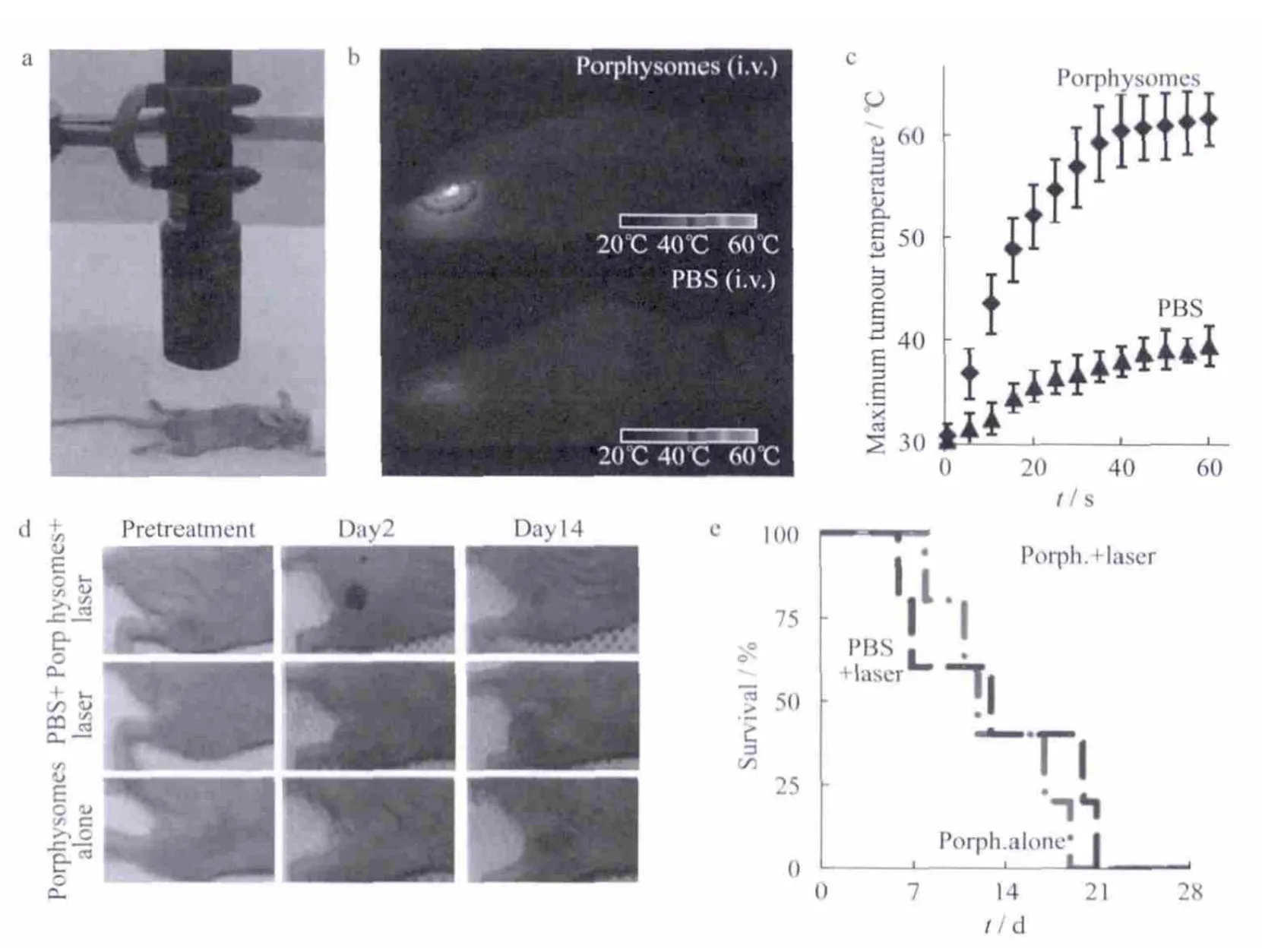
图8 卟啉纳米囊泡试剂作为光热试剂的光热治疗图(小鼠静脉注射剂量为42 mg·kg-1)
2.2 热成像
有机光热转换材料的另一种重要用途是热成像造影剂.由于近红外热像仪探测的波长范围(7.5~13μm)与近红外光热治疗的波长(680~1100 nm)无重叠,因此可以用有机材料作为热成像的造影剂.另外在光热治疗的过程中,传统的热电偶或者其他测试手段不能有效地检测激光照射位置的温度分布,给光热治疗带来了诸多不便,而热成像仪不仅可以方便地检测整个生物体的温度空间分布情况,实时监控光热治疗过程中温度的变化情况,还可以通过温度变化情况来确定治疗时所需要的激光功率、照射时间等参数,为尽可能地降低光热治疗的副作用和减轻对患者的治疗创伤提供可靠的指导.Yang等[17]展示了一种基于聚苯胺的新型纳米粒子作为有机光热剂诱导治疗上皮癌的可行性.聚苯胺的生物相容性很好,已被用来作为电活性材料研究细胞增殖[21-22],它的一个重要优点是:可以作为掺杂剂(即,强酸,路易斯酸,过渡金属,碱金属离子),诱导质子在价带和导带之间产生的带间能隙的电子的运动,并降低激发能量水平[23-25].在掺杂过程中,当聚苯胺由亚胺碱(EB)转变成亚胺盐(ES)时,其过渡吸收峰将红移到近红外区.聚苯胺对近红外光的吸收会产生大量的热能,由此可用于癌症细胞消融.由图9可以清楚地看到,所得到的热成像图具有非常高的温度分辨率,能有效地指导光热治疗.
Dai等[26]利用聚乙烯醇(PVA)作为稳定剂,在水溶液中通过一步聚合反应合成了均匀的聚吡咯纳米粒子[27-33].把三氯化铁(FeCl3)加入到PVA水溶液中,同时作为反应的氧化剂和PVA/铁阳离子的成形剂.据该文章所述,这是第一次对单分散聚吡咯纳米粒子稳定性的报道,它作为一类新的光热治疗试剂,具有良好的生物相容性,对近红外具有较强吸收,光热转换效率高和良好的耐光性.

图9 纯水、PANPs-EB(0.5 mg/mL)、PANPs-ES(0.05 mg/mL)和 PANPs-ES(0.5mg/mL)的近红外激光照射(808 nm,7 W/cm2)前后热成像对比图
3 结论和未来展望
有机纳米光热转换材料,展现了许多优点,吸收范围容易调控、可生物降解.人们已经研发了多种方法对有机纳米材料(包括吲哚菁绿、聚苯胺、聚吡咯、聚噻吩和多巴胺黑色素纳米颗粒)进行表面改性和靶向性功能化,这些有机光热转换材料在光热治疗和近红外热成像领域展现了光明的应用前景.
但目前有机光热转换材料的生物应用还处在研究的起始阶段,相关文献还比较少.下一步的研究方向主要有:(1)发展有机光热转换材料的可控合成和表面改性方法,以期得到生物兼容性更好、光热转换效率更高的有机光热纳米材料;(2)将有机光热材料与其他光热转换材料有机地结合,形成纳米复合材料,有望改善光的吸收,提高光热转换效率,为实际医学应用奠定基础.
[1]YOO D,LEE JH,SHIN T H,et al.Theranostic magnetic nanoparticles[J].Acc Chem Res,2011,44(10):863 -874.
[2]RIZIA B,SURBHI L,AMITJ,et al.Theranostic nanoshells:from probe design to imaging and treatment of cancer[J].Acc Chem Res,2011,44(10):936 -946.
[3]FORREST M,KIEVIT,ZHANG M Q,et al.Surface engineering of iron oxide nanoparticles for targeted cancer therapy[J].Acc Chem Res,2011,44(10):853 -862.
[4]VOGEL A,VENUGOPALAN V.Mechanisms of pulsed laser ablation of biological tissues[J].Chem Rev,2003,103(2):577-644.
[5]NOLSOE CP,TORP -PEDERSEN S,BURCHARTH F,et al.Interstitial hyperthermia of colorectal liver metastases with a US - guided Nd - YAG laser with a diffuser tip:A pilot clinical study[J].Radiology,1993,187(2):333 -337.
[6]LAL S,CLARE SE,HALAS N J.Nanoshell- enabled photothermal cancer therapy:impending clinical impact[J].Acc Chem Res,2008,41(12):1842 -1851.
[7]CHOI W I,KIM J Y,KANGC,et al.Tumor regression in vivo by photothermal therapy based on gold -nanorod -loaded,functional nanocarriers[J].ACSNano,2011,5(3):1995 -2003.
[8]WANG S,CHEN K J,WU T H,et al.Photothermal effects of supramolecularly assembled gold nanoparticles for the targeted treatment of cancer cells[J].Angew Chem Int Ed,2010,49(22):3777 -3781.
[9]TIAN Q W,TANG M,SUN Y,et al.Hydrophilic flower- like CuS superstructures as an efficient 980 nm laser- driven photothermal agent for ablation of cancer cells[J].Adv Mater 2011,23(31):3542 -3547.
[10]YANG K,ZHANG S,LIU Z,et al.Graphene in mice:ultrahigh in vivo tumor uptake and efficient photothermal therapy[J].Nano Lett,2010,10(9):3318 -3323.
[11]NOBUHIRO N,HENDRIK R,ZHANG G D,et al.Light- harvesting ionic dendrimer porphyrins as new photosensitizers for photodynamic therapy[J].Bioconjugate Chem,2003,14(1):58 -66.
[12]SHARIFI S,BEHZADI S,LAURENT S,et al.Toxicity of nanomaterials[J].Chem Soc Rev,2012,41(6):2323 -2343.
[13]YANG K,XU H,CHENG L,et al.In vitro and in vivo Near- Infrared photothermal therapy of cancer using polypyrrole organic nanoparticles[J].Adv Mater,2012,24(41):5586 -5592.
[14]WANG C,XU H,LIU Z,et al.Iron Oxide@Polypyrrole nanoparticles as a multifunctional drug carrier for remotely controlled cancer therapy with synergistic antitumor effect[J].ACSNano,2013,7(8):6782 -6795.
[15]SAXENA V,SADOQI M,SHAO J.Degradation kimetics of indocyanine green in aqueous solution[J].JPharm Sci,2003,92(10):2090-2097.
[16]YU J,JAVIER D,YASEEN M A,et al.Self- assembly synthesis,tumor cell targeting,and photothermal capabilities of antibody - coated indocyanine green nanocapsules[J].J Am Chem Soc,2010,132(6):1929 -1938.
[17]YANG J,CHOI J,BANG D,et al.Convertible organic nanoparticles for near- infrared photothermal ablation of cancer cells[J].Angew Chem Int Ed,2011,50(2):441 -444.
[18]LIU Y,AI K,LIU J,et al.Dopamine - melanin colloidal nanospheres:an efficient near- infrared photothermal therapeutic agent for in vivo cancer therapy[J].Adv Mater,2013,25(9):1353 -1359.
[19]CHENG L,YANG K,CHEN Q,et al.Organic stealth nanopar ticles for highly effective in vivo near - infra red photothermal therapy of cancer[J].ACSNano,2012,6(6):5605 - 5613.
[20]LOVELL JF,JIN CS,HUYNH E,et al.Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents[J].nature materials,2011,10(4):324 -311.
[21]ALAN J H.Semiconducting and Metallic Polymers:The fourth generation of polymeric materials(nobel lecture)[J].Angew Chem Int Ed,2001,40(14):2591 -2611.
[22]BIDEZ P R,LI S,MACDIARMID A G,et al.Polyaniline,an electroactive polymer,supports adhesion and proliferation of cardiac myoblasts[J].JBiomater Sci Polym Edn,2006,17(1 -2):199 -212.
[23]STEJSKAL JR G,GILBERT R G.Polyaniline.preparation of a conducting polymer[J].Pure Appl Chem,2002,74(5):857-867.
[24]DIMITRIEV O P.Doping of Polyaniline by transition - metal salts[J].Macromolecules,2004,37(9):3388 -3395.
[25]MARIJA G N,JADRANKA T S,GRAHAM A,et al.Conducting polymers as free radical scavengers[J].Synth Met,2004,140(2-3):225-232.
[26]ZHA Z B,YUE X L,DAI Z F.Uniform polypyrrole nanoparticles with high photothermal conversion efficiency for photothermal ablation of cancer cells[J].2012,25(5):777 -782.
[27]HONG J H,YOON H,KINETIC J,et al.Study of the formation of polypyrrole nanoparticles in water- soluble polymer/metal cation systems:A light- scattering analysis[J].Small,2010,6(5):679 -686.
[28]OH W K,YOON H,JANG J.Size control of magnetic carbon nanoparticles for drug delivery[J].Biomaterials,2010,31(6):1342-1348.
[29]GEORGE PM,LYCKMAN A W,LAVAN D A,et al.Fabrication and biocompatibility of polypyrrole implants suitable for neural prosthetics[J].Biomaterials,2005,26(17):3511 -3519.
[30]FONNER JM,FORCINITI L,NGUYEN H.Biocompatibility implications of polypyrrole synthesis techniques[J].Biomed Mater,2008,3(3):1 -12.
[31]LOFTSSON T,HREINSDOTTIR D,STEFANSSON E.Cyclodextrin microparticles for drug delivery to the posterior segment of the eye:aqueous dexamethasone eye drops[J].JPharm Pharmacol,2007,59(5):629 -635.
[32]AU K M,LU Z H,MATCHER S J,et al.Polypyrrole Nanoparticles:A Potential Optical Coherence Tomography Contrast Agent for Cancer Imaging[J].Adv Mater,2011,23(48):5792 - 5795.
[33]ARMESSP,VINCENT B.Dispersions of electrically conducting polypyrrole particles in aqueous media[J].J Chem Soc Chem Comm,1987(4):288-290.

