慢性脑低灌注大鼠认知功能和突触可塑性变化
海 舰,苏少华,吴一芳,余 飞
同济大学附属同济医院神经外科,上海 200065
慢性脑低灌注(chronic cerebral hypoperfusion,CCH)属于一种常见的病理现象,多见于脑动静脉畸形、颈动脉狭窄或闭塞、硬膜动静脉瘘、脑动脉硬化、阿尔茨默氏病等[1-3]。长期脑低灌注可诱导认知功能障碍,临床表现为血管性痴呆,尽管急性脑缺血研究的较为广泛,但慢性脑低灌注对脑功能的影响,特别是认知功能尚少有研究[4]。临床证据表明改善CCH有助于患者认知功能的恢复[5],由此可见,CCH在认知功能障碍的病理发生过程中起着重要作用,但CCH导致认知功能障碍的分子机制尚不清楚。认知功能主要包括学习和记忆功能,突触可塑性对维持认知功能至关重要[6]。临床上,由于受到多种不同因素如年龄、系统性疾病、教育背景等影响,难以准确判断CCH和认知功能之间的关系[3],而通过建立单纯的慢性脑低灌注动物模型有助于相关病因学研究。双侧颈总动脉结扎是目前常用的研究慢性脑低灌注动物模型,而临床上很少发现双侧颈总动脉同时闭塞情况[7]。为此,我们基于脑动静脉畸形的血流动力学特征,通过右侧颈外静脉和颈总动脉端侧吻合,同时结扎双侧颈外动脉和左侧横窦引流静脉,建立了一种改良的CCH动物模型[8],进一步研究CCH对大鼠认知功能及其海马区突触可塑性的影响。
1 材料与方法
1.1 CCH动物模型的建立
8,12只SD模型组大鼠(200~250 g),3%戊巴比妥钠(40 mg/kg)腹腔麻醉后固定于动物实验台上,手术显微镜下分离暴露右侧颈外静脉、颈总动脉,11-0尼龙丝线行颈外静脉和颈总动脉端侧吻合,再结扎双侧颈外动脉和左侧横窦引流静脉。12只鼠龄相同的大鼠仅结扎右侧颈外静脉和双侧颈外动脉,作为手术对照组。饲养3个月后进行相关实验研究。
1.2 水迷宫实验
按照参考文献9方法进行水迷宫实验,水迷宫为一圆形水槽,直径1.8 m,高度0.6 m,水深35 cm,水温保持在25±1℃。目标平台直径9 cm,位于水面下2 cm,游泳路径由计算机录像系统实时记录,所有大鼠每天进行连续4天训练,每天4次,每次间隔1 h。动物每次入水象限随机分配,面向池壁入水,将大鼠寻找平台时间设定为90 s,平台上停留30 s,如在规定时间未找到平台,可人工引导到平台,记录游泳速度和到达平台的潜伏期。第5天进行空间探究实验,移除可视平台,设定游泳时间为60 s,记录各组动物在平台象限的停留时间和跨越平台象限的次数。
1.3 HE 染色
水迷宫实验后每组取4只动物进行HE染色,过量麻醉,经心脏在体灌注200 ml 4℃ 0.1 mol/L PBS,再灌注200毫升4%多聚甲醛缓冲液。矢状缝后3~4 mm区冠状脑组织块,常规后固定,石蜡包埋,5μm切片,HE染色。
1.4 免疫组化
每组4只动物,矢状缝后3~4 mm冠状取脑组织块,冰冻切片,厚度30μm,采用免疫荧光双染法,0.01 mol/L醋酸钠缓冲液中微波抗原修复10 min,0.2%Triton-X100-PBS洗涤5 min,3%小牛血清封闭30 min,MAP-2一抗(1∶200,Sigma)4 ℃孵育过夜,带荧光素标记二抗 (1∶500,Dako)和4μg/ml PI(Sigma)孵育1小时,LSM 510 META激光共聚焦显微镜观察 (Zeiss)。
1.5 蛋白印迹
每组4只动物,深度麻醉后处死,取海马组织,2~3 ml缓冲液 (20 mmol/L Tris-HCl,pH 7.5,1 mmol/L EGTA,1 mmol/L EDTA,25 μg/ml aprotinin,25 μg/ml leupeptin,1 mmol/L Na4P2O7,500 μmol/L phenylmethylsulfonyl fluoride,4 mmol/L para-nitrophenylphosphate,and 1 mmol/L sodium orthovanadate),采用BCA法蛋白定量,40μg蛋白10%凝胶蛋白电泳、转膜、封闭,MAP-2,GAP-43和突触素(synaptophysin)一抗孵育,二抗孵育,ECL法显色,密度扫描定量分析。
1.6 统计分析
定量资料以均数±标准差表示,方差分析和t检验进行统计学分析,p<0.05表示差别具有显著性。
2 结果
2.1 认知功能评估
水迷宫是评价动物学习、记忆等认知功能的重要方法[10],与对照组动物相比,模型组动物寻找平台的潜伏期明显延长,而两组动物之间的游泳速度并无明显差异,说明两组动物的运动功能无明显改变,模型组动物的学习能力下降与感觉运动功能无关。空间记忆功能测试发现模型组动物在平台象限的停留时间和跨越平台象限的次数明显减少,结果表明CCH可诱导大鼠学习和记忆等认知功能障碍。
2.2 组织学检查
HE染色光学显微镜下观察两组动物脑组织中未见明显的脑梗塞表现。
2.3 CCH对MAP-2表达的影响
采用免疫荧光双染法观察两组动物海马CA1区MAP-2免疫原性,MAP-2主要在胞体和树突表达(绿色),PI染色胞核(红色),与对照组动物相比,模型组动物海马CA1区神经元MAP-2表达明显降低 (Fig.1)。
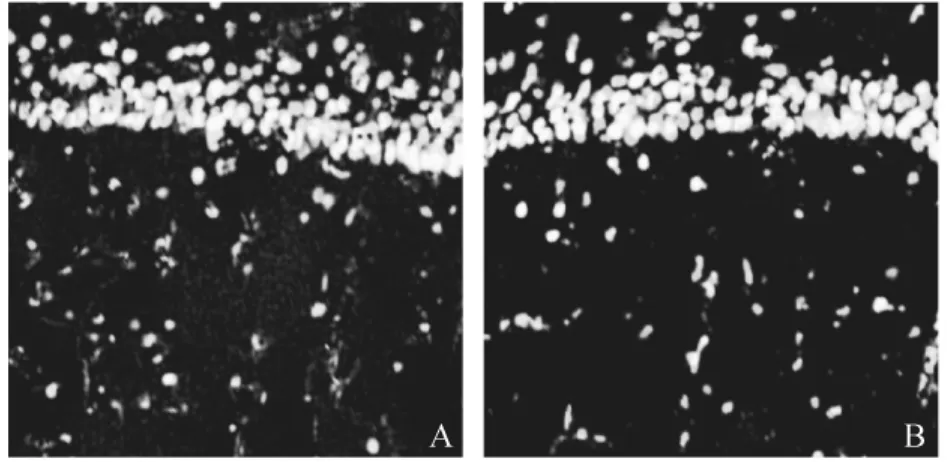
图1 对照组(A)和模型组(B)动物海马CA1区神经元MAP-2免疫组化、染色,MAP染色呈绿色,PI染色为红色(放大倍数(200)Fig.1 MAP-2 immunoreactivity(green)counterstained with PI(red)in the happocampalregion of the control(A)and model rats(B)(magnification(200).
2.4 CCH对MAP-2,GAP-43和突触素表达影响的定量分析
免疫印迹检测两组动物海马组织中MAP-2,GAP-43和突触素表达变化,结果显示模型组动物海马组织中MAP-2和突触素的表达较对照组动物明显降低,而两组动物之间GAP-43表达无明显差异(Fig.2)。
3 讨论
巨大的脑动静脉畸形、脑动脉硬化、严重的双侧颈动脉闭塞等疾病病理发生过程常伴有CCH[1,11],尽管炎性因素可能与CCH所致的神经病理学改变有关[12],但CCH对认知功能影响尚不清楚,本研究表明,CCH可诱导大鼠认知功能障碍,包括学习和记忆功能。

图2 对照组(Con)和模型组(M)动物海马组织中MAP-2,GAP-43,和突触素(synaptophysin)表达(A),B为定量分析结果Fig.2 Representative western blotting for MAP-2,GAP-43,and synaptophysin expression(A)of the hippocampal regions in the control(Con)and model(M)rats.The protein levels of MAP-2,GAP-43,and synaptophysin expression are quantified by densitometric analysis(B).Data represent mean ± SEM(n=4).*p <0.05 vs.the control group
脑动静脉畸形患者的主要血流动力学改变是颅内动静脉分流导致病灶周围脑组织灌注压下降[13],目前已有多种动物模型试图模拟脑动静脉畸形所致的血流动力学改变,Spetzler等创建的动物模型是通过静脉血液逆行进入系统循环,但颅内静脉压升高并不明显[14],Morgan等制作的动物模型是通过动脉和静脉端端吻合,颈内动脉血液直接流入颅内静脉系统,静脉高压明显,但系统动脉压降低不明显[15]。我们基于脑动静脉畸形的基本血流动力学特征,采用右侧颈外静脉和颈总动脉端侧吻合的方法造成系统动脉分流,结扎双侧颈外动脉以阻断颅外动脉向颅内供血,同时结扎对侧横窦引流静脉以造成颅内静脉高压[8],结果形成稳定的颅内供血动脉低压和引流静脉高压,有效地降低了脑灌注压,我们通过组织学检查发现模型组动物未见明显的脑梗塞表现[16-17]。
MAP-2是一种细胞骨架蛋白,主要位于神经元树突,MAP-2表达与树突生长、损伤后树突重塑等有关[18]。MAP-2免疫原性降低是评价永久性和短暂性脑卒中后缺血性损伤的一个敏感指标[19],我们通过免疫组化和蛋白印迹方法检测发现模型组动物海马组织中MAP-2表达明显降低,MAP-2表达水平下降可能导致细胞骨架蛋白之间的异常联系和(或)细胞内微管异常组合,进而影响与海马结构有关的学习行为和空间记忆功能。
突触素是一种38 kDa钙结合糖蛋白,位于突触前小泡膜上,参与了神经突触的发育和可塑性[20],突触素表达水平常用于反映突触数量和密度。本研究发现CCH可诱导动物海马组织中突触素表达下调,可能与CCH所致的认知功能障碍有关。同时,突触素也是突触前小泡膜上神经递质传输的重要成份,突触素下降可直接影响突触间的神经传递[21]。
GAP-43属于细胞内膜相关蛋白,主要表达于神经生长的帽状结构,参与了轴突生长、突触形成、突触重塑和神经递质的释放等[22],GAP-43表达与神经系统的发育、突触可塑性和神经再生密切相关,在导向轴突生长和调节轴突形成过程中起到重要作用[23]。突触形成后,GAP-43表达一般是下调的,本研究发现两组动物之间海马组织中GAP-43表达未见明显变化,可能与CCH病理发生过程中动物自身的调节和补偿机制有关[20]。
综上所述,本研究所建立的动物模型属于一种慢性非梗塞性脑缺血,可导致动物的认知功能障碍,模型组动物海马组织中MAP-2和突触素表达下调可能是导致动物认知功能损害的一种因素。
参考文献
[1]Aliev G,Gasimov E,Obrenovich ME,etal.Atherosclerotic lesions and mitochondria DNA deletions in brain microvessels:implication in the pathogenesis of Alzheimer's disease[J].Vasc Health Risk Manag,2008,4(3):721-730.
[2]Hasumi T,Fukushima T,Haisa T,etal.Focal dural arteriovenous fistula(DAVF)presenting with progressive cognitive impairment including amnesia and alexia[J].Intern Med,2007,46(16):1317-1320.
[3]Sarti C,Pantoni L,Bartolini L,etal.Cognitiveimpairment and chronic cerebral hypoperfusion:what can be learned from experimental models[J].J Neurol Sci,2002,203-204:263-266.
[4]Kruyt ND,Nys GM,van der Worp HB,etal.Hyperglycemia and cognitive outcome after ischemic stroke[J].J Neurol Sci,2008,270(1-2):141-147.
[5]Tsuda Y,Yamada K,Hayakawa T,etal.Cortical blood flow and cognition after extracranial-intracranial bypass in a patient with severe carotid occlusive lesions.A three-year follow-up study[J].Acta Neurochir(Wien),1994,129(3-4):198-204.
[6]Silva AJ.Molecular and cellular cognitive studies of the role of synaptic plasticity in memory[J].J Neurobiol,2003,54(1):224-237.
[7]Kudo T,Tada K,Takeda M,etal.Learning impairment and microtubule-associated protein 2 decrease in gerbils under chronic cerebral hypoperfusion[J].Stroke,1990,21(8):1205-1209.
[8]Hai J,Ding M,Guo Z,etal.A new rat model of chronic cerebral hypoperfusion associated with arteriovenous malformations[J].J Neurosurg,2002,97(5):1198-1202.
[9]Morris R.Developments of a water-maze procedure for studying spatial learning in the rat[J].JNeurosci Methods,1984,11(1):47-60.
[10]Schenk F,Morris RG.Dissociation between components of spatial memory in rats after recovery from the effects of retrohippocampal lesions[J].Exp Brain Res,1985,58(1):11-28.
[11] Meyer B,Schaller C,Frenkel C,etal.Distributions of local oxygen saturation and its response to changes of mean arterial blood pressure in the cerebral cortex adjacent to arteriovenous malformations[J].Stroke,1999,30(12):2623-2630.
[12]Hai J,Lin Q,Li ST,etal.Chronic cerebral hypoperfusion and reperfusion injury of restoration of normal perfusion pressure contributes the neuropathological changes in rat brain[J].Mol Brain Res,2004,126(2):137-145.
[13] Al-Shahi R,Warlow C.A systematic review of the frequency and prognosis of arteriovenous malformations of the brain in adults[J].Brain,2001,124(10):1900-1926
[14]Spetzler RF,Wilson CB,Weinstein P,etal.Normal perfusion pressure breakthrough theory[J].Clin Neurosurg,1978,25:651-672.
[15]Morgan MK,Anderson RE,Sundt TM Jr.A model of the pathophysiology of cerebral arteriovenous malformations by a carotid-jugular fistula in the rat[J].Brain Res,1989,496(1-2):241-250.
[16] Hai J,Li ST,Lin Q,Pan QG,etal.Vascular endothelial growth factor expression and angiogenesis induced by chronic cerebral hypoperfusion in rat brain[J].Neurosurgery,2003,53(4):963-972.
[17]Hai J,Wan JF,Lin Q,Wang F,etal.Cognitive dysfunction induced by chronic cerebral hypoperfusion in a rat model associated with arteriovenous malformations[J].Brain Res,2009,1301:80-88.
[18] Tucker RP.The roles of microtubule-associated proteins in brain morphogenesis:a review[J].Brain Res Brain Res Rev,1990,15(2):101-120.
[19]Dawson DA,Hallenbeck JM.Acute focal ischemia-induced alterations in MAP2 immunostaining:description of temporal changes and utilization as a marker for volumetric assessment of acute brain injury[J].JCereb Blood Flow Metab,1996,16(1):170-174.
[20] Liu HX,Zhang JJ,Zheng P,etal.Altered expression of MAP-2,GAP-43,and synaptophysin in the hippocampus of rats with chronic cerebral hypoperfusion correlates with cognitive impairment[J].Brain Res Mol Brain Res,2005,139(1):169-177.
[21] Ding Y,Li J,Clark J,etal.Synaptic plasticity in thalamic nuclei enhanced by motor skill training in rat with transient middle cerebral artery occlusion[J].Neurol Res,2003,25(2):189-194.
[22]Strittmatter SM,Vartanian T,Fishman MC.GAP-43 as a plasticity protein in neuronal form and repair[J].J Neurobiol,1992,23(5):507-520.
[23]Xiao N,Li S,Zhang X,etal.Effect of ephedrine on neuronal plasticity of hypoxic-ischemic brain damage in neonatal rats[J].Neurosci Lett,2008,435(2):99-102.

