芦丁合铁(Ⅲ)的合成、表征及其与DNA相互作用研究
李艾华,郭艳华,张玉敏
(江汉大学 化学与环境工程学院,湖北 武汉 430056)
芦丁是存在于植物中的一种黄酮类化合物,广泛用于医药、保健食品中[1-3]。芦丁具有降低毛细血管通透性、抗炎、抗病毒、镇痛、抗氧化及抑制醛糖还原酶等药理活性。近年来,国内外文献报道芦丁具有抗癌作用[4],芦丁具有3',4'位二羟基和4-羰基-5-羟基,与金属离子可螯合成稳定的五元环或六元环[5]。研究表明,许多有机分子配体与金属配合形成配合物后,其药效明显增强。研究发现芦丁合铁配合物可以增强芦丁保护细胞抗损伤的能力及对抗炎症作用。芦丁合铁(Ⅲ)配合物的体外清除氧自由基的能力为单纯芦丁的2~30倍,芦丁合铁(Ⅲ)配合物能够有效对抗博莱霉素诱导的肺水肿[6]。
众所周知,DNA是生物体的重要组成物质,是遗传信息的携带者和基因表达的物质基础,它在生物的生长、发育和繁殖等活动中具有十分重要的作用。DNA的结构直接影响其功能,并与致癌、抗癌有关。研究小分子金属配合物和DNA的相互作用,从而探索DNA的结构与功能的关系,将有助于人们从分子水平上了解生命现象的本质,并从基因水平上理解遗传病、癌症、艾滋病等疾病的发病机理,使通过分子设计寻找有效的治疗药物成为可能。钴、铜、锌、铕等元素的芦丁配合物与DNA相互作用的研究已有报道[7-9],而铁与DNA相互作用的研究鲜见报道。本实验合成了芦丁合铁配合物,利用红外、紫外、差热-热重分析等方法对合成的芦丁合铁进行了检测,并对芦丁合铁与DNA的作用进行了研究。
1 材料与方法
1.1 试剂与仪器
芦丁(BR)、DNA(BR 批号 F20091118)、无水乙醇(AR)均购于国药集团化学试剂有限公司;硫酸铁(AR)购于天津市福晨市化学试剂厂;Ethidium Brmide(BR纯度≥98%)购于上海索莱宝生物科技有限公司;其余试剂均为分析纯。
UV-2550紫外可见分光光度计,日本岛津;FTIR-8000型红外光谱仪,日本岛津;LS-55荧光分光光度计,美国Perkin Elmer公司;CRY-2P型差热分析仪,北京光学仪器厂;JJ-1型定时电动搅拌器,江苏金坛中大仪器厂;DF110型电子分析天平,中国轻工业机械总公司常熟衡器工业公司;数显恒温水浴锅,HH-2国华电器有限公司。
1.2 实验方法
1.2.1 芦丁合铁配合物的合成 根据芦丁合铁配合物的合成条件,按下列较优方法合成:将1.4 g(约2 mmo1)芦丁与40 mL无水乙醇投入到250 mL三口烧瓶中,微热使其完全溶解,再加入0.4 g无水碳酸钠搅拌1 h,即有黄色的芦丁钠盐生成,再将0.4 g(约1 mmo1)硫酸铁加入到三口烧瓶中,同时滴加约10 mL浓度为0.5 mol/L的醋酸溶液调pH至弱酸性,然后在40℃的恒温水浴锅中加热回流搅拌4 h,即得到大量棕黑色沉淀,静置、冷却、抽滤,沉淀用95%乙醇洗涤数次,室温真空干燥,最后得深棕色粉末状固体,保存备用。
1.2.2 芦丁合铁组成与结构的表征 配位比的测定采用等摩尔连续变化法:固定缓冲溶液的用量为2.0 mL,金属离子和芦丁溶液(浓度均为1.0 mmol/L)的总量为8.0 mL,连续改变两种组分的体积,在40℃的恒温水浴锅中反应1 h,反应完毕后测溶液在416 nm处的吸光度,并对芦丁体积作图。
紫外吸收光谱测定:选择合适的参比溶液,在200~700 nm范围扫描样品溶液的紫外可见吸收光谱图。扫描速度为500 nm/min,分辨率为0.02 nm。
差热-热重分析测定:取3.6 mg芦丁合铁放入CRY-2P型差热分析仪中,在N2气氛中,升温速度为20℃/min,测定范围为20~700℃ 条件下,绘制其TG-DTA-DTG曲线图。
红外光谱测定:KBr压片,在400~4000 cm-1区间范围内扫描其红外光谱。
1.2.3 芦丁合铁与DNA作用的光谱表征 荧光光谱测定:在10 mL比色管中加入26.7 mg/25 mL DNA溶液0.05 mL,1.0 mg/mL EB溶液0.4 mL,再分别加入0、0.2、0.4、0.6、0.8、1.0 mL的芦丁合铁(36.7 mg/50 mL),用二次蒸馏水稀释至刻度,避光作用1 h后,在激发波长为356 nm、激发狭缝和发射狭缝为10 nm的条件下扫描其发射光谱。
2 结果与分析
2.1 芦丁合铁组成的测定
图1即为用等摩尔连续变化法测配位比的曲线。由图1可见,当Ru和Fe(Ⅲ)体积比(即摩尔比)约为2∶1时吸光度最大,说明芦丁合铁配合物的组成约为Ru∶Fe(Ⅲ)=2∶1。
图2为芦丁合铁的TG-DTA-DTG曲线图,由图2可见,热重曲线在开始时也有由于气流不稳所致的鼓起部分,在54℃左右有一吸热峰,是由于芦丁合铁配合物失去结晶水所致,对应于热失重曲线,失重率为6.94%,推测结晶水分子数为5;在261℃处有一吸热峰,为配合物的分子结构被破坏而引起分解所致,对应于热失重曲线,失重率为18.33%,最后剩余81.67%可能为未完全分解的芦丁和Fe2O3的质量。
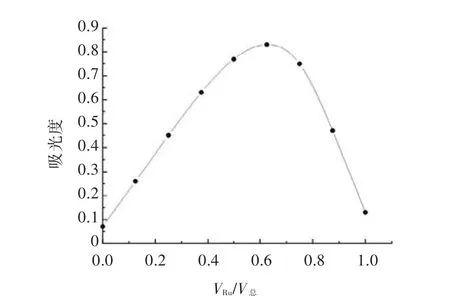
图1 芦丁合铁配位比的测定
结合以上配位比组成的测定和差热与热重分析的数据,可以推测出合成的芦丁合铁配合物分子式可能为Fe(Rutin)2·5H2O。
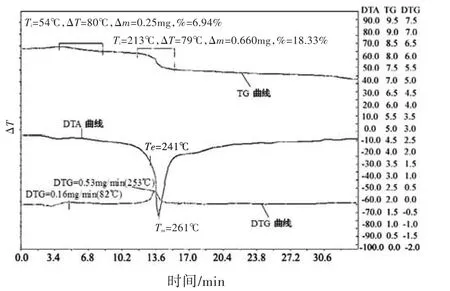
图2 芦丁合铁的TG-DTA-DTG曲线
2.2 紫外-可见光谱分析
分别称取0.0260 g芦丁、0.0367 g芦丁合铁,用95%乙醇定容至100 mL。用95%乙醇作参比,在200~700 nm范围扫描其吸收光谱,光谱图见图3所示。
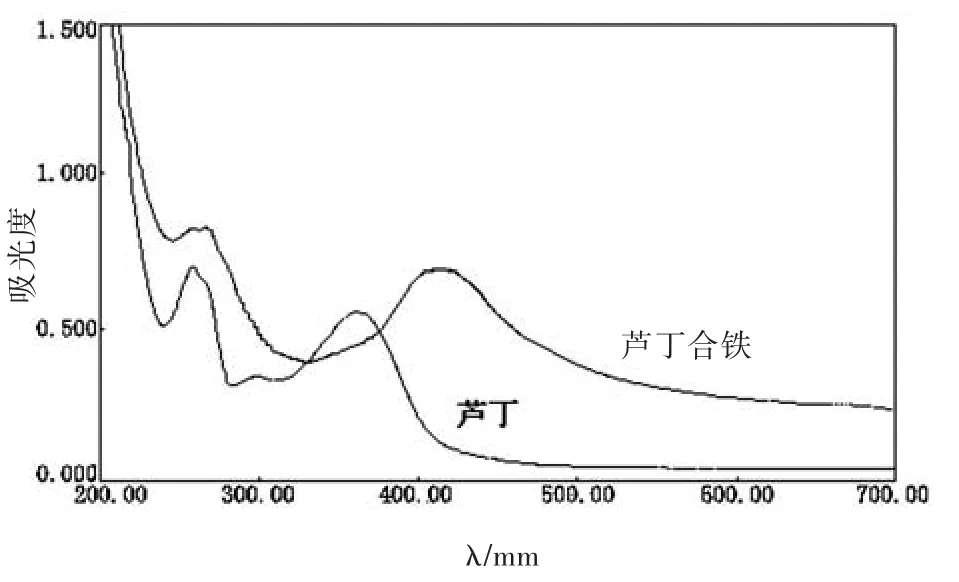
图3 芦丁及其配合物在95%乙醇溶液中的紫外吸收光谱图
芦丁在乙醇溶液中的特征吸收波长为258 nm、360 nm,形成配合物后两个峰带分别红移了4 nm和56 nm。谱带的移动证明了配合物的生成,而谱带之所以移动是因为形成配合物之后,整个分子中电子的离域程度增大,致使电子跃迁时需要的能量降低,从而使吸收峰发生红移。
2.3 红外光谱分析
红外光谱是由于分子中基团原子间振动跃迁时吸收红外光所产生的,红外光谱主要用于定性鉴定和结构分析。表1为芦丁及其配合物的红外光谱数据,配体芦丁在1655 cm-1处出现羰基伸缩振动吸收峰,芦丁合铁形成配合物后向低频方向移动了约31 cm-1,表明芦丁4位羰基参与了配合反应。芦丁合铁在620.94 cm-1处出现了Fe-O键的特征吸收峰,而该吸收峰在芦丁的红外波谱图中没有出现,可见金属离子与配体发生了络合。芦丁在1504.76 cm-1处出现的峰为苯环π键共轭体系的(C=C)键伸缩振动峰,在配合物中此峰向低波数移动了30.43 cm-1,这是配位反应对苯环共轭体系影响所致。另外,芦丁在1298.10 cm-1处的C-O伸缩振动移至1271.21 cm-1,这些现象也说明由于金属离子的配位作用发生偏移,从而产生吸收峰的位移。

表1 红外光谱数据/cm-1
2.4 配合物与DNA作用的电子吸收光谱分析
在10 mL比色管中加入27.8 mg/50 mL芦丁合铁2 mL,再分别加入0.2、0.4、0.6、0.8、1.0 mL的26.7 mg/25 mL DNA溶液,用二次蒸馏水稀释至刻度,扫描纪录紫外光谱(见图4)。从图4中看出DNA的加入使芦丁合铁配合物的吸收光谱发生了变化,随着DNA浓度的增加,谱图有明显的增色效应,吸收峰的位置红移了10 nm左右,红移是由芦丁合铁分子嵌入DNA双链中,芦丁合铁的π*共轭体系与DNA碱基的大π共轭体系之间发生较强的相互作用,产生π电子堆积,其π*空轨道与碱基的π电子轨道发生偶合,能使级下降,导致π*—π跃迁能减小[10]。这说明芦丁合铁与DNA确实发生了作用。
2.5 配合物与EB的竞争性结合研究
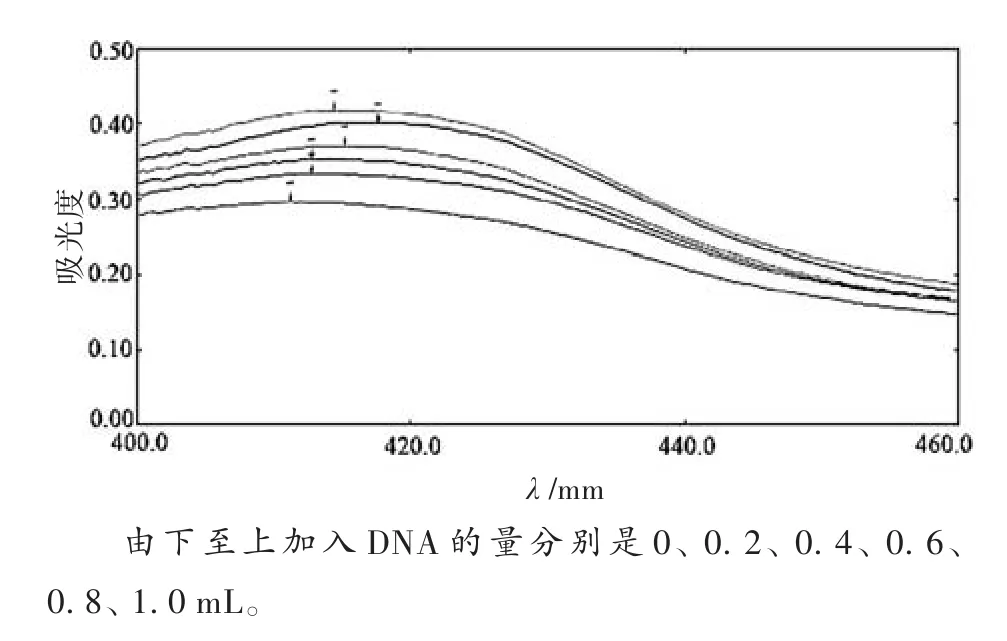
图4 芦丁合铁及其与DNA作用后的吸收光谱
EB是一种荧光试剂,它本身的荧光很弱,但嵌入双链DNA的碱基之间后使本身荧光强度显著增强。如果小分子配合物也能与DNA发生类似的嵌入作用,则这个小分子竞争EB与DNA的结合位点,使体系的荧光强度减弱。通常,当EB-DNA体系的荧光强度减弱50%,且c(配合物)/c(DNA)<100时,就认为该小分子配合物与DNA发生了类似于EB的嵌入作用[11]。
图5即为加入不同量的芦丁合铁后EB-DNA的荧光光谱。由图5可知,当c(芦丁合铁)/c(DNA)=5.50时,EB-DNA体系的荧光强度已降到原来的50%以下,说明芦丁合铁发生了类似于EB的嵌入作用。随着芦丁合铁的加入,它取代了EB-DNA体系中相当数量的EB分子,导致了EB-DNA体系荧光强度的较大降低。
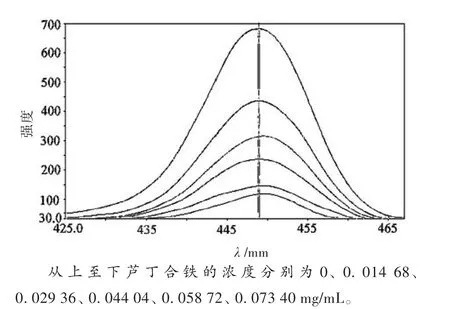
图5 芦丁合铁-EB-DNA体系的荧光光谱
2.6 荧光猝灭方式判断
根据经典的荧光猝灭理论,无论静态猝灭或动态猝灭,体系相对荧光强度F0/F(F0为未加入配合物的EB-DNA体系荧光值,F为加入配合物的EB-DNA体系的荧光值),对配合物浓度[Q]作图均应得到一条直线[12](见图6)。由图6可知荧光强度F0/F与配合物浓度呈线性关系,根据Stem-Volmer方程F0/F=l+kq[Q],得出芦丁合铁与DNA的键合常数为67.57 mL/mg,相关系数R=0.9923,说明芦丁合铁嵌入DNA双链中取代已嵌入的EB分子。
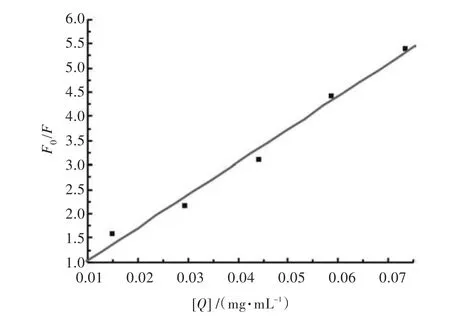
图6 芦丁合铁对EB-DNA体系的荧光猝灭
3 结语
笔者合成了芦丁合铁配合物,结合UV中的等摩尔连续变化法和TG-DTA等手段初步确定其可能的分子式为Fe(Rutin)2·5H2O,并对配合物的结构进行了表征;运用吸收光谱、荧光发射光谱等方法研究了配合物与DNA的作用机理,并计算出键合常数为67.57 mL/mg。实验结果表明芦丁合铁与DNA以嵌入模式结合。
[1]韩英华,秦元璋.芦丁研究现状[J].山东中医杂志,2003,22(10):635-637.
[2]李茂星,谢景文,葛欣.芦丁的药学研究进展[J].华西药学杂志,2000,15(6):450-451.
[3]龙全江,杨韬.芦丁的研究概况及展望[J].中国中医药信息杂志,2002,9(4):39-42.
[4]沈钦海,马臻,陈国民.芦丁对HepG2细胞生长的影响[J].第三军医大学学报,2006,28(18):1885-1887.
[5]刘杰,王伯初,彭亮,等.黄酮类抗氧化剂的构-效关系[J].重庆大学学报:自然科学版,2004,27(2):120-124.
[6]Afanas'eva I B,Ostrakhovitch E A,Mikhal'chik E V,et al.Enhancement of antioxidant and anti-inflammato⁃ry activities of bioflavonoid rutin by complexation with transition metals[J].Biochem Pharmacol,2001,61(6):677-684.
[7]康敬万,苏碧泉,卢小泉,等.芦丁配合物的合成、表征及其与DNA作用的电化学研究[J].西北师范大学学报:自然科学版,2006,42(1):54-57.
[8]康敬万,苏碧泉,李志峰,等.芦丁合钴与DNA相互作用研究[J].化学研究与应用,2006,18(4):360-364.
[9]康敬万,吴海霞,卓琳,等.Eu3+—芦丁配合物与DNA相互作用的电化学和紫外可见吸收光谱研究[J].中国稀土学报,2005,23(4):496-500.
[10]王明召,黄凤仙,徐小燕,等.金属配合物与DNA的弱相互作用[J].化学教育,2008(10):3-5.
[11]Liu J,Zhang T X,Lu T B,et al.DNA—binding and cleavage studies of macrocycliccopper(II) complexes[J].J Inorg Biochem,2002,91(1):269-276.
[12]宋玉民,杨培菊,王流芳,等.全反式维甲酸合钐(Ⅲ)配合物与DNA作用的研究[J].化学学报,2003,61(8):1266-1270.

