天然气—水/盐水体系相平衡计算
涂多运 邓道明 董 勇 张 强,3 宫 敬
1.中国石油大学(北京)油气管道输送安全国家工程实验室·城市油气输配技术北京市重点实验室2.中国石油集团工程设计有限责任公司西南分公司 3.中国国际石油化工联合有限责任公司
目前,人们认为水和烃类流体是互不相溶的,但天然气中的CO2和H2S却能大量地溶解于水中,对管道和设备造成腐蚀。此外,湿气系统中溶解盐不可避免地对气—水两相平衡产生影响,盐析效应会降低气体在水中的溶解度,准确地计算酸性气体的溶解量可以为管道腐蚀预测提供基础。
天然气管道工艺计算中不可避免地遇到气—水/盐水的相平衡计算[1]。天然气—水体系相平衡的研究从气相中含水量和液相水中气体的溶解度两个方面展开[2-6]。国外学者对两组分系统做了大量实验,并公布了一些可用的实验数据,而多组分系统的实验数据则很少。研究发现,气相含水量随着压力减小或温度升高而增大;气体溶解度随着压力增大和温度减小而增大;水中溶解的盐能减少气相的含水量和抑制气相在水中的溶解[7]。笔者介绍的天然气—水相平衡求解方法,简单实用,再加上对溶解盐影响的修正,可以准确地预测多组分气—水/盐水体系的气液相组成。
1 VPT状态方程法(VPT法)
众所周知,Patel-Teja状态方程能够有效地模拟极性体系的相平衡。Patel-Teja状态方程的改进型——VPT状态方程采用非密度依赖(NDD)混合规则能有效地模拟含有极性和非极性物质体系的相平衡[8]。
VPT状态方程如下:

混合规则:
其中
式中R为通用气体常数,8.314J/(mol·K);p为压力Pa;T为温度,K;v为摩尔体积,m3/mol;pc为气体临界压力,Pa;Tc为气体临界温度,K;Zc为气体临界压缩因子;ω为偏心因子;Tr为对比温度,Tr=T/Tc;kij为i组分和j组分的二元交互系数;xi为i组分摩尔分数;下标p为极性分子为参数符号。
2 PR状态方程法(PR法)
Sreide等采用PR状态方程、新的α项和气—水两相二元交互系数来模拟气液平衡[9]。新的α项由气—水/盐水实验数据拟合得到,是纯水的对比温度Tr和盐度csw的函数。
水溶液中二元交互系数(i代表烃组分;j代表水):
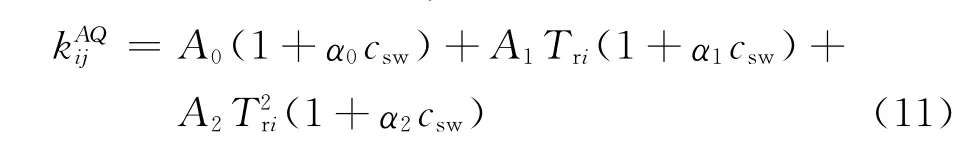
N2/NaCl盐水:

CO2/NaCl盐水:

H2S/NaCl盐水:
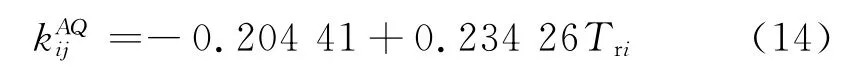
式中i为 N2、CO2、H2S;j为水或者盐水;Tri为i组分对比温度;csw为盐度,mol/kg。
3 φ-γ 法(PR-Henry法)
φ-γ法就是气相采用PR状态方程计算组分逸度[10],而液相采用活度系数和Henry定律计算组分逸度[11]。气相组分逸度系数计算就不再详述,这里重点介绍水溶液的处理。水溶液中水逸度计算公式如下:
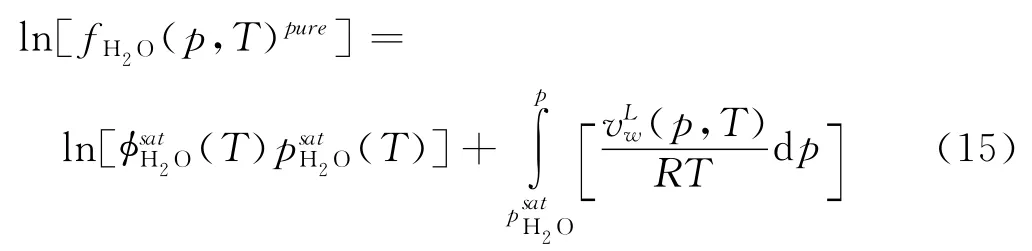
式中fH2O(p,T)pure为纯水的逸度为水饱和状态下的逸度系数;p为体系压力,Pa;(T)为水饱和蒸汽压,Pa;(p,T)为水的液相体积,m3/kg;T为体系温度,K。
水溶液中溶解的气体逸度计算公式如下:

式中xi为i组分在水溶液中的摩尔分数;γi,h(I)为修正水中溶解盐的Henry定律活度系数;Hi(T,p)为在压力p和温度T下,组分i在水中的Henry常数;I为离子强度,mol/kg。
4 盐的影响
很少发现烃—水系统没有盐溶解的情况。盐的存在能减小液态水的逸度,从而降低气相含水量。Pizter
基于氯化钠(NaCl)的性质开发了针对地热盐水的高精度模型[12],将活度系数、渗透系数和溶液的离子强度关联起来,能有效地计算盐的影响。Pitzer渗透系数公式如下:
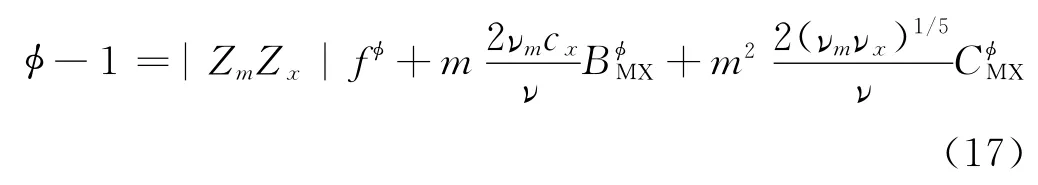
渗透系数能够计算由于盐的存在而导致的溶液活度系数的变化,将公式变形即可得到水的活度,从而修正计算含离子的液态水逸度。
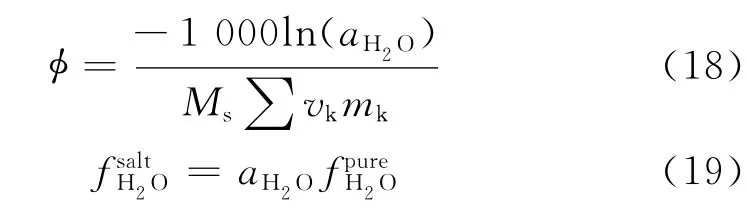
式中Zm、Zx、νm、νx分别为阳离子m、阴离子x的电荷和个数;ν为总电荷个数,ν=νm+νx;νk、mk为离子k的电荷个数和质量摩尔浓度(mol/kg);Ms为溶剂的摩尔质量; 为渗透系数;aH2O为水的活度系数为纯水逸度,含盐水逸度。
盐的存在改变了水溶液中气体的溶解度(盐析效应),通过活度系数来修正其影响。对于烷烃、二氧化碳,活度系数计算采用拟合实验数据得到的关联式[10],硫化氢、氮气在盐溶液中的活度系数采用过剩吉布斯自由能维里扩展式计算[13-14]。
5 模拟计算
5.1 天然气—水/盐水体系气相含水率
采用上述3种方法迭代计算表1所示混合物的气相含水率,计算结果和Hysys模拟结果对比见图1、2。

表1 混合物组成表
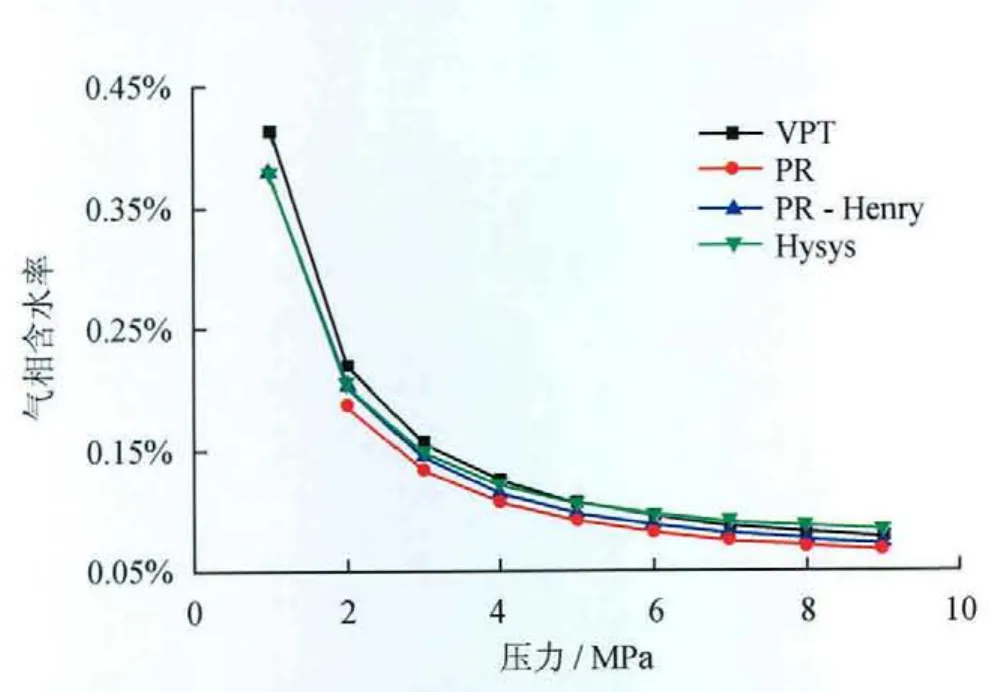
图1 混合物在300.15K时气相含水率随压力的变化图(不含坏点)
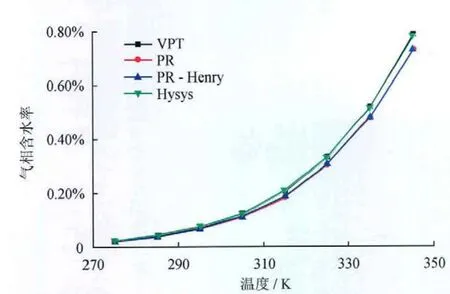
图2 混合物在6MPa压力下气相含水率随温度的变化图(不含坏点)
由对比分析结果可知,上述3种方法均能描述天然气—水相平衡,且精度相差不大,但PR状态计算结果存在坏点。究其原因,PR状态方程不再适合极性体系的相平衡计算,通过数据回归拟合得到的二元交互系数虽然可使其达到满意的模拟效果,但使用范围却受到限制。对于天然气—盐水体系,采用表1所示的混合物,气相含水量计算结果如图3所示,该图验证了Pitzer模型的正确性。其中,半经验相关式考虑天然气相对密度、酸气和盐含量修正项,能在一定范围内较准确地计算含盐天然气的含水率[15]。
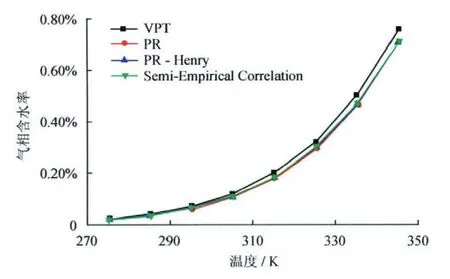
图3 混合物在6MPa压力下气相含水率随温度的变化图(含盐1.0mol/kg)
5.2 天然气—水/盐水体系水溶液相中气体的溶解度
酸气气体CO2和H2S在水溶液中溶解度远远大于烃类气体,溶解在水中酸性气体能够强烈地腐蚀管道和设备,准确地计算天然气在水中溶解量对于管道安全运行具有重要意义。二氧化碳和硫化氢在水中的溶解度的实验值及预测值对比结果见图4、5;对于含盐的体系,甲烷在水中溶解度的实验及预测值对比结果如图6所示。可以看出,3个模型对天然气—水体系相平衡预测具有较高的精度,VPT法最佳,其中PR法预测硫化氢在水中的溶解度时迭代不收敛,可能是因为液相二元交互系数计算公式出现笔误,故未在图5中给出数据。
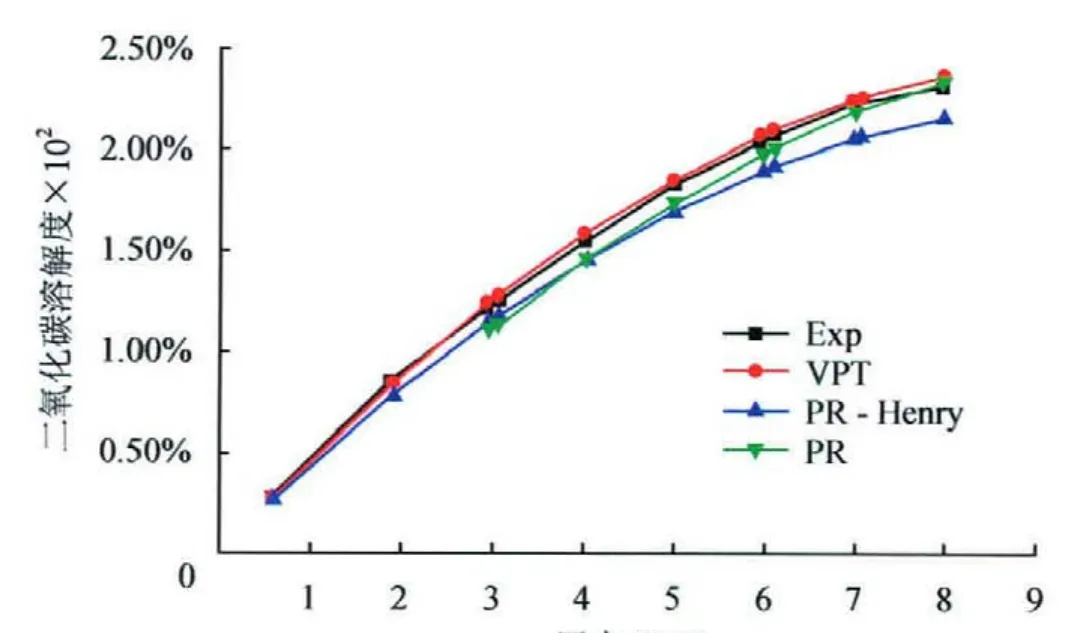
图4 308.2K时CO2—H2O体系中CO2在水中溶解度随压力的变化图
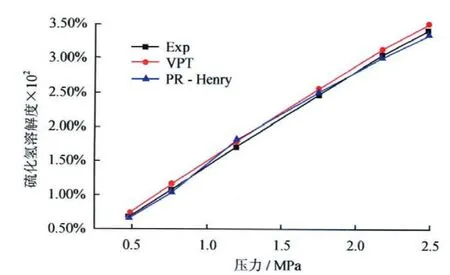
图5 308.2K时H2S—H2O体系中H2S在水中溶解度随压力的变化图
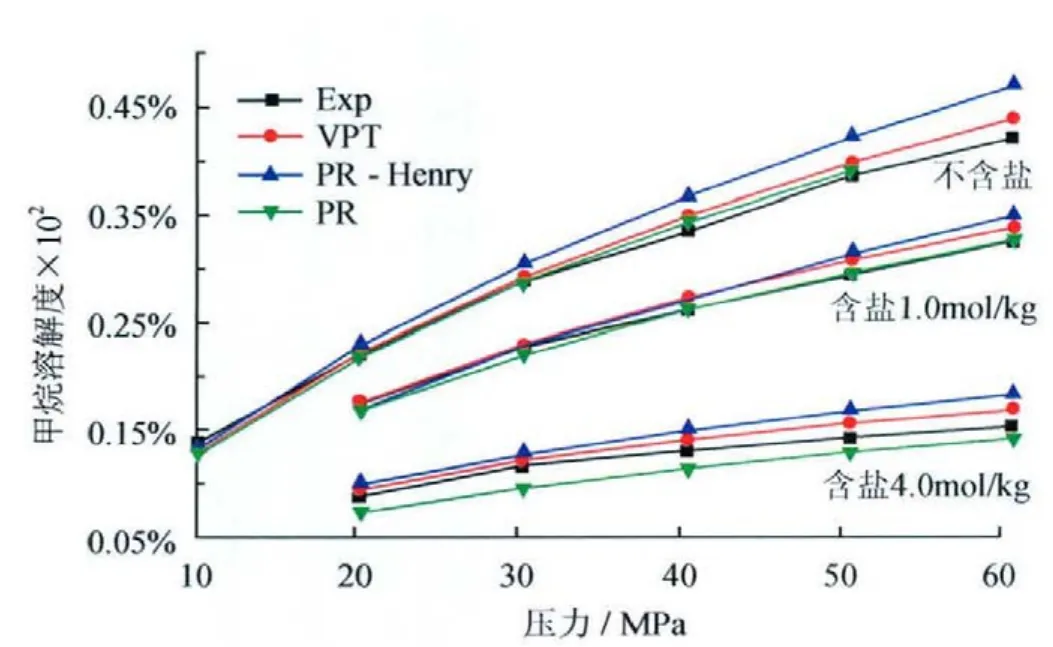
图6 375K时甲烷—水/盐水体系中甲烷溶解度随压力的变化图
6 结论
准确计算天然气—水/盐水体系的相平衡对管线的安全运营至关重要。笔者所述的3个模型能够描述天然气—水/盐水体系的相态特征,其计算精度满足工程要求,其中VPT法精度最佳。合理地选用状态方程、混合规则和二元交互系数能够取得更加令人满意的效果。但现今的二元交互系数大都有二元体系实验数据回归而来,应用到多元混合物体系,其精度可能会有所影响,需要进一步实验验证。
[1]郭天民.多元气—液平衡和精馏[M].北京:石油工业出版社,2002.GUO Tianmin.Gas-liquid equilibrium and distillation of multi-component system[M].Beijing:Petroleum Industry Press,2002.
[2]诸林,白剑,王治红.天然气含水量的公式化计算方法[J].天然气工业,2003,23(3):118-120.ZHU Lin,BAI Jian,WANG Zhihong.Formulated correlation calculation method of water content in natural gas[J].Natural Gas Industry,2003,23(3):118-120.
[3]HARIDY A,AWAD M E,ABD-EL-FATAH K,et al.New model estimates water content in saturated natural gas[J].Oil & Gas Journal,2002,100(7):50-53.
[4]史博会,钱亚林,王华青,等.管输天然气含水量/水露点的计算方法[J].油气储运,2012,31(3):188-192.SHI Bohui,QIAN Yalin,WANG Huaqing,et al.Calcula-tion method of water content/water dew point of natural gas[J].Oil and Gas Storage and Transportation,2012,31(3):188-192.
[5]左有祥,郭天民.天然气在水中的溶解度计算Ⅰ热力学模型[J].石油学报:石油加工,1990,6(2):65-74.ZUO Youxiang,GUO Tianmin.Calculation of solubility of natural gas in waterⅠ.Thermodynamic model[J].Acta Petrolei Sinica:Petroleum Processing Section,1990,6(2):65-74.
[6]左有祥,郭天民.天然气在水中的溶解度计算Ⅱ应用到多元系统[J].石油学报:石油加工,1990,6(3):95-100.ZUO Youxiang,GUO Tianmin.Calculation of solubility of natural gas in water Ⅱ.Application to multi-component system[J].Acta Petrolei Sinica:Petroleum Processing Section,1990,6(3):95-100.
[7]HEMPTINNE DE J C,DHIMA A,ZHOU H.The Importance of water-hydrocarbon phase equilibria during reservoir production and drilling operations[J].Revue de Institut Francais du Pétrole,1998,53(3):283-302.
[8]AVLONITIS D,DANESH A,TODD A C.Prediction of VL and VLL equilibria of mixtures containing petroleum reservoir fluids and methanol with a cubic EoS[J].Fluid Phase Equilibria,1994,94(3):181-216.
[9]SΦREIDE I,WHITSON C H.Peng-Robinson predictions for hydrocarbons,CO2,N2and H2S with pure water and NaCL brine[J].Fluid Phase Equilibria,15September 1992,77:217-240.
[10]MATT Y.Measurement and modeling of the water content of high pressure sweet and acid natural gas systems[D].Houston:Rice University,2006.
[11]YAWS C L,HOPPER J R,WANG X M,et al.Calculating solubility & Henry's law constants for gases in water[J].Chemical Engineering,1999,106(6):102-105.
[12]PITZER K S.Thermodytriarnics of electrolytes.I.Theoretical basis and general equation[J].The Journal of Physical Chemistry,1973,77(2):268-277.
[13]DUAN Z,SUN R,LIU R,et al.Accurate thermodynamic model for the calculation of H2S solubility in pure water and brines[J].Energy & Fuels,2007,21(4):2056-2065.
[14]SUN R,HU W,DUAN Z.Prediction of nitrogen solubility in pure water and aqueous NaCL solutions up to high temperature,pressure,and ionic strength[J].Journal of Solution Chemistry,2001,30(6):561-573.
[15]MOHAMMADI A H,SAMIEYAN V,TOHIDI B.Estimation of water content in sour gases[C]∥SPE Europec/EAGE Annual Conference,13-16June 2005,Madrid,Spain.New York:SPE,2005.

