玻璃化冷冻对人卵巢组织形态结构及组织增殖活性的影响
潘永苗,徐向荣,钱羽力,周彩云,徐 键
(浙江大学医学院附属妇产科医院,浙江 杭州 310006)
近年来,新的化疗和放疗方案应用,使得患有恶性肿瘤的年轻妇女生存率有了较大的提高,但化疗和放疗极易造成卵巢组织不同程度甚至永久性损伤,引起患者月经失调、闭经、卵巢早衰,甚至丧失生殖和内分泌能力。如何保存此类年轻妇女的卵巢功能成为迫切需要解决的问题。卵巢组织冷冻保存是一种较有前途的卵巢功能保存方法[1-2]。但冷冻可能对卵巢组织尤其是卵细胞造成不同程度的冷冻损伤[3-4],从而影响卵巢组织的冻存效率。本研究采用麦管玻璃化冷冻人类卵巢组织,与新鲜卵巢组织比较,探讨玻璃化冷冻对人类卵巢组织中卵泡组织形态和超微结构以及细胞增殖活性的影响,为探索卵巢组织冻融方法和进一步在体外培养、移植等研究提供实验基础。
1 资料与方法
1.1 标本来源 卵巢组织取自12 例来浙江大学医学院附属妇产科医院行腹腔镜下或进腹手术行卵巢良性囊肿切除的患者;术中取囊肿被覆上皮或修剪整形卵巢组织多余上皮。病理诊断:10 例为卵巢畸胎瘤,2 例单纯性囊肿。年龄25~37岁,月经规律,无痛经史,无内分泌疾病和服激素药物史,无化疗放疗史。卵巢组织冷冻保存经医院医学伦理委员会批准同意。
1.2 实验方法
1.2.1 标本采集 采集的人卵巢组织放入室温保存的磷酸盐缓冲液中迅速转移至实验室。清洗组织,剔除卵巢髓质保留皮质部分,将卵巢组织在室温磷酸盐缓冲液(PBS)中洗涤5次,用眼科剪剪成约1 mm×1 mm×1 mm 的组织块,每例标本预留2 块作为新鲜组(A组),经40 g/L 中性甲醛固定后行常规石蜡包埋切片;余组织块作为玻璃化冷冻组(B组)。
1.2.2 组织玻璃化冷冻 将处理后的组织块浸泡在快速冷冻液中(含有5.5 mol/L 乙二醇、1.0 mol/L 蔗糖、10%胎牛血清的磷酸盐缓冲液),在室温下平衡10 min,用麦管(0.25 ml)按3 段式法装管,封口泥封口后直接投入液氮中保存1 周。
1.2.3 解冻复苏 玻璃化冻存的卵巢组织块采用3 步法依次在含有1.0 mol/L 蔗糖和10%胎牛血清的磷酸盐缓冲液,0.5 mol/L 蔗糖和5%胎牛血清的磷酸盐缓冲液,以及0.25 mol/L蔗糖和2.5%胎牛血清的磷酸盐缓冲液中逐步稀释去除冷冻保护剂,每次平衡10 min,最后在磷酸盐缓冲液中冲洗2次(每次5 min)。将解冻的卵巢组织分别放入25 g/L 戊二醛和福尔马林(40 g/L)中固定。
1.3 组织学检查 将新鲜固定组织和冻融复苏后固定组织块常规脱水、透明,每块组织单独石蜡包埋,以4μm 厚度连续切片,HE 染色后光镜下读片统计。依据Gougeon[5]标准观察卵泡形态:卵泡和卵母细胞均呈圆形,卵母细胞核无固缩,颗粒细胞分布均匀,基底膜完整的为正常卵泡结构;卵泡结构不完整或消失,卵母细胞核固缩或皱缩,颗粒细胞排列紊乱的为异常卵泡。统计每片中形态正常和异常的原始和初级卵泡比例。
1.4 免疫组化测定卵巢组织中增殖细胞核抗原(PCNA)表达 采用组织学检查的切片(PCNA 试剂盒购自北京中衫金桥公司),Envision 二步法操作测定。结果判定以光镜下组织细胞结构清晰,细胞核内见棕黄色颗粒沉着,染色明显高于背景为阳性细胞;卵母细胞或颗粒细胞PCNA 阳性表达为PCNA 阳性卵泡。同时,计数阳性卵泡比例数(PCNA 阳性卵泡/卵泡总数)。
1.5 电镜检查 在A组新鲜组织块和B组冻融组织块中各选2 块卵巢组织,经25 g/L 的戊二醛固定、包埋修块后半薄切片,甲苯胺蓝染色,光镜下定位组织学形态正常的原始卵泡,超薄切片后经醋酸铀及硝酸铅双重染色,透射电镜观察卵泡超微结构。
1.6 统计学处理 比较新鲜组织和冻融组织中原始卵泡和初级卵泡分布和形态正常比例,以及PCNA 阳性卵泡比例采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组卵巢组织光镜观察结果
2.1.1 新鲜和冻融卵巢组织卵泡计数 两组卵巢组织中主要为原始卵泡,初级卵泡明显少于原始卵泡。A组中卵泡185个,其中原始卵泡146个(86.4%),初级卵泡39个(13.6%);B组中卵泡162个,其中原始卵泡137个(84.5%),初级卵泡25个(15.5%)。A、B 两组原始和初级卵泡分布差异无统计学意义(χ2=1.37,P >0.05)。
2.1.2 新鲜和冻融卵巢组织形态 A、B 两组卵巢组织中原始卵泡大多数形态正常,分别占75.3%和69.3%,形态正常的卵泡保持圆形或椭圆形,卵母细胞核完整,颗粒细胞排列均匀,未见核固缩(图1)。但观察到部分卵泡形态异形,卵母细胞核面积缩小或固缩,胞浆比例增大,颗粒细胞排列疏松或紊乱,基底膜欠完整,部分卵泡闭锁(图2)。与A组比较,玻璃化冻融后原始卵泡光镜下形态异常率无显著性差异(P>0.05)。但是,其初级卵泡冻融后形态异常的比例(56%)高于新鲜组织(28.2%,P<0.05)。
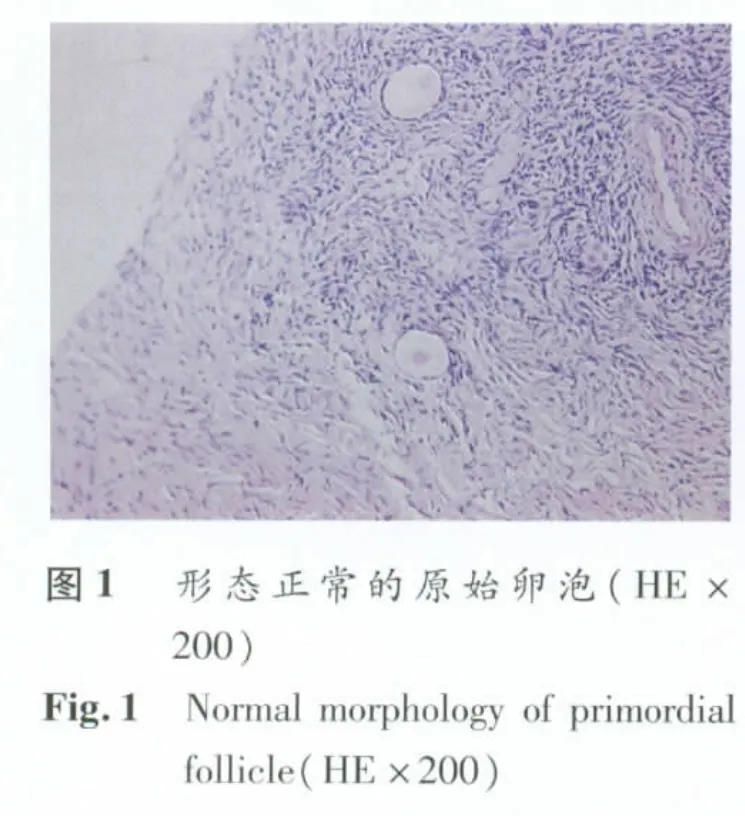
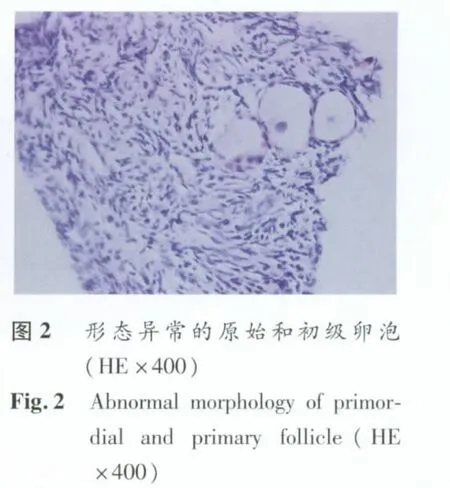

表1 新鲜组和冻融组中卵泡形态正常和异常的比例变化Table 1 The proportion of follicles with normal and abnormal morphology in fresh and frozen-thawed tissue [n,(%)]
2.2 新鲜和冻融卵巢组织PCNA 表达 新鲜和冻融后卵巢组织均可见PCNA 阳性表达,表达主要位于原始卵泡、初级卵泡以及间质细胞核内(图3A、图3B)。新鲜组织PCNA 阳性卵泡比例为15.5%,冻融组织中阳性卵泡比例为13.5%,两组比较差异无显著性(P >0.05)。
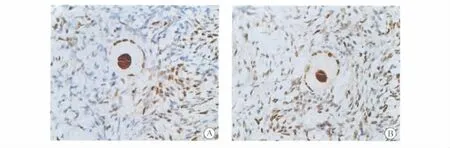
图3 PCNA 阳性表达于新鲜卵巢组织(A) 和冻融卵巢组织(B) 卵母细胞、颗粒细胞和间质细胞(×400)Fig.3 Positive expression of PCNA in oocyte and granulsa and stromal cells in fresh tissue(A) and frozen-thawed tissue(B) (envision system staining×400)
2.3 两组卵巢组织电镜观察结果 A、B 两组中均可见超微结构正常的原始卵泡,卵母细胞居中、圆形,核膜及核仁清晰完整,卵母细胞膜、核膜与线粒体膜、内质网膜完整,颗粒细胞膜完整,排列整齐,细胞间连接紧密,细胞核完整,染色质分布均匀(图4A)。但在冻融组初级卵泡中可见卵母细胞和前颗粒细胞胞浆内基质电子密度略有下降,部分线粒体和内质网肿胀并出现小空泡(图4B、图4C);个别卵母细胞及颗粒细胞胞浆中存在无细胞器区和空泡增多,严重者核膜局部凹陷甚至破裂(图4C)。
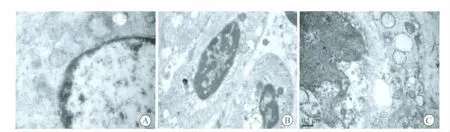
图4 新鲜和冻融卵巢组织的超微结构Fig.4 Ultrastructure of fresh and frozen-thawed ovarian tissue ultrastructure
3 讨论
慢冻速融和玻璃化冷冻是卵巢组织冷冻保存的主要方法,玻璃化冷冻技术由于保存和保持组织细胞溶液内水分子和离子的分布,极大地避免了细胞内冰晶的形成,因此冷冻保存后对人卵巢组织内原始卵泡和颗粒细胞的组织结构影响相对较小[6-7],但目前经典的慢冻速融比较玻璃化冷冻技术对卵泡质量和复苏后卵巢组织生物活性的影响尚有争议[4,8-9]。玻璃化冷冻技术有较多种改良方法,其中组织物直接与液氮接触能提高冷冻速率,但存在被微生物或病毒污染的可能[10],本实验采用较为安全的、不与液氮直接接触的麦管装载法玻璃化冷冻人卵巢组织,复苏后光学显微镜下检查原始卵泡分布比例为84.5%,与文献报到的70%~90%基本一致,原始卵泡卵母细胞和颗粒细胞异常率(30.7%)与新鲜组织(24.7%)比较也无统计学差异(P >0.05),而初级卵泡形态学异常率高于新鲜组织。这提示玻璃化冷冻对体积相对较大的初级卵泡细胞容易造成损伤,对体积较小的原始卵泡有较好的冷冻保持效率,光镜下观察组织学形态结构无明显影响。
动物实验显示,小鼠卵巢组织玻璃化冷冻后原始卵泡的超微结构无明显改变[6],而在人类卵巢组织研究中发现,无论慢冻速融和玻璃化冷冻卵巢组织原始卵泡均有一定程度的超微结构改变,这些细微的结构改变是否对进一步的组织移植后生物活性产生影响,则较难精确预测[8,11],原始卵泡发育潜能需经过组织培养和移植物检测得以验证。本实验对光镜检查无明显改变的组织细胞进一步作了透射电镜的观察,发现部分卵泡超微结构有一定改变,主要表现为部分细胞线粒体、内质网肿胀并出现少量小空泡,卵母细胞和前颗粒细胞胞浆内基质电子密度有下降,个别卵母细胞及颗粒细胞胞浆中存在无细胞器区和空泡增多,核膜凹陷,也可见部分颗粒细胞膜的不完整,这种改变在初级卵泡多见,这可能与初级卵泡代谢较原始卵泡旺盛,更容易发生冷冻损伤或组织离体后短时的缺血缺氧等有关[8,13]。在原始卵泡这种超微结构的改变较少见,而且不明显。Stefania等[13]研究发现,原始卵泡即使发生这种细微和暂时的冷冻损伤可能为复苏后组织移植存活后细胞本身所修复,并能进一步发育成初级卵泡。PCNA 表达是卵泡启动生长的最早期指标[14],本研究结果显示,新鲜和冻融卵巢组织中PCNA 均有表达,主要集中在卵母细胞、颗粒细胞和间质细胞,两者比较无统计学差异。由此推测,玻璃化冷冻能有效地保存卵巢组织中的卵泡,尤其是原始卵泡,对其组织学形态、超微结构及启动进一步发育潜能影响甚小。但玻璃化冷冻复苏异体移植后可观察到卵母细胞和颗粒细胞早期发育的非同步化[13],这是否对卵泡进一步发育造成影响有待研究。
卵巢组织的冷冻保存成为继胚胎和卵细胞冷冻之外保存女性生殖和内分泌能力的又一极具潜力手段。卵巢组织内存在大量体积小、结构简单、代谢率低、对温度低敏感的未成熟卵母细胞,其为有效冻存提供了基础。随着研究深入,玻璃化冷冻不失为一种简单而有效的冻存卵巢组织的基础技术之一。
[1]MICHAEL V W,JACQUES D,OUTI H,et al.Cryopreservation and autotransplantation of human ovarian tissue prior to cytotoxic therapy– A technique in its infancy but already successful in fertility preservation[J].Eur J Cancer,2009,45(9):1547-1553.
[2]JACQUES D,PASCALE J,JEAN S,Ovarian tissue cryopreservation and transplantation in cancer patients[J].Best Pract Res Clin Obstet and Gynecol,2010,24(1):87-100.
[3]CHEN S U,CHIEN C L,WU M Y,et al.Novel direct cover vitrification for cryopreservation of ovarian tissues increases follicle viability and pregnancy capability in mice [J].Hum Reprod,2006,21(11):2794-2800.
[4]VICTORIA K,SUSANNA X,KJELL H.Vitrification versus controlled-rate freezing in cryopreservation of human ovarian tissue [J].Hum Reprod,2009(24):1670-1683.
[5]GOUGEON A.Dynamics of follicular growth in the human:a model from preliminary results[J].Hum Reprod,1986,1(2):81-87.
[6]GANDOLFI F,PAFFONI A,PAPASSO BE,et al.Eficiency of equilibrium cooling and vitrification procedures for the cryopreservation of ovarian tissue:comparative analysis between human an d animal models [J].Fertil Steril,2006,85(Supp1):1150-1156.
[7]XIN H Z,YI-J W,JIN S.Cryopreservation of human ovarian tissue:Comparison of novel direct cover vitrification and conventional vitrification [J].Cryobiology,2010(60):101-105.
[8]ISACHENKO V,LAPIDUS I,ISACHENKO E,et al.Human ovarian tissue vitrification versus conventional freezing:morphological,endocrinological,and molecular biological evaluation [J].Reproduction,2009,138:319-327.
[9]LI Y B,ZHOU C Q,YANG,G F,et al.Modified vitrification method for cryopreservation of human ovarian tissue[J].Chinese Med J(Engl),2007,120:110-114.
[10]ISACHENKO V,ISACHENKO E,KREIENBERG R,et al.Human ovarian tissue cryopreservation:quality of follicles as a criteria of effectiveness[J].Reprod Bio Med Online,2010(20):441-442.
[11]ANDERSON R A,WALLACE W H B,BAIRD D T.Ovarian cryopreservation for fertility preservation:indications and outcomes [J].Reproduction,2008,136:681-689.
[12]LH W,MULLEN S F,LI Y,et al.Morphological and apoptotic comparison of primordial and primary follicles in cryopreserved human ovarian tissue[J].Reprod Dom Anim,2009,44:879-883.
[13]STEFANIA A N,ALESSANDRA C,ANNE V L,et al.Cryopreservation and xenotransplantation of human ovarian tissue:an ultrastructural study[J].Fertil and Steril,2008,90(1):23-32.
[14]OKTAY K,SCHENKEN R S,NELSON J E.Proliferation cell nuclear antigen marks the initiation of follicular growth in the rat[J].Biol Reprod,1995,53(2):295-301.

