电生理监测下脊髓黏液乳头型室管膜瘤显微外科治疗
王 博 刘丕楠 张 忠 王 昊 陶晓蓉 乔 慧 王贵怀 杨 俊▲
1.首都医科大学附属北京天坛医院神经外科,北京 100050;2.首都医科大学北京市神经外科研究所,北京 100050
脊髓室管膜瘤是最常见的髓内肿瘤,约占脊髓髓内肿瘤的60%,可以发生在颈、胸、腰、骶和马尾、终丝等任何部位。一般认为脊髓室管膜瘤是生物学行为偏良性的肿瘤,手术全切肿瘤可以获得较好的预后[1]。黏液乳头型室管膜瘤(myxopapillary ependymoma,MPE)是好发于脊髓骶尾部的一种室管膜瘤亚型(WHOⅠ级),因部分肿瘤与马尾神经、圆锥粘连极其紧密,强行切除常导致严重神经功能障碍,而部分切除肿瘤极易复发及播散[1-3]。北京天坛医院主要应用术中肌电图(EMG)监测辅助对13例脊髓黏液乳头型室管膜瘤进行显微外科切除,取得了良好的效果,现报道如下:
1 资料与方法
1.1 一般资料
回顾性分析了1998年6月~2012年6月北京天坛医院收治的13例患者的临床资料,其中,男10例,女3例;年龄10~47岁,平均27.2岁;病程1个月~2.5年,平均11个月;临床表现:腰背部疼痛10例,坐骨神经痛7例,下肢无力、麻木伴浅感觉减退8例,括约肌功能障碍6例,4例男性患者诉有性功能减退。
1.2 影像学检查
本组病例患者术前、术后均行MRI平扫及增强检査,依据MRI结果计数病变累及椎体节段数目,病变对椎体本身侵袭情况。
1.3 方法
1.3.1 麻醉 术中采用静脉复合麻醉或静吸复合麻醉,特别强调的是术中如无特殊情况不予应用肌松剂,注意保持血压和体温稳定。
1.3.2 电生理监测 监测设备采用美国Cadwell Cascade 16导术中诱发电位监测系统。其中监测参数如下,术中自发肌电图连续监测(Free-EMG):记录部位:肛门外括约肌;记录参数:带通滤波范围 10~30 000 Hz;分析时间:10 ms;打开50 Hz或60 Hz限波滤波器。术中诱发肌电图(Trigger-EMG):脉宽:100 μs;刺激频率:2.79 Hz;刺激量:20 mA[4-5]。
1.3.3 手术方法 术前均行X线下椎管定位,术中患者均采用侧俯卧位,采用后正中入路,纵向切开硬脊膜并悬吊,在电生理监测下行肿瘤切除,术后如肿瘤全切无脊髓肿胀则连续严密缝合硬脊膜并应用钛片复位椎板,使脊柱解剖复位保持稳定性。
1.4 切除范围限定及疗效评价
依据术后MRI同术前MRI的对比,本组病例设定切除范围:全切除,近全切除(> 95%),大部切除(80%~95%),部分切除(<80%)。术前、术后均采用McCormick[6]评分方法对患者脊髓功能进行分级。
2 结果
本组13例患者中7例患者做到手术全切,这7例病变的特点为病变体积较小(均小于2个椎体节段),有完整包膜,且包膜同圆锥、马尾神经粘连较轻,术中可沿包膜完整将肿瘤切除,包膜无破损。近全切除3例,大部分切除2例。近全切除及大部切除的病变特点为术中虽可见包膜,肿瘤局部可沿包膜完整分离并切除,但部分病变向上嵌入脊髓圆锥或向下包绕马尾神经,或同圆锥及马尾神经粘连极其紧密无法分离,仅能在电生理监测下沿肿瘤大致边界分离并切除。本组病例中仅1例肿瘤部分切除,该病例为肿瘤复发,病变累及多个节段,仅能做部分切除。全组病例无手术死亡。
本组病例的随访时间为5个月~14年,平均33.2个月,随访期间原位复发2例,播散1例。对于复发及播散病历手术仍是首选治疗方案,术后建议行放疗。
本组患者脊髓功能改善6例(46%),其中有4例术前为Ⅱ级术后变为Ⅰ级,另有2例术前为Ⅲ级术后变为Ⅱ级,稳定无变化4例(13%),4例患者术前脊髓功能均为Ⅰ、Ⅱ级。加重3例(23%),其中2例由术前Ⅰ级变为术后Ⅱ级,1例由于复发及播散由术前Ⅱ级变为术后Ⅲ级。
13例患者术中均应用连续肌电图监测,均监测到自发肌电反应,其中1例患者病变多发,累及多个脊髓节段,术中联合应用体感诱发电位(SEP)及运动诱发电位(MEP)进行监测。本组患者术后无括约肌功能障碍及下肢瘫痪等严重神经功能障碍出现。
3 讨论
脊髓室管膜瘤起源于脊髓中央管表面或终丝的室管膜细胞,黏液乳头型室管膜瘤是室管膜瘤的一种亚型,主要见于20~50岁成年人,而且大多数发生在脊髓的圆锥、马尾和终丝部,占这一区域原发性肿瘤的90%。2007年WHO将室管膜瘤的肿瘤组织学分级定为:黏液乳头型室管膜瘤、室管膜下瘤为WHOⅠ级;室管膜瘤为WHOⅡ级;间变性室管膜瘤为 WHOⅢ级[1-3,7]。黏液乳头型室管膜瘤肉眼观察一般呈紫红色,呈半透明状,包膜菲薄,瘤内血管丰富,局部合并出血。电镜下观察由立方形或长梭形瘤细胞构成,分化好,核呈卵圆形,核分裂象罕见,单层或多层围绕纤维血管间质呈乳头状排列,有较多黏液样物质将瘤细胞和玻璃样变的轴心分隔开,并聚集成微囊[8-9]。由于病变主要位于脊髓圆锥及马尾,患者的首发症状多为腰背部疼痛及坐骨神经痛,病变体积较大可能出现双下肢无力及括约肌功能障碍。MRI增强检查是首选的检查方法,主要特点为T1WI上病灶为等或稍低信号,T2WI上病灶呈不均匀稍高信号,增强后病灶呈显著不均匀强化(图1)。本组病例中有3例肿瘤伴有囊变,2例病灶侵袭椎体。未侵袭椎体的病变需同神经鞘瘤、血管母细胞瘤、星形细胞瘤、畸胎瘤鉴别,侵袭椎体的病变需同神经鞘瘤、脊索瘤鉴别[7,10]。
3.1 术中电生理监测方法的选择及麻醉配合
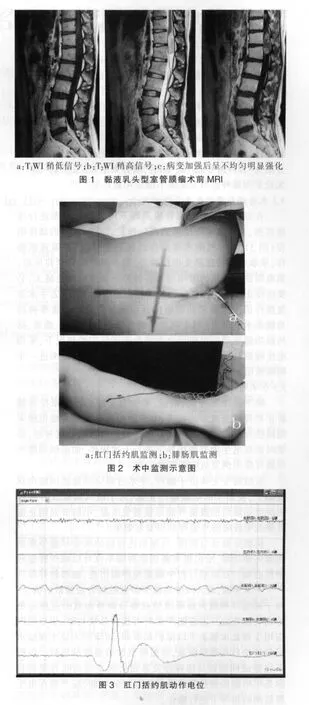
黏液乳头型室管膜瘤主要位于脊髓圆锥及马尾,位置较低,累及运动传导通路和感觉传导通路的可能性较小,即使术中联合应用SEP及MEP进行监测术中阳性率较低,本组患者主要应用自发肌电图进行连续性监测,对于可疑的组织采用诱发肌电图来明确是否具有神经功能。在本组患者手术中主要保护患者肛门外括约肌和下肢运动功能,因此选用肛门括约肌和腓肠肌作为主要监测的对象(图2)。本组病例中1例患者因病变累及多个节段,术中联合应用SEP、MEP、EMG进行监测,有效的保留了患者的运动、感觉及括约肌功能。若术中仅应用EMG进行监测,则麻醉可采用静脉复合麻醉或静吸复合麻醉,若联合应用SEP、MEP、EMG进行监测,则仅能采用静脉复合麻醉,本组病例方案为:异丙酚 6 mg/(kg·min)、瑞芬太尼 0.2 μg/(kg·min),无论采用哪种监测方法都不能应用肌松剂[4-5,11]。
3.2 电生理监测同手术医师的配合
在显微镜下切开硬脊膜后即采用自发肌电图进行连续监测,如果肌电图记录到高频暴发式或一连串的动作电位(图3),及时提醒术者操作已接近重要结构,需谨慎操作,采取适当措施避免损伤神经,减少对神经的牵拉压迫,肌电图波形出现的时间越长,神经损伤的可能性越大,必要时停止手术等待肌电图波形恢复后继续手术。若手术重复操作仍出现异常动作电位预示该部位组织有重要神经功能需术中保留。对于高度怀疑可能会引起运动、感觉、括约肌功能障碍的组织而自由肌电图无反应的情况下,采用电生理刺激器直接进行电刺激,通过诱发肌电图来进一步明确该组织的功能[4,11]。
3.3 手术的技巧
镜下操作要轻柔、精确,术中力求最小程度牵拉脊髓防止对脊髓造成新的损害,分离肿瘤时最好沿肿瘤包膜采用锐性分离,术中切勿随意切开圆锥或切断马尾神经,必要时需在电生理监测指导下进行上述操作,如组织功能不明确可应用诱发肌电图明确功能。
虽然病变主体位于髓外,手术过程应尽量使用髓内双极镊子,使用小的电凝输出止血,对于嵌入圆锥或者髓内的肿瘤切除后的残留界面尽量避免电凝,小的渗血用止血纤维或明胶海绵压迫可获得良好效果。
包膜完整且与圆锥、马尾粘连较轻的病变尽量争取沿包膜完整切除,沿包膜完整切除肿瘤不仅可以减少肿瘤残留机会而且在取瘤过程中能避免肿瘤出血,能够较好保持一个手术界面,最大限度地减少肿瘤随脑脊液播散的机会,对于肿瘤体积较大妨碍清楚观察分离界面或沿包膜完整分离有困难或压迫脊髓严重时可选择分块切除,病变周围应用生理盐水棉条予以保护和限制,切除后大量生理盐水反复冲洗后再撤除棉条,尽量降低肿瘤播散的风险。包膜不完整或同圆锥马尾神经关系密切病变的切除首要的目标是尽可能的保护圆锥及马尾神经的功能,应严格在电生理监测的指导下进行操作。
术后硬脊膜严密缝合、椎板解剖复位对于降低术后脑脊液漏、避免感染和伤口延迟愈合、保持脊柱的稳定性有重要意义,但对于肿瘤切除后脊髓压力下降不显著及病变未能全切术后建议放疗的患者应用人工硬脊膜减张缝合,并去除椎板使脊髓达到充分减压的目的。
3.4 术后放疗
脊髓黏液乳头型室管膜瘤的患者术后是否放疗目前存在争议。Alessia等[12]认为尽管脊髓黏液乳头型室管膜瘤的病理分型为WHOⅠ级,但应看作恶性肿瘤来处理,无论是否全切术后常规放疗对于抑制肿瘤复发有重大的意义,Ross等[13]认为对于全切和近全切除的病例放疗与否无明显差别。考虑到放疗的并发症等因素,本组肿瘤全切的患者未行放射治疗,无1例复发。2例复发及1例出现播散的患者均未遵医嘱行放射治疗。其中1例患者为近全切除。笔者认为对于脊髓黏液乳头型室管膜瘤的患者关键是争取对肿瘤的全切除,未能达到全切除的患者建议放疗。
[1]Bagley CA,Kothbauer KF,Wilson S,et al.Resection of myxopapillary ependymomas in children[J].J Neurosurg,2007,106(4 Suppl):261-267.
[2]DiLuna ML,Levy GH,Sood S,et al.Primary myxopapillary ependymoma of the medulla:case report[J].Neurosurgery,2010,66(6):1208-1209.
[3]Yoshihito Sakai,Yukihiro Matsuyama,P Yoshito Katayama,et al.Spinal myxopapillary ependymoma neurological deterioration in patients treated with surgery[J].Spine,2009,34(15):1619-1624.
[4]Sala F,Palandri G,Basso E,et al.Motor evoked potential monitoring improves outcome after surgery for intramedullary spinal cord tumors:a historical control study[J].Neurosurgey,2006,58(6):1129-1143.
[5]陶晓蓉,乔慧,李群喜,等.运动诱发电位联合体感诱发电位监测在脊髓髓内肿瘤手术中的应用[J].中华神经外科杂志,2010,26(12):1086-1089.
[6]Mc Cormiek PC,Tortes R,Post KD,et al.Intramedullary ependymoma of the spinal cord[J].J Neurosurg,1990,72(4):523-532.
[7]Oztekin O,Ozan E,Unal G,et al.An unusual presentation of myxopapillaryependymomawithfaecalincontinenceandliterature review[J].Eur Spine J,2009,71(3):113-115.
[8]Nakama S,HigasIli T,Kinllra A,et al.Double,myxopapillary ependymoma of the cauda equina[J].Orthop Sci,2005,10(5):543-545.
[9]余丽萍,周志毅,程静,等.黏液乳头型室管膜瘤10例临床病理分析[J].诊断病理学杂志,2008,15(2):88-91.
[10]Gerber S,Ollivier L,Leclère J,et al.Imaging of sacral tumours[J].Skeletal Radiol,2008,37(4):277-289.
[11]Weinzierl MR,Reinaeher P,Gihbach JM,et al.Combined motor and somatosensory evoked potentials for intraoperative monitoring:intraand postoperative data in a series of 69 operations[J].Neurosurg Rey,2007,30(2):109-116.
[12]Alessia P,Robert M,Slvador V,et al.The results of surgery,with or without radiotherapy,for primary spinal myxopapillary ependymomas:a retrospective study form the rare cancer network[J].Int J Radiation Oncology Biol Phys,2009,74(4):1114-1120.
[13]Ross GW,Rubinatein LI.Lack of histopathologieal correlation of malignant ependymomas with postoperative survival[J].J Neurosurgery,1989,70(1):31-36.

