羧甲基茯苓多糖脂质体的制备及其包封率的测定
赵永新 赵子剑 王 邹
怀化学院,湖南怀化 418000
羧甲基茯苓多糖(CMP)系多孔菌真菌茯苓中β-茯苓聚糖的衍生物,具有增强免疫、抗肿瘤、抗病毒、抗放射、保肝、抗衰老、镇静等作用,目前临床上已应用的剂型主要有口服液、胶囊、片剂等。CMP 在人体内的半衰期比较短,因此作为一种具有免疫调节作用的抗肿瘤辅助药物,在临床上的应用受到明显的限制。笔者将羧甲基茯苓多糖制备成脂质体,旨在利用脂质具有靶向性和淋巴定向性、缓释性、细胞亲和性与组织相容性、降低药物毒性、保护药物提高稳定性等特点,从而改变药物在体内的分布,延缓药物在体内的释放,降低药物的毒性[1-5]。羧甲基茯苓多糖脂质体的不断发展,可以为临床抗肿瘤治疗提供更加方便、有效的新剂型,具有巨大的市场潜力,可以创造良好的社会效益和经济效益。
1 仪器与试剂
1.1 仪器
旋转蒸发仪(郑州长城科工贸有限公司),SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器有限责任公司),烧瓶,容量瓶,恒温水浴锅(郑州长城科工贸有限公司),DW-2型多功能电动搅拌机(巩义市予华仪器有限责任公司),紫外分光光度仪(日本岛津制造UV-2450),800 型电动离心机(江苏金坛市金城国胜实验仪器厂),电子天平,烧瓶,容量瓶。
2.2 试药
羧甲基茯苓多糖,大豆卵磷脂(江苏曼氏生物科技有限公司),胆固醇(南京新百药业有限公司),无水乙醚(分析纯,天津市科密欧化学试剂有限公司),磷酸氢二钠,磷酸二氢钠。
2 方法与结果
2.1 实验制备方法
2.1.1 实验处方
本组研究中,一共选择6 种不同的处方作为研究对象:①将1.5g 大豆磷脂、0.5g 胆固醇以及10 mL 无水乙醚加入到1 mg/L的CMP 溶液50 mL 中,制成50 mL的脂质体。②将1.5g 大豆磷脂、0.5g 胆固醇以及10 mL 无水乙醚加入到10 mg/L的CMP 溶液50 mL 中,制成50 mL的脂质体。③将1.5g 大豆磷脂、0.5g 胆固醇以及10 mL 无水乙醚加入到20 mg/L的CMP 溶液50 mL 中,制成50 mL的脂质体。④将1.5g 大豆磷脂、0.5g 胆固醇以及10 mL 无水乙醚加入到50 mg/L的CMP 溶液50 mL 中,制成50 mL的脂质体。⑤将1.5g 大豆磷脂、0.5g 胆固醇以及10 mL 无水乙醚加入到100 mg/L的CMP 溶液50 mL 中,制成50 mL的脂质体。⑥将1.5g 大豆磷脂、0.5g 胆固醇以及10 mL 无水乙醚加入到50 mL 磷酸盐(PBS)缓冲液中,制成50 mL的脂质体。
2.1.2 磷酸盐缓冲液(PBS)的制备
称取磷酸氢二钠(Na2HPO4)5.59 g 与磷酸二氢钠(NaH2PO4)0.41 g,加蒸馏水适量,溶解并稀释至 1 000 mL(pH 约为 7.8),摇匀[6]。
2.1.3 空白脂质体的制备
2.1.3.1 称取处方量磷脂,胆固醇,至于100 mL 烧瓶中,加无水乙醚10 mL,55℃水浴中,搅拌使溶解,于旋转蒸发仪上旋转,使磷脂的乙醚在壁上成膜,除去乙醚,制备磷脂膜[7]。
2.1.3.2 另取磷酸缓冲液50 mL 至于小烧杯内,同置于55℃水浴中,保温,待用[8]。
2.1.3.3 取预热的磷酸盐缓冲液50 mL,加至含有磷脂膜的烧瓶中,转动下,55℃水浴中水化10~20 min。取出脂质体液体于烧杯内,置于磁力搅拌器上,室温,搅拌30~60 min,混匀,即得[9]。
2.1.4 含药脂质体的制备
2.1.4.1 称取适量的羧甲基茯苓多糖,用磷酸缓冲液分别配成 1、10、20、50、100 mg/mL 的 5种浓度的溶液来配制羧甲基茯苓多糖溶液。
2.1.4.2 称取处方量磷脂,胆固醇,至于100 mL 烧瓶中,加无水乙醚10 mL,55℃水浴中,搅拌使溶解,于旋转蒸发仪上旋转,使磷脂的乙醚在壁上成膜,除去乙醚,制备磷脂膜。
2.1.4.3 另取羧甲基茯苓多糖溶液50 mL(1 mg/mL)置于小烧杯内,同置于55℃水浴中,保温,待用。
2.1.4.4 取预热的液羧甲基茯苓多糖溶液50 mL,加至含有磷脂膜的烧瓶中,转动下,55℃水浴中水化10~20 min。取出脂质体液体于烧杯内,置于电动搅拌器上,室温,搅拌30~60 min,混匀,即得。
2.1.4.5 按照上面的方法依次制备浓度为10、20、50、100 mg/mL的羧甲基茯苓多糖溶液的脂质体。
2.2 羧甲基茯苓多糖脂质体含量测定的方法
2.2.1 羧甲基茯苓多糖溶液的配制
精确称取羧甲基茯苓多糖0.1 g,加入到100 mL的量瓶中,加二次蒸馏水至刻度,定容摇匀,配制成1 g/L的羧甲基茯苓多糖溶液,待用。
2.2.2 测定波长的选择
用移液管吸取5mL的1 g/L的CMP 溶液于50 mL的容量瓶中配制成100 mg/L的CMP 溶液。精密量取该溶液2 mL,置20 mL 具塞试管中,分别加入80%的苯酚溶液50 μL 以及浓硫酸 5mL,摇匀,静置 10 min,置于 25~30℃的水浴中保温20 min。以2 mL 二次蒸馏水代替CMP 溶液,同法所得为空白溶液。绘制450~250 nm的吸收曲线。CMP的最大吸收波长为298 nm。
2.2.3 标准曲线的制备
精密称取CMP 10 mg 于100 mL 容量瓶中,用二次蒸馏水定容至100 mL,振摇得浓储备液。精密量取浓储备液适量于50 mL的容量瓶中,加二次蒸馏水定容至刻度,制备浓度分别为 1、10、20、50、100 mg/L 的溶液, 以二次蒸馏水为空白溶液,于298 nm 波长处测定吸收度。
2.3 羧甲基茯苓多糖脂质体包封率的测定
量取羧甲基茯苓多糖脂质体溶液2 mL,加pH 7.8的PBS 缓冲液2 mL 混匀,待脂质体凝聚,然后于电动离心机(2 000 r/min)上离心30 min,将上清液定量稀释;另外量取羧甲基茯苓多糖脂质体溶液2 mL,加入无水乙醚2 mL 破坏脂质体后,用PBS 定量稀释,然后于扫描到的紫外吸收
的最大吸收峰所对应的波长处测定上清液和总药的吸收度,带入标准曲线,计算羧甲基茯苓多糖的浓度,按下式计算药物的包封率:包封率=(C总-C上清/C总)×100%,其中,C上清为上清液中所测得药物浓度,C总为羧甲基茯苓多糖脂质体测得的药物浓度[10]。
2.4 结果
2.4.1 含量测定方法学考察
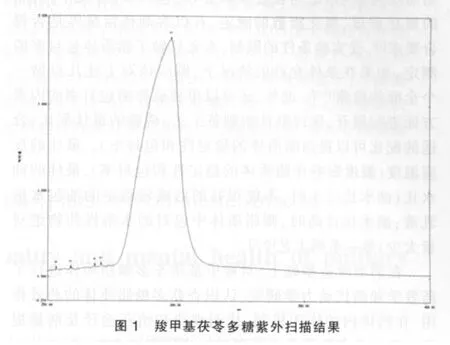
2.4.1.1 紫外扫描结果表明,在298 nm 波长处羧甲基茯苓多糖有最大吸收,见图1。
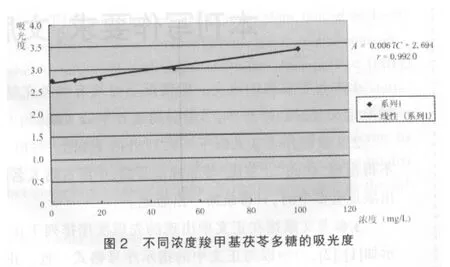
2.4.1.2 以CMP的吸收度A 对CMP的浓度C 进行线性回归,得线性方程为:A=0.006 7C+2.694,r=0.992 0,羧甲基茯苓多糖在1~100 mg/L 浓度范围内吸光度(A)与浓度(C)线性良好。 羧甲基茯苓多糖在浓度为 1、10、20、50、100 mg/L 时,吸光度分别为 2.74、2.765、2.78、2.99、3.39,见图2。
2.4.2 羧甲基茯苓多糖脂质体包封率的测定
不同浓度的羧甲基茯苓多糖脂质体有不同的包封率,在1~50 mg/L 之间包封率明显增加,而在50~100 mg/L 之间则有所下降,并且在50 mg/L 处包封率值最大。见表1。
3 讨论
羧甲基茯苓多糖为水溶性物质,因脂质体对水溶性药物的包封率较低,适合水溶性药物脂质体的制备方法为逆向蒸发法[11]。但由于受实验条件的影响,本文中羧甲基茯苓多糖脂质体的制备采用薄膜分散法制备,旨在寻找适合制备羧甲基茯苓多糖脂质体的最佳药物浓度,并且采用离心分离法测定脂质体的包封率[12]。而在脂质体的质量评价中则需要考察:形态与粒径及其分布,包封率,渗漏率,磷脂的氧化程度,氧化指数的测定,有机溶剂残留量等是否符合要求[13]。受实验条件的限制,本文只做了脂质体包封率的测定,如果在条件允许的情况下,则应该对上述几点做一个全面的检测[14-15]。此外,还可以单独就影响包封率的因素方面进行展开,探讨最佳的制备工艺:磷脂的最佳配比(合适的配比可以提高脂质体的稳定性和包封率),最佳的反应温度(温度影响在脂质体的稳定性和包封率),最佳的油水比(油水比过小时,不能很好的形成较稳定的油包水形乳液;油水比过高时,则脂质体中包封的水溶性药物绝对量太少)等一系列工艺[16-17]。
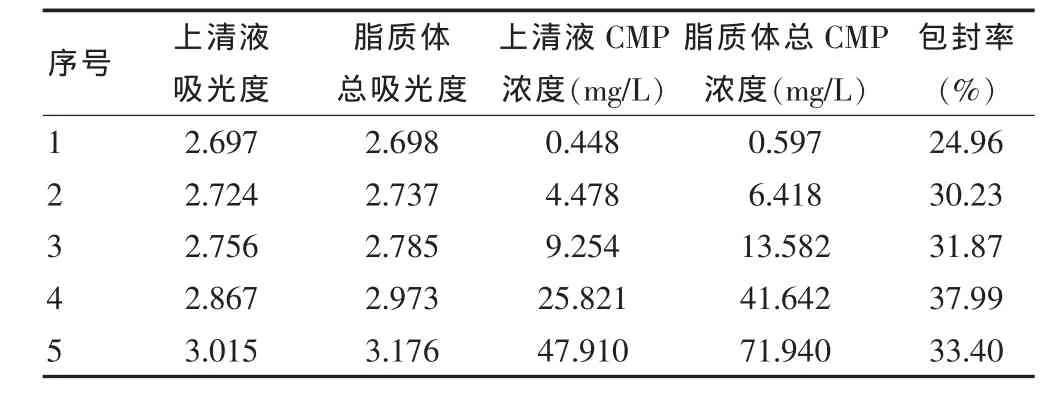
表1 不同浓度羧甲基茯苓多糖脂质体的比较
在剂型改造基础上,对羧甲基茯苓多糖脂质体进行了药效学和药代动力学研究,认识香菇多糖脂质体的药效作用、在机体内的作用机制、代谢规律和给药途径及剂量提供宝贵的参考数据是本课题进一步研究的方向。
[1] 崔福德.药剂学[M].北京:人民卫生出版社,2008:420-426.
[2] 田景振,张玉娟.脂质体的研究进展[J].齐鲁药事,2004,23(1):40-41.
[3] 李祖惠,杨辉.脂质体药物研究进展[J].中国药业,2005,14(10):75-76.
[4] 杨静,周邵兵.载药脂质体的研究与应用进展[J].现代生物医学进展,2007,7(10):1597-1600.
[5] 金惠,赵英博,江维,等.茯苓药理作用及临床应用研究进展[J].湖北中医杂志,2008,30(4):59-61.
[6] 陈春霞.羧甲基茯苓多糖的化学研究[J].中国食用菌,2005,13(5)35-36.
[7] 张璐,刘强.茯苓多糖制备工艺及药理作用研究进展[J].中国实验方剂学杂志,2006,12(4):61-63.
[8] 叶兆伟,承伟.脂质体包封率测定方法及影响因素[J].中国生物制品学杂志,2007,12(10):789-792.
[9] 郭海燕,莫穗林.脂质体物理稳定性和包封率的影响因素[J].中国新药杂志,2004,13(6):498-501.
[10] 窦有业,窦薇.茯苓及羧甲基茯苓多糖的研究概况[J].中国药师,2005,8(3):244-245.
[11] 黄君勤,孔俐文.盐酸吉西他滨脂质体的制备及含量和包封率的测定学性质[J].中国抗生素杂志,2010,35(1):30-32.
[12] 郭咸希,王晖,阮亮,等.比色法测定血浆中羧甲基茯苓多糖的含量[J].中国医院药学杂志,2006,26(7):830-831.
[13] 陈春霞.羧甲基茯苓多糖含量测定的两种方法[J].食用菌,2008,(3):38-39.
[14] 林宁.药剂学实验[M].北京:中国医药科技出版社,1998:106-108.
[15] 黄义昆,杜娟,李志.凝胶过滤法和离心法测定盐酸川芎嗪脂质体包封率比较[J].华中国医院药学杂志,2006,26(7):830-831.
[16] 丁艳,王金萍,潘瑶,等.替莫唑胺脂质体制备工艺研究[J].齐鲁药事,2010,29(2):111-112.
[17] 仵文英,席枝侠,薛红安.紫外分光光度法测定黄芩苷脂质体的包封率与渗漏率[J].医药导报,2005,24(7):624-625.

