右美托咪定对大鼠肾缺血/再灌注损伤保护作用的研究
吕 鹏,陈克研,周 锦,刁玉刚,张铁铮
肾移植是当今治疗终末期肾脏疾病最理想的方法之一。从50年前第1例肾移植成功至今,已超过50万例肾衰竭患者通过肾移植延续生命[1]。然而,肾移植围术期缺血再灌注损伤的问题至今尚未解决。由于肾脏自身的结构特点使其成为IRI中最为敏感的器官之一[2]。当肾脏缺血时,血流量减少,肾小管内皮细胞损坏,导致肾小管堵塞,再灌注后,细胞代谢功能紊乱,炎症介质释放,炎症反应加剧[3-5]。目前,在 IR肾脏损伤的防治研究中,启动肾脏内源性保护机制尤显重要,用药物激活或抑制机体某些因子从而保护肾组织,对肾移植和移植物的功能恢复有着重要意义[6-8]。右美托咪定(Dexmedetomidine,Dex)是一种高度选择性α2肾上腺素受体激动剂,具有镇静、镇痛、利尿、抗焦虑、无呼吸抑制、器官保护等特性[9-10]。本研究旨在观察右美托咪定对肾缺血再灌注损伤的保护作用,为防治肾移植术中的缺血/再灌注损伤提供理论依据。
1 材料与方法
1.1 实验动物与分组 清洁级SD大鼠40只,雄性,体质量250~300 g,由我院实验动物科提供,随机分4组,每组10只。假手术组(S组):行右肾切除;缺血再灌注组(I/R组):右肾切除,左肾缺血45 min,再灌注60 min制备肾缺血再灌注模型;Dex预处理组(Pre/Dex组):于大鼠股静脉穿刺后泵注 1 μg/kg Dex 10 min 后改为0.5 μg/kg,泵注30 min直至缺血即刻;Dex后处理组(Post/Dex组):自左肾再灌注即刻静脉泵注1 μg/kg右美托咪定,10 min后改为0.5 μg/kg,泵注30 min停止。
1.2 麻醉及模型建立 术前大鼠禁食禁饮6 h。腹腔注射10%水合氯醛(3 mg/kg)实施麻醉。仿照文献报道[11]的方法建立肾I/R损伤模型。具体步骤如下:腹中线4~5 cm切口,沿腹白线剪开,暴露腹腔;将回小肠、结肠和脾脏移至左侧,分离右肾,结扎肾蒂,取出右肾;将小肠、结肠、脾脏移至右侧,显露左侧肾脏和左肾蒂,用无损伤血管夹夹闭肾蒂;45 min后松开左肾血管夹,恢复灌注,见肾脏从暗紫色转成红色则说明I/R模型建立成功;缝合关闭腹腔。
1.3 标本采集与检测 模型建立成功后6 h将各组实验鼠眼球放血,收集血液,3 000 r/min离心5 min,将上清吸出,移入1.5 mL离心管中,-80℃保存备用;取部分肾组织固定于中性福尔马林液中,其余部分存放于-80℃冰箱保存。应用全自动生化分析仪检测血清尿素氮和肌酐;用酶联免疫吸附试验(ELISA)试剂盒检测血清中IL-1、TNF-α。
1.4 统计分析 应用SPSS 19.0软件进行统计学分析,实验数据以±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 肾脏病理组织学变化 与S组相比,I/R组肾脏损伤严重,炎症明显,肾小管扩张、充血、水肿,有肾小球肾炎表现;而Dex预处理和后处理组肾脏损伤明显减轻,炎症降低,细胞形态异常较少(见图1)。
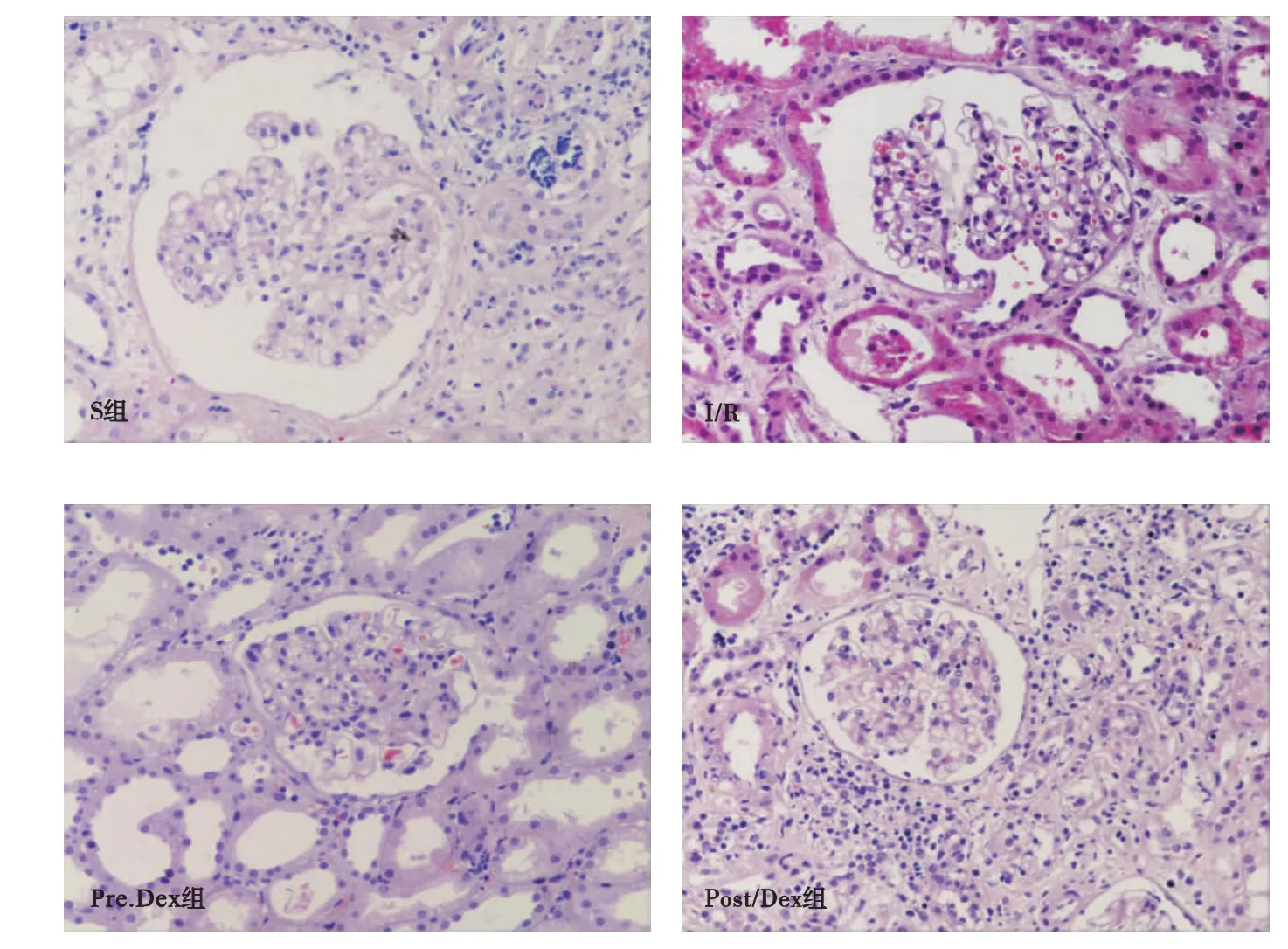
图1 肾脏缺血再灌注损伤的病理组织学观察结果(×200)
2.2 肾功能检测 各组血清经生化检测仪检测,结果如表1所示,与S组相比,各实验组肌酐和尿素氮显著升高(P<0.05),Pre/Dex组和Post/Dex组肌酐和尿素氮含量差异无统计学意义(P>0.05),但明显低于R组(P<0.05)。

表1 各组血清肌酐和尿素氮检测结果
2.3 炎症因子检测 用ELISA试剂盒对血清中IL-1β和TNF-α含量进行检测,结果如表2所示。与S组相比,各实验组IL-1β和TNF-α含量均显著升高(P<0.05);Pre/Dex组和Post/Dex组IL-1和TNF-α含量比较差异无统计学意义(P>0.05),但均低于R组(P<0.05)。
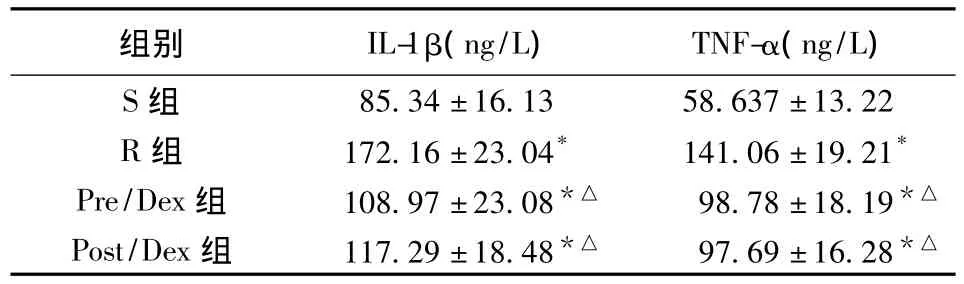
表2 各组炎症因子比较
3 讨论
目前,IRI已成为临床常见的病理现象,由于肾脏结构和功能的特殊性,肾移植手术中发生的缺血再灌注损伤尤为典型和严重,也更多地引发研究者的重视。IRI的发生机制主要分缺血阶段和再灌注阶段。肾组织缺血时血流量下降,肾脏处于缺氧状态,再灌注后虽然缺血的组织恢复血流,但能量代谢发生障碍,细胞通透性改变,激活炎症反应,加剧组织的损伤[12]。本研究通过建立的大鼠IRI动物模型模拟临床肾I/R过程,结果发现肾脏再灌注6 h后损伤严重,HE染色后其肾小管扩张、炎症明显,有肾小球肾炎表现。血生化检测证实其肌酐和尿素氮的含量明显增高。该结果一方面证明大鼠IRI模型建立成功,另一方面说明IRI后肾组织损伤严重。
炎症过程始于血管内皮损伤和肾小管细胞功能障碍,一系列的免疫调节细胞因子,包括IL-1β、IL-6、IL-8、TNF-α 和单核细胞趋化蛋白1(MCP-1),分别释放入肾组织和血液循环[13]。在 IRI过程中,肾小管上皮细胞产生的 TNF-α、IL-1β、IL-6和IL-18等细胞因子促使血管黏附分子表达增高,从而介导白细胞和内皮细胞的黏附作用[14]。本研究结果表明,肾脏缺血45 min,再灌注6 h后血清中IL-1β和TNF-α含量明显增高。可见,炎症反应在IRI过程中发挥重要作用。
Dex可以维持肾髓质血流,从而防止造影剂肾病,保护肾脏,并可激动中枢和外周交感神经的突触前膜肾上腺素能受体,从而减弱外科手术引起的应激反应,起到镇静和镇痛的作用[15]。此外,Dex有维持血流动力学稳定的作用,当循环血量减少时,可使心输出量重新分配,保证重要脏器的灌注,维持肾血流量和肾小球滤过[16]。在本研究中,分别在大鼠I/R模型中实施Dex预处理和后处理,血生化结果显示,两组中肌酐和尿素氮的含量差异无统计学意义(P>0.05),但均明显低于 I/R组(P<0.05);肾脏病理组织学观察结果显示,Dex两组中肾脏损伤明显减少。说明Dex在I/R中对肾脏有一定的保护作用。
综上所述,肾缺血再灌注可导致以炎性反应为特征的肾损伤;右美托咪定通过减轻炎性反应,从而减轻肾缺血再灌注损伤,具有一定的肾保护作用。
[1]Yoshitomi T,Kohjitani A,Maeda S,et al.Dexmedetomidine enhances the local anesthetic action of lidocaine via an alpha-2A adrenoceptor[J].Anesth Analg,2008,107:96-101.
[2]Wagner DS,Brummett CM.Dexmedetomidine:As safe as safe can be[J].Semin Anesth Perioper Med Pain,2006,25:77-83.
[3]Tan JA,Ho KM.Use of dexmedetomidine as a sedative and analgesic agent in critically ill adult patients:a meta-analysis[J].Intensive Care Med,2010,36:926-939.
[4]赵天,杨橙,胡林昆,等.促红细胞生成素衍生肽的制备和鉴定及对大鼠肾缺血再灌注损伤的保护作用[J].中国临床医学,2011,18(1):25-28.
[5]侯宝军,任长虹,李恩颉,等.远程缺血预适应研究进展[J].中国医药,2013,8(6):871-873.
[6]Siobal MS,Kallet RH,Kivett VA,et al.Use of dexmedetomidine to facilitate extubation in surgical intensive-care-unit patients who failed previous weaning attempts following prolonged mechanical ventilation:A pilot study[J].Respir Care,2006,51:492-496.
[7]Short J.Use of dexmedetomidine for primary sedation in a general intensive care unit[J].Crit Care Nurse,2010,30(1):29-38.
[8]Shehabi Y,Botha JA,Ernest D,et al.Clinical application,the use of dexmedetomidine in intensive care sedation[J].Crit Care Shock,2010,13:40-50.
[9]Riker RR,Shehabi Y,Bokesch PM,et al.Dexmedetomidine vs mid zolam for sedation of critically ill patients:a randomized trial[J].J Am Med Assoc,2009,301:489-499.
[10]Phan H,Nahata MC.Clinical uses of dexmedetomidine in pediatric patients[J].Paediatr Drugs,2008,10:49-69.
[11]Paul S,Bhattacharjee DP,Ghosh S,et al.Efficacy of intra-articular dexmedetomidine for postoperative analgesia in arthroscopic knee surgery[J].Ceylon Med J,2010,55:111-115.
[12]Kielar PP,Pun BT,Herr DL,et al.Effect of sedation with dexmedetomidine vs lorazepam on acute brain dysfunction in mechanically ventilated patients:The MENDS randomized controlled trial[J].JAMA,2007,298:2644-2453.
[13]Olutoye OA,Glover CD,Diefenderfer JW,et al.The effect of intraoperative dexmedetomidine on postoperative analgesia and sedation in pediatric patients undergoing tonsillectomy and adenoidectomy[J].Anesth Analg,2010,111:490-495.
[14]Nguyen NQ,Chapman MJ,Fraser RJ,et al.The effects of sedation on gastric emptying and intra-gastric meal distribution in critical illness[J].Intensive Care Med,2008,34:454-460.
[15]Memis D,Dokmeci D,Karamanlioglu B,et al.A comparison of the effect on gastric emptying of propofol or dexmedetomidine in critically ill patients:preliminary study[J].Eur J Anaesthesiol,2006,23:700-704.
[16]Kaygusuz K,Gokce G,Gursoy S,et al.A comparison of sedation with dexmedetomidine or propofol during shockwave lithotripsy:A randomized controlled trial[J].Anesth Analg,2008,106:114-119.

