拟南芥NAD激酶3(NADK3)参与调节镉胁迫响应
王晓阳,孙立荣,李珊珊,胡盼盼,郝福顺
(河南大学生命科学学院植物逆境生物学重点实验室,河南开封475004)
Cd是一种有毒重金属,被植物吸收后可直接或间接抑制许多生理过程如呼吸作用、光合作用、细胞生长、水分吸收、氮代谢和矿质营养等,导致植物生长量下降[1-2].Cd还可通过食物链进入人体,危害人体健康[1].过量Cd能够导致植物产生大量活性氧(reactive oxygen species,ROS),导致氧化胁迫.同时,植物中存在抗氧化酶和抗氧化剂清除过量的ROS,主要的抗氧酶有抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽还原酶(glutathione reductase,GR)[3].
NADPH作为还原力在植物生长发育和应答逆境胁迫反应中发挥重要作用.NADPH主要通过磷酸戊糖途径产生,另外,NAD(H)激酶(NADK)也能通过磷酸化NAD(H)形成NADPH.拟南芥基因组中存在3 个 NADK 基因:NADK1(At3g21070)、NADK2(At1g21640)和 NADK3(At1g78590)[4-6].NADK1 在拟南芥应答离子射线胁迫和氧化胁迫中起作用[4].NADK2主要在叶绿体合成和叶绿体保护中发挥作用[5].NADK3则为拟南芥应答氧化胁迫和ABA反应所必需[7].然而,NADK3是否参与调节Cd胁迫反应以及具体的作用机制还不清楚.本文以野生型(WT)、NADK3纯合缺失突变体nadk3和超表达NADK3的转基因植物为材料研究发现,NADK3通过调节拟南芥ROS水平和Cd的积累应答Cd胁迫反应.
1 材料与方法
1.1 试验材料
拟南芥(Arabidopsis thaliana L.)T-DNA插入突变体种子nadk3(SALK_079342)购自拟南芥生物资源中心(Arabidopsis Biological Resource Center,ABRC),突变体和WT等种子用质量分数为0.1%的HgCl2表面消毒5 min,然后用无菌水洗5遍,点种于质量分数为0.6%的琼脂MS培养基上,4℃春化2~3 d,培养室中培养2周后,移苗至培养土中培养,培养室温度为(20±2)℃,光照强度为8000~16 000 lx,光暗周期为16 h/8 h,相对湿度50%左右.
1.2 试验方法
1.2.1 NADK3表达分析及突变体表型分析 提取WT、nadk3及转基因植株的总RNA,反转录得到cDNA,进行RT-PCR反应,以Actin2为参照分析NADK3的表达,NADK3特异引物为:
Sense:5'-TTGTTTGGCAGAGTGGTTCCT-3'
Antisense:5'-CGATGTAGATAGTCCCGTGGTC-3'
将在MS培养基上生长5 d左右的WT、nadk3及2个超表达株系转移到含有CdCl2(0、50、100、150 μmol/L)的MS培养基上,幼苗在培养室竖直生长14 d后测定主根长并进行生物学统计.
1.2.2 根中H2O2水平测定 利用H2O2荧光探针2′,7′-二氯二氢荧光素(H2DCF-DA)检测根中H2O2的积累[8].将MS培养基上生长5 d的拟南芥幼苗转移到含50 μmol/L CdCl2的MS培养基上生长6 h,将幼苗在10 μmol/L的H2DCF-DA中孵育10 min,用无菌水冲洗2遍,然后用激光共聚焦显微镜(激发光波长488 nm,发射光波长525 nm)测定H2O2荧光强度.将WT未用CdCl2处理根的平均荧光强度设置为100%,其他根的荧光强度以此为对照得到相对荧光强度.试验重复3次(n=10).
1.2.3 抗氧化酶活性的测定 按Jiang和Zhang[9]的方法制备粗酶液.0.5 g样品在液氮中研磨后,加入5 mL 50 mmol/L磷酸钾缓冲液(pH 7.0),含1 mmol/L的乙二胺四乙酸,1%聚乙烯吡咯烷酮,以15 000 r/min离心15 min,上清液为粗酶液.分装,迅速用液氮速冻,-80℃超低温保存.
按Nakano和Asada[10]的方法,根据290 nm处光吸收的降低确定APX活性.3 mL反应混合液中包括含50 mmol/L的磷酸钾缓冲液(pH 7.0),0.5 mmol/L抗坏血酸,0.1 mmol/L H2O2和200 μL酶液,反应时间为2 min.
按Aebi[11]的方法,根据240 nm处H2O2的降解速率测定CAT活性.3 mL反应混合液中包括50 mmol/L磷酸钾缓冲液(pH 7.0),10 mmol/L H2O2和200 μL酶液.反应时间为3 min.
按Giannopolitis和Ries[12]的方法,根据抑制氯化硝基四氮唑蓝(NBT)光还原的相对百分率测定SOD的活性.3 mL反应混合液中包括50 mmol/L磷酸钾缓冲液(pH 7.8),13 mmol/L蛋氨酸,75 μmol/L NBT,2 μmol/L核黄素,2 mmol/L Na2EDTA和100 μL粗酶液.测定560 nm的光吸收.一个酶活力单位定义为抑制50%NBT所需的酶量.
GR活性按Schaedle和Bassham[13]的方法根据340 nm处NADPH的氧化测定酶活性测定,反应时间为3 min.3 mL反应液中含50 mmol/L的磷酸钾缓冲液(pH 7.8),2 mmol/L Na2EDTA,0.5 mol/L氧化型谷胱甘肽和200 μL粗酶液.
1.2.4 Cd2+含量测定 将在MS培养基上生长5 d的幼苗,转移到含有CdCl2的MS培养基上生长14 d,所有幼苗都用来测定Cd2+含量.用Z-2000型日立石墨炉原子吸收法测定Cd2+吸光度,然后计算出含量.取处理好的新鲜拟南芥材料,用去离子水洗3遍,然后用称量纸包好,放在70℃烘箱烘至恒重.称取15 mg材料,550℃灰化6 h,待冷却至室温后用体积分数为2%的盐酸溶解,定容至50 mL.
2 结果与分析
2.1 突变体nadk3对Cd胁迫敏感
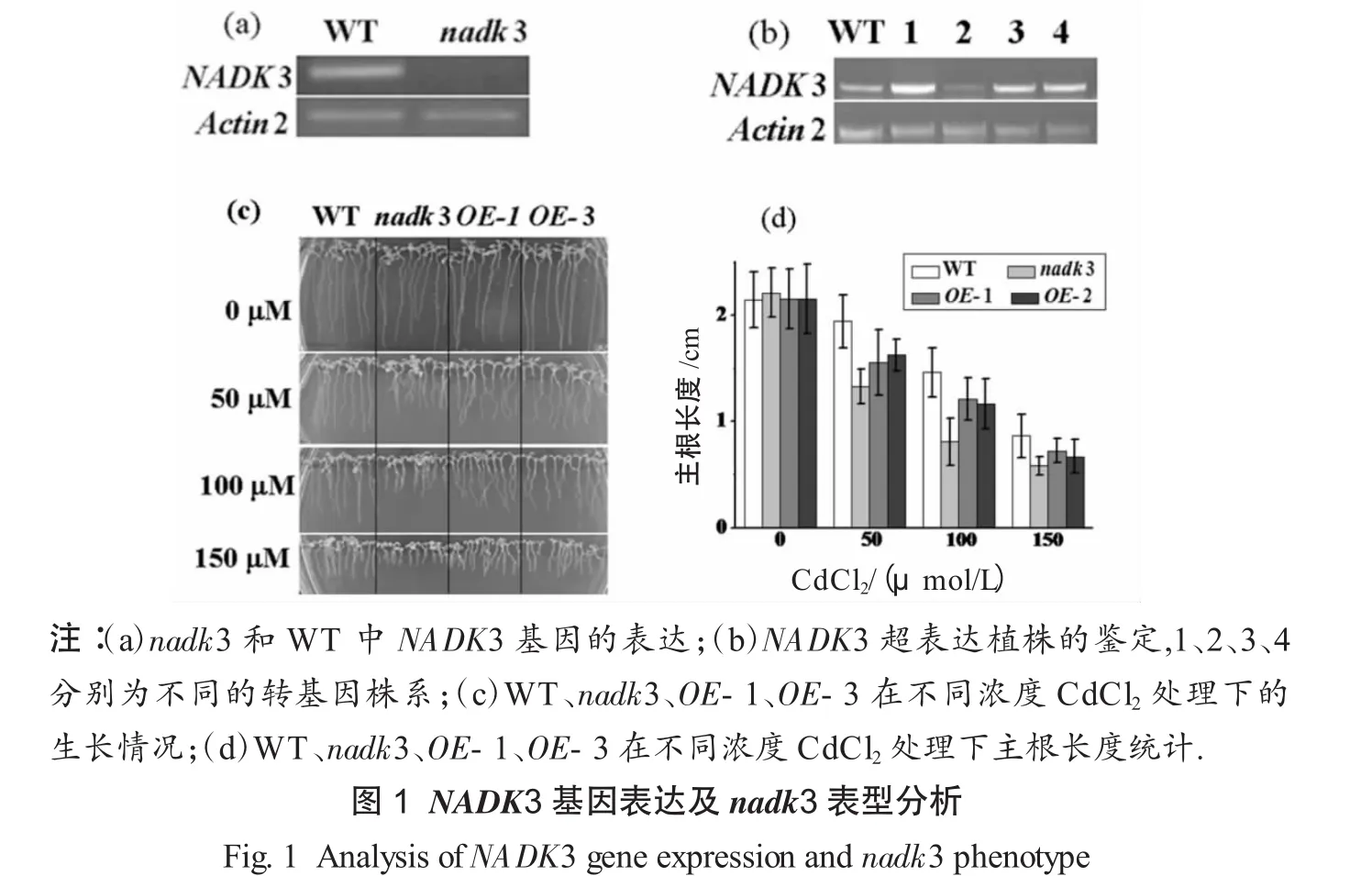
从拟南芥生物资源中心得到了T-DNA插入到NADK3外显子的突变体SALK_079342,并通过PCR鉴定获得了纯合突变体,命名为nadk3,同时构建了NADK3的超表达载体,转化拟南芥获得了4个超表达株系.RT-PCR结果显示,与WT相比,nadk3中NADK3完全被敲除(见图1(a)),4个超表达株系中有3个NADK3的表达量明显高于WT(图1(b)).因此,选表达量显著增加的2个株系OE-1和OE-3进行后续研究.如图1(c)和1(d)所示,在正常MS培养基上生长时,WT、nadk3、OE-1和OE-3表型上没有显著差异,但在添加50 mmol/L或100 mmol/L CdCl2的MS培养基上生长后,突变体主根明显比WT和超表达植物短,而且,随着CdCl2浓度的增加,Cd对突变体的抑制作用更加显著,这说明nadk3比WT和超表达植物对Cd胁迫更敏感.
2.2 Cd胁迫上调WT植株中NADK3基因的表达
用RT-PCR技术测定了Cd对WT幼苗中NADK3表达的影响,发现50 mmol/LCdCl2处理幼苗12 h、24 h后,NADK3的表达均增加,12 h增加量最大,说明Cd处理诱导了NADK3的表达结果(见图2).

2.3 Cd胁迫下nadk3中H2O2的增加量显著多于WT
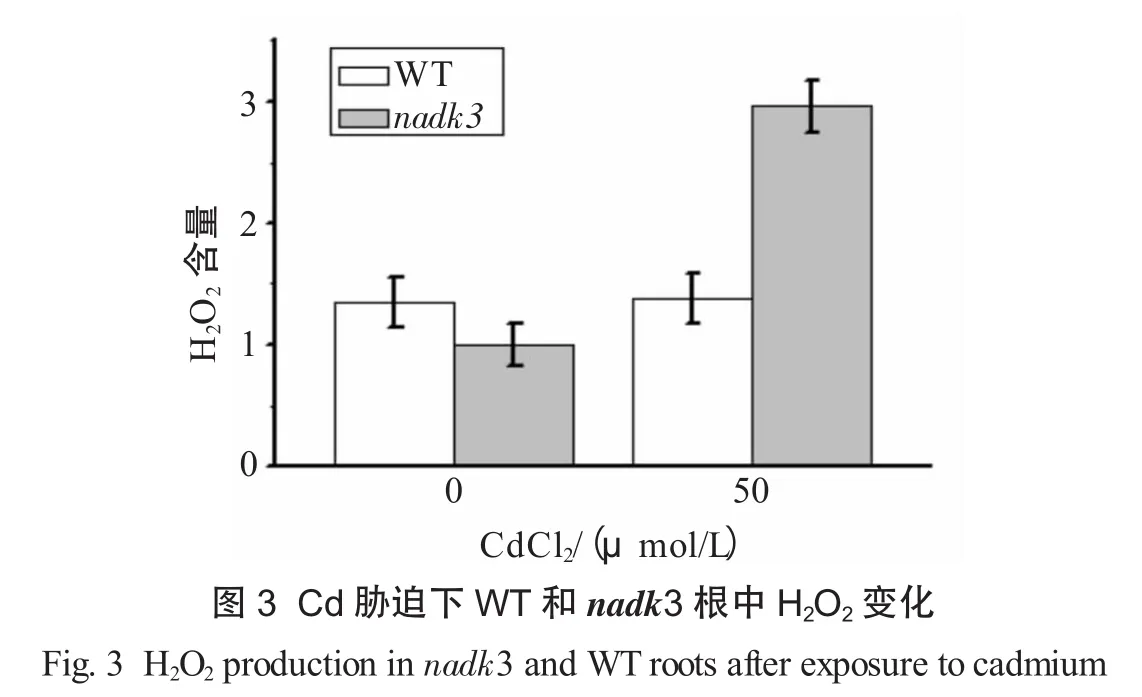
为了进一步检测H2O2在WT和突变体中的积累水平,利用H2O2荧光探针H2DCF-DA检测了Cd胁迫下WT和nadk3幼苗根中H2O2的变化.结果发现:未用CdCl2处理时,WT根中H2O2含量明显高于nadk3.Cd胁迫下,WT和nadk3根中H2O2积累均增加,而且nadk3中H2O2的水平显著高于WT,前者相对荧光强度是后者的3倍,说明NADK3的缺失导致Cd胁迫下拟南芥根中ROS增加(见图3).
2.4 镉胁迫下nadk3中抗坏血酸过氧化物酶的活性显著降低
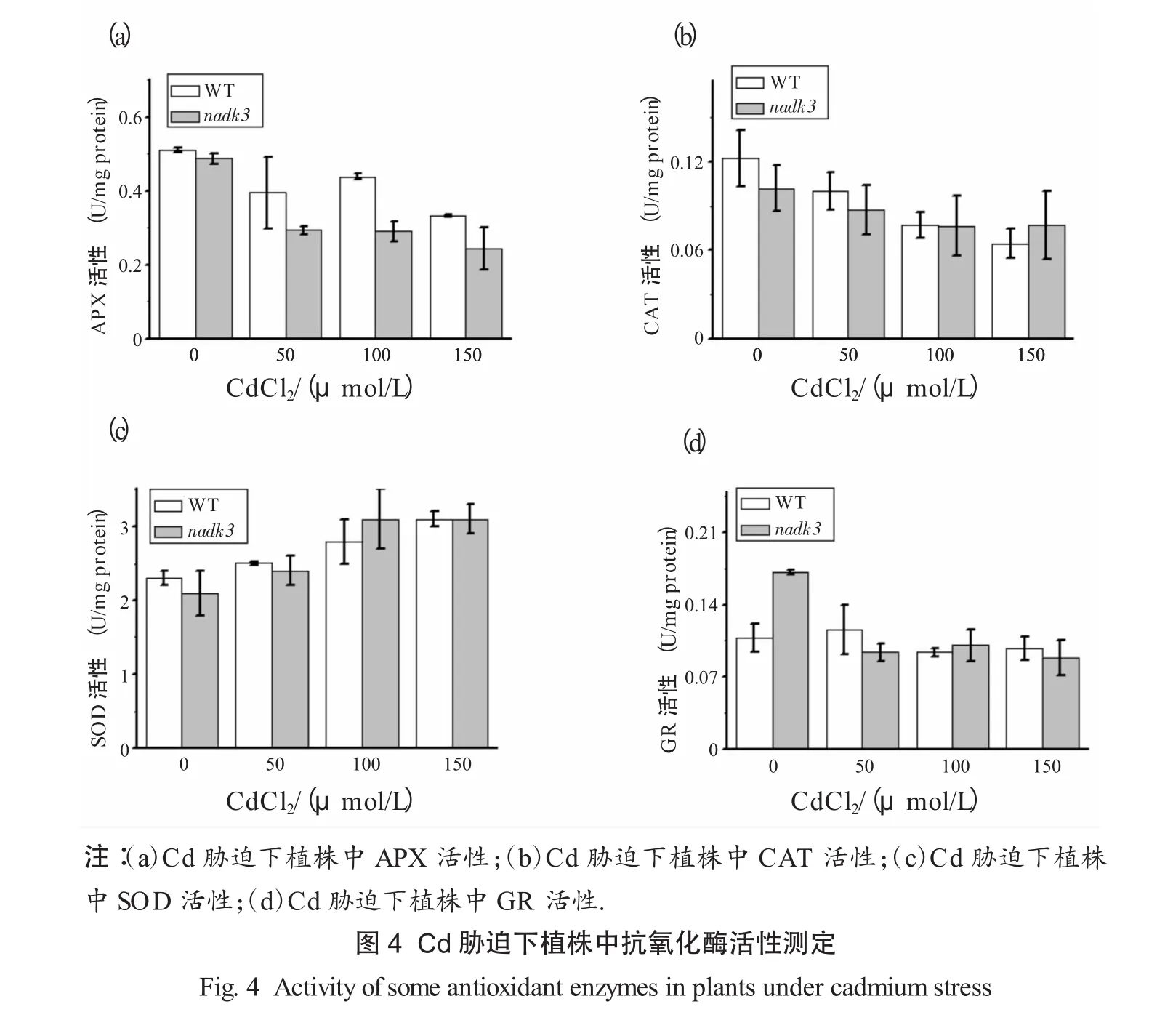
为确定NADK3是否通过影响抗氧化酶的活性应答Cd胁迫反应,检测了Cd胁迫下突变体和WT植物中APX、CAT、SOD和GR的活性.结果显示:Cd胁迫下WT和nadk3中APX和GR的活性均明显降低,突变体中这2种酶活性降低的幅度显著大于WT.用CdCl2处理后,CAT活性在WT和nadk3中都下降,SOD活性在2种植物中均增加,但CAT和SOD活性变化的幅度在2种植物中差异不显著(见图4).这些结果说明,Cd胁迫下,NADK3可能通过调节APX和GR的活性影响ROS的变化.
2.5 Cd胁迫下nadk3中Cd2+积累增加
为了研究在不同浓度Cd处理下WT和nadk3体内Cd2+的积累情况,进行了Cd2+含量的测定.结果见图5.

由图5可知,CdCl2处理后,2种植物中Cd2+的含量随处理浓度的增高而增加,且突变体的增加量明显高于WT,表明NADK3通过负调控Cd2+的积累在拟南芥应答Cd胁迫反应中起作用.
3 结论
通过分析NADK3在拟南芥应答Cd胁迫下的作用,得到了纯合突变体nadk3和NADK3转基因超表达植物,通过表型分析发现NADK3在拟南芥应答Cd胁迫反应中具有重要作用.NADK3基因表达受Cd胁迫诱导.Cd胁迫下,NADK3可能通过调控APX和GR的活性影响植物中ROS的变化.另外NADK3也通过影响Cd胁迫下拟南芥幼苗中Cd2+的积累调节Cd胁迫的应答反应.
[1]Wagner G J.Accumulation of cadmium in crop plants and its consequence to human health[J].Advances in Agronomy,1993,51:173-212.
[2]Sanitádi T L,Gabbrielli R.Response to cadmium in higher plants[J].Environmental and Experimental Botany,1999,41:105-130.
[3]Mittler R,Vanderauwera S,Gollery M,et al.Reactive oxygen gene network of plants[J].Trends in Plant Science,2004,9(10):490-498.
[4]Berrin J G,Pierrugues O,Brutesco C,et al.Stress induces the expression of AtNADK-1,a gene encoding a NAD(H)kinase in Arabidopsis thaliana[J].Molecular Genetics and Genomics,2005,273(1):10-19.
[5]Chai M F,Chen Q J,An R,et al.NADK2,an Arabidopsis chloroplastic NAD kinase,plays a vital role in both chlorophyll synthesis and chloroplast protection[J].Plant Molecular Biology,2005,59(4):553-564.
[6]Tutner W L,Waller J C,Sanedden W A.Identification molecular cloning and functional characterization of a novel NADH kinase from Arabidopsis thaliana(thale cress)[J].Biochemical Journal,2005,385(Pt1):217-223.
[7]Chai M F,Wei P C,Chen Q J,et al.NADK3,a novel cytoplasmic source of NADPH,is required under conditions of oxidative stress and modulates abscisic acid responses in Arabidopsis[J].The Plant Journal,2006,47(5):665-674.
[8]Kawano T,Pinontoan R,Uozumi N,et al.Aromatic monoamine-induced immediate oxidative burst leading to an increase in cytosolic Ca2+concentration in tobacco suspension culture[J].Plant Cell Physiol,2000,41:1251-1258.
[9]Jiang M,Zhang J.Cross talk between calcium and reactive oxygen species originated from NADPH oxidase in abscisic acidinduced antioxidant defence in leaves ofmaize seedlings[J].Plant,Cell&Environment,2003,26(6):929-939.
[10]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J].Plant and Cell Physiology,1981,22(5):867-880.
[11]Aebi H.Catalase in vitro[J].Methods Enzymol,1984,105:121-126.
[12]Giannopolitis CN,Ries S K.Superoxide Dismutases[J].Plant Physiol,1977,59:309-314.
[13]Schaedle M,Bassham J A.Chloroplast glutathione reductase[J].Plant Physiology,1977,59(5):1011-1012.

