α-倒稔子素亚微乳在大鼠体内的药动学及血浆蛋白结合率研究
单伟光,陶 蓉,宋必卫
(浙江工业大学 药学院,浙江 杭州310032)
倒稔子素是从传统药物山竹干燥果皮中分离得到的氧杂蒽酮类化合物[1],常用于腹痛腹泻、痢疾、疟疾、伤口感染及溃疡等治疗,其主要成分为α-倒稔子素.近年来的研究表明:α-倒稔子素在抗炎[2]、抗细菌真菌[3]、抗肿瘤[4]、抗氧化、抗动脉粥样硬化[5]、抗糖尿病[6]、抗纤维化[7]、抗组胺及镇痛[8]等方面均有显著作用,有望成为治疗肿瘤、心血管系统等疾病的潜在候选药物,因此该药具有十分广阔的开发前景.然而目前对α-倒稔子素的研究主要集中在体外药理活性上,而对其体内药动学及血浆蛋白结合率相关研究还未见报道.本实验采用HPLC法研究α-倒稔子素亚微乳在大鼠体内的药动学规律及血浆蛋白结合率,为α-倒稔子素的进一步开发提供实验依据.
1 仪器与材料
1.1 实验动物
雄性Wistar大鼠,体重220~250g,购自浙江省医学科学院动物实验中心,许可证号:SCXK(浙)2008-0033.
1.2 药品与试剂
α-倒稔子素(浙江工业大学天然药物课题组提供,纯度为98.5%);α-倒稔子素亚微乳(参照瑞典Kabivitrum公司生产的Intralipid亚微乳注射液的处方(国际通行的亚微乳配方)来制备α-倒稔子素亚微乳注射液,平均粒径165nm);α-倒稔子素、厚朴酚标准品(Aladdin,纯度>98%);甲醇(Merck公司);其他试剂均为分析纯.
1.3 仪 器
Agilent 1200高效液相色谱仪(美国Agilent公司);干热式氮吹仪(青岛海科仪器有限公司,DCY-24G);低温离心机(Heraeus,LDZ5-2);涡旋混匀器(上海医大仪器厂,XW-80A).
2 方 法
2.1 色谱条件的选择
色谱柱:RP zobax SB-C18(150mm×4.60mm,5μm);预柱C18(25×4.6mm);流动相:甲醇(溶剂A)和水(溶剂B)梯度洗脱:0~4min 70%A,4~8min 73%A,8~16min 85%A,16~18min 95%A,18~24min 95%A;检测波长312nm;流速1mL/min;进样量10μL.
2.2 样品处理
取0.1mL血浆加0.4mL含内标厚朴酚(2.4μg)的乙酸乙酯溶液,旋涡振荡混合1.0min,超声1.0min,5 000r/min离心,上清液氮气吹干,加甲醇0.1mL复溶,微孔滤膜过滤,取10μL进样分析.透析外液样品的处理方法同血浆样品.
2.3 色谱条件专属性考察
采用2.1的HPLC-UV色谱条件,考察空白血浆样品、空白血浆+对照品+内标、血浆实验样品的色谱行为.
2.4 标准曲线的建立
在空白血浆和平衡透析液中添加α-倒稔子素对照品,使质量浓度相当于0.10,0.30,1.00,3.00,10.00,30.00,100.00μg/mL,按照样品处理项进行处理并进样测定,记录色谱信息.所得数据用加权最小二乘法进行线性回归,以α-倒稔子素与内标的响应值比为纵轴,α-倒稔子素浓度为横轴,考察α-倒稔子素的线性范围.
2.5 最低定量限(LLOQ)
取空白血浆加α-倒稔子素对照品,精密配制成系列α-倒稔子素质量浓度的样品,按样品处理项下处理方法处理并测定,记录色谱信息,以测定信号噪音比为10∶1时为最低定量限.
2.6 回收率
取空白血浆15份,分为3组,每组5份,分别精密加入α-倒稔子素对照品配制成含α-倒稔子素质量浓度为0.31,1.25,5.00μg/mL的高、中、低3个质量浓度的样品,按样品处理项下处理样品并进行HPLC测定,记录色谱信息;另外,用流动相配制α-倒稔子素0.31,1.25,5.00μg/mL的高、中、低3个质量浓度各5份,HPLC测定,记录色谱信息,评价α-倒稔子素在培养液中的方法回收率与提取回收率.
2.7 精密度
用大鼠空白血浆配制含α-倒稔子素质量浓度为0.31,1.25,5.00μg/mL的血浆样品,分别一天内连续测定5次和连续测定5d.记录色谱信息,计算日内和日间精密度.
2.8 血浆样品的采集与处理
取Wister大鼠6只,实验前进食12h,自由饮水,以8mg/kg剂量尾静脉注射α-倒稔子素亚微乳.于给药后5,10,15,20,30,45,60,90,120,180,240及360min经断尾取血约0.3mL至肝素抗凝管中,3 500r/min离心10min,取血浆0.1mL同2.2处理,取10μL进样分析记录色谱信息,用标准曲线计算出各时点的血药浓度,DAS 2.0分析计算其药动学参数.
2.9 血浆蛋白结合率试验
将α-倒稔子素亚微乳(2mg/mL)用平衡透析液分别稀释成1,3,10μg/mL,各取50mL置于小烧杯中.精密量取肝素抗凝的空白血浆500μL至透析袋(截留分子量8 000,直径11.5mm),夹紧并悬于各烧杯中,调整透析袋位置于4℃冰箱中平衡透析72h.透析后用30%磺基水杨酸检测袋外有无蛋白质泄露,泄露则弃之重做.透析后,精密量取血浆100μL同2.2处理,取10μL进样分析记录色谱信息,用标准曲线可计算出各血药浓度,血浆蛋白结合率公式为
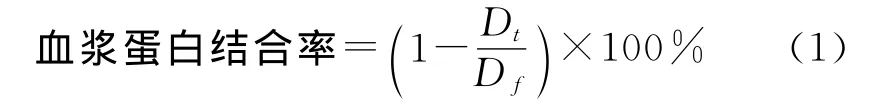
式中:Dt为袋外透析液药物的质量浓度,μg/mL;Df为袋内血浆药物的质量浓度,μg/mL.
3 结 果
3.1 色谱条件专属性
分别将空白血浆,空白血浆加对照品及血浆样品的色谱图(图1)进行对比来考察方法的专属性,结果表明,α-倒稔子素和内标的保留时间分别19.4和15.1min,其中内源性物质的保留时间为20.8min,无相互干扰,方法专属性良好.
3.2 线性范围试验
α-倒稔子素在血浆中的回归方程为Y=0.418 9X+0.099 5(R2=0.999 2);α-倒稔子素在透析外液中的回归方程为Y=0.405 4X+0.098 8(R2=0.999 3).线性范围为0.10~100.00μg/mL,定量下限为40ng/mL.
3.3 回收率与精密度实验
表1为HPLC法测定血浆内和透析外液中α-倒稔子素含量的回收率和精密度,结果表明:日内、日间精密度RSD<8%,相对回收率在98%~105%之间,绝对回收率大于71%,满足α-倒稔子素含量测定的要求.
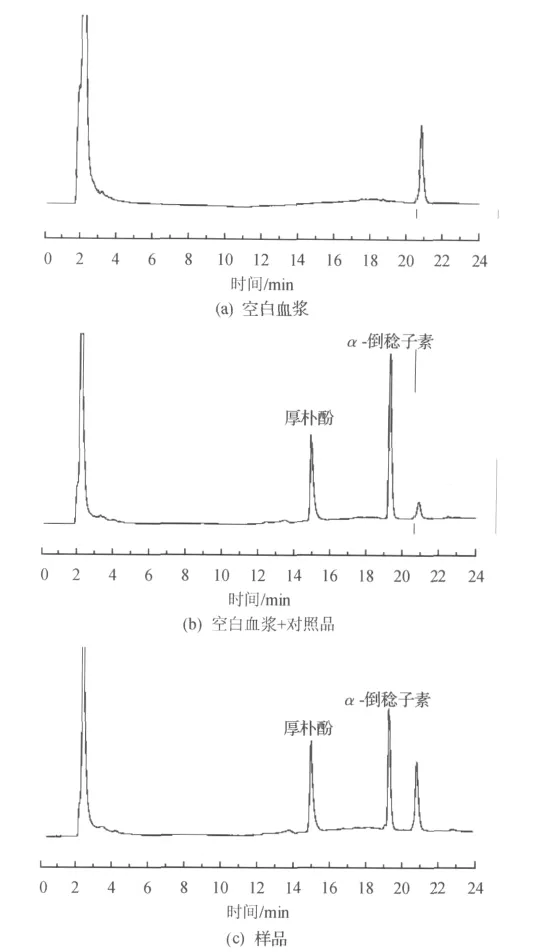
图1 α-倒稔子素在血浆中的色谱图,厚朴酚作为内标Fig.1 HPLC chromatograms ofα-mangostin with magnolol as the internal standard
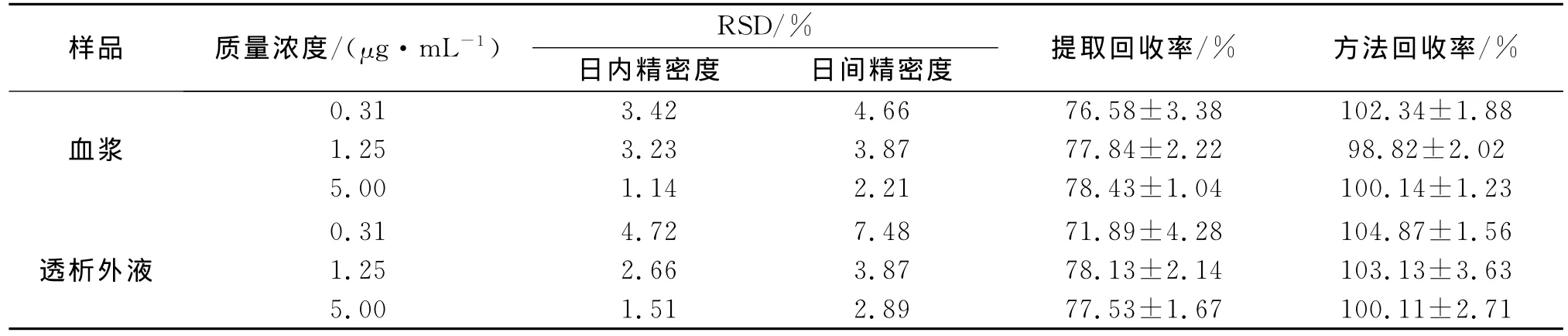
表1 HPLC法测定大鼠血浆中α-倒稔子素质量浓度的精密度及回收率结果Table 1 Precision and recovery of HPLC testing concentration ofα-mangostin in biological samples
3.4 大鼠体内α-倒稔子素血药质量浓度的测定
血浆样品测定时随行标准曲线以及质控样品,计算出未知样品的质量浓度.质控样品质量浓度不得超过理论值的15%,否则该数据不被接受.大鼠按8mg/kg尾静脉注射α-倒稔子素亚微乳后,其平均血药质量浓度—时间曲线如图2所示.采用DAS 2.0药动学分析软件进行房室拟合,根据程序自动进行推算、模拟和权重选择(以赤池信息AIC判断),α-倒稔子素亚微乳静注后的药动学参数如表2所示.结果表明:拟合的药—时曲线符合静脉推注给药二室模型(AIC值为1.31).
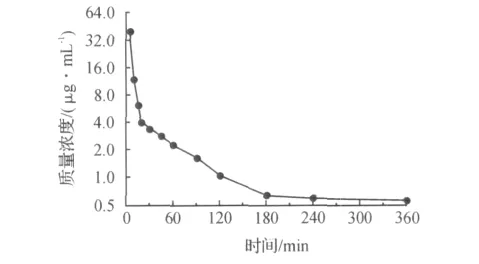
图2 大鼠静脉注射α-倒稔子素亚微乳后的平均药时曲线Fig.2 Mean concentration-time profile forα-mangostin in rat plasma
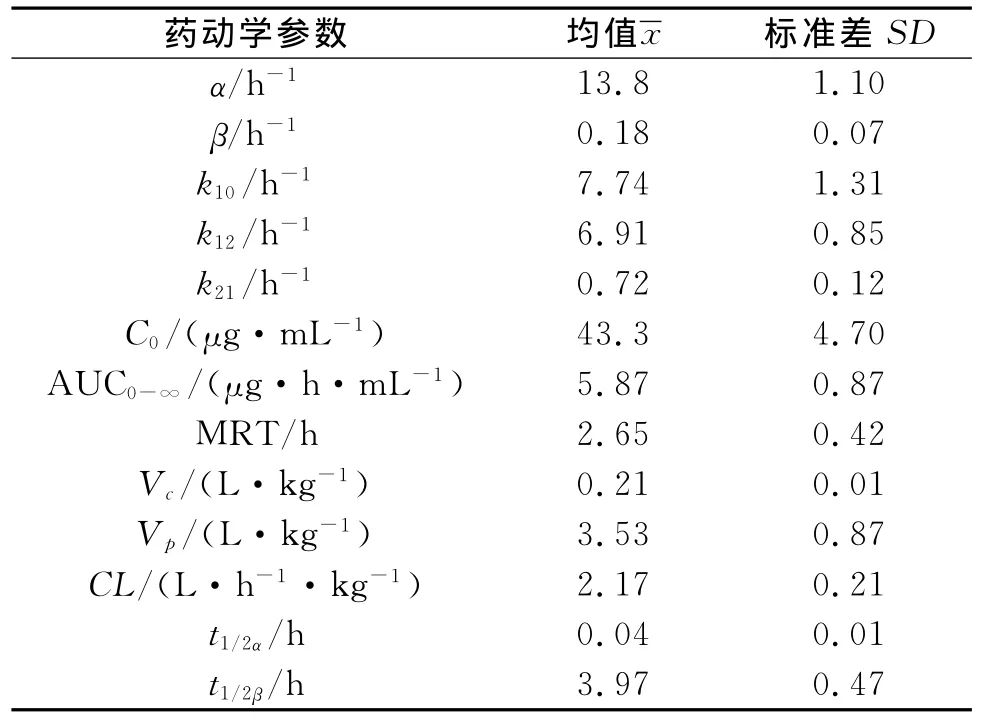
表2 α-倒稔子素亚微乳注射液在大鼠中的药动学参数1)Table 2 PK parameters ofα-mangostin injection in rat
3.5 α-倒稔子素的血浆蛋白结合率
考察低、中、高3个质量浓度(1,3,10μg/mL)α-倒稔子素的血浆蛋白结合率,每个质量浓度进行6样品分析,结果显示:上述3个质量浓度的结合率分别为(62.3±1.3)%,(60±3.3)%和(57.4±1.6)%,呈中等强度的血浆蛋白结合率,代表色谱图见图3.
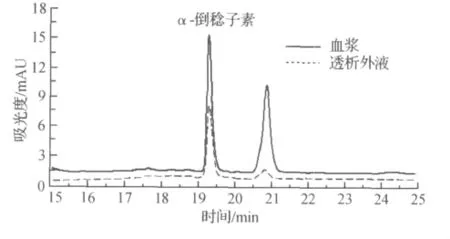
图3 α-倒稔子素在血浆及透析液中的含量比较Fig.3 The representative chromatogram ofα-mangostin in the plasma and buffer
4 结 论
建立了α-倒稔子素在血浆中HPLC分析方法,研究其在大鼠体内的药动学和血浆蛋白结合率.在该色谱条件下α-倒稔子素的峰形良好,最低检测限为40ng/mL,提取回收率达71%~78%,方法回收率大于98%,日内、日间精密度RSD<8%,在0.1~100.0μg/mL范围内线性关系良好,能够满足α-倒稔子素的含量测定要求.根据DAS 2.0药动学分析软件自动推算和权重选择,拟合的药—时曲线符合静脉推注二室模型,主要分为快速分布相和慢速消除相两个阶段,其中t1/2α<5.0min,t1/2β>3.9h,即分布半衰期较短及消除半衰期较长,结果提示α-倒稔子素在周边室具有较强的组织亲和力.α-倒稔子素血浆蛋白结合率试验结果显示其平均结合率为60%,呈中等强度结合,即静脉注射给药初期血浆中游离药物比例较高.该性质结合其高脂溶性的特点,可促进α-倒稔子素透过毛细血管向周边室扩散.
[1]OBOLSKIY D,PISCHEL I,SIRIWATANAMETANON N,et al.GarciniamangostanaL.:aphytochemical and pharmacological review[J].Phytother Res,2009,23:1047-1065.
[2]NAKATANI K,YAMAKUNI T,KONDO N,et al.Gammamangostin inhibits inhibitor-kappaB kinase activity and decreases lipopolysaccharide-induced cyclooxygenase-2gene expression in C6rat glioma cells[J].Mol Pharmacol,2004,66(3):667-674.
[3]SAKAGAMI Y,IINUMA M,PIYASENA K G,et al.Antibacterial activity of alpha-mangostin against vancomycin resistant enterococci(VRE)and synergism with antibiotics[J].Phytomedicine,2005,12(3):203-208.
[4]MATSUMOTO K,AKAO Y,OHGUCHI K,Xanthones induce cell-cycle arrest and apoptosis in human colon cancer DLD-1cells[J].Bioorg Med Chem,2005,13(21):6064-6069.
[5]BUELNA-CHONTAL M,CORREA F,HERNáNDEZRESéNDIZ S,et al.Protective effect ofα-mangostin on cardiac reperfusion damage by attenuation of oxidative stress[J].J Med Food,2011,14:1370-1374.
[6]BUMRUNGPERT A,KALPRAVIDH R W,CHUANG C C,et al.Xanthones from mangosteen inhibit inflammation in human macrophages and in human adipocytes exposed to macrophage-conditioned media[J].J Nutr,2010,140(4):842-847.
[7]CHIN Y W,SHIN E,HWANG B Y,et al.Antifibrotic constituents fromGarciniamangostana[J].Nat Prod Commun,2011,6(9):1267-1268.
[8]LU Z X,HASMEDA M,MAHABUSARAKAM W,et al.Inhibition of eukaryote protein kinases and of a cyclic nucleotide-binding phosphatase by prenylated xanthones[J].Chem Biol Interact,1998,114(1/2):121-140.
- 浙江工业大学学报的其它文章
- 214型离子交换树脂固定化假丝酵母脂肪酶的研究

