钙基复合载氧体的制备及反应性能
郗艳荣,刘永卓,郭庆杰,程 煜,田红景
(青岛科技大学化工学院,清洁化工过程山东省高校重点实验室,山东 青岛 266042)
化学链气化(chemical looping gasification,CLG)是一种新型气化技术。以金属氧化物载氧体(MeO)为例,其原理示意图见图 1。该技术将传统的燃料与空气直接接触反应借助于载氧体的作用分解为2个气-固反应,燃料与空气无需接触,由载氧体将晶格氧传递到燃料中。控制载氧体与燃料的比值可以避免过量燃料被完全氧化生成 CO2和H2O,而是得到以CO和H2为主要组分的合成气。合成气没有被N2稀释,不需要常规的分离装置,节约了能量,从而提高了系统效率。另外,由于无火焰的气-固反应温度低于常规的气化温度,因而可控制热力型NOx的生成。载氧体对化学链气化技术十分重要,其反应性、持续循环能力和耐磨损性能[1]直接影响着化学链气化系统运行的稳定性和经济性。
当前载氧体的主要制备方法[2]包括机械混合法、浸渍法、冷冻成粒法、共沉淀法及燃烧合成法。尽管机械混合法适用于大规模生产,但活性组分和惰性载体之间的混合均匀性较差,产品粒度不均一,易团聚[3]。而冷冻成粒法、共沉淀法和燃烧合成法制备工艺复杂,使生产成本极大增加,不适宜用于规模化制备。开发适于规模化生产优质载氧体的方法对于化学链气化技术的应用具有重要意义。
由于金属氧化物载氧体会造成环境污染,且成本相对较高;天然矿石载氧体活性较差。而CaSO4因其储量丰富、价格低廉、载氧能力强、无二次污染等优点,成为目前研究较多的一种非金属载氧体。研究结果表明[4-5],在适当的温度范围内,CaSO4还原-氧化过程中不会产生 CaO和 SO2。同时发现,添加活性或惰性组分可改变载氧体颗粒的表面形貌,增强传质传热,大大改善其反应性能和循环性能[6-7]。通过向CaSO4颗粒中浸渍少量金属离子,制备出复合型载氧体,可有效提高载氧体反应活性,同时又避免了大量使用金属氧化物造成的环境污染[8]。因此,复合载氧体具有很好的应用前景。
本工作利用湿式混合成粒法制备了 CaAlNi钙基复合载氧体。载氧体目标组成为CaSO4、γ-Al2O3和 NiO,故命名为 CaAlNi;CaAlNi3表示 CaSO4与 NiO质量比为 100∶3。没有添加 NiO的CaSO4/γ-Al2O3载氧体命名为 CaAl。采用 STA409 PC同步热分析仪对载氧体与煤的反应特性进行了研究,并在小型流化床中考察了载氧体的循环反应性能。
1 CaAlNi载氧体煤化学链气化热力学分析
煤的气化过程通常包括煤的干燥、热解反应、焦炭的水蒸气/CO2气化反应。文献[9]中一般认为煤的气化为固体化学链气化的控制步骤。煤气化主要包括3个反应,如式(1)~式(3)。
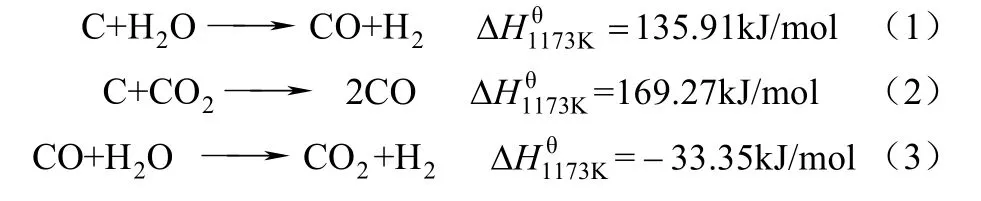
同时,流化床内载氧体颗粒和煤气化产物(CO、H2、CH4等)以及焦炭颗粒进行还原反应。CaAlNi10载氧体的活性组分 CaSO4与 NiO的摩尔比为 1∶0.18,因此 CaAlNi10载氧体的化学式用 CaSO4·Ni0.18O0.18表示。郭庆杰等[10]研究了CaSO4的复合载氧体同煤焦颗粒的化学链反应特性,通过分析固体产物成分得出浸渍Ni离子的CaSO4载氧体同固体燃料煤焦颗粒反应后,Ni以Ni3S2形式出现。因此,本文认为 NiO的还原态为 Ni3S2。主要反应如式(4)~式(7)。

根据标准Gibbs自由能的变换,反应平衡常数Kp与温度T的关系[11]如式(11)。

煤化学链气化反应中各物质的热力学参数均来自《实用无机物热力学数据手册》[12],根据式(1)可得到反应式(4)~式(10)化学平衡常数的对数lgKp随温度的变化曲线(图 2)。通常平衡常数Kp越大,反应活性越高。由图2可见,900 ℃时,式(9)的反应平衡常数的对数为 51.654,远大于式(10)的35.201,其反应活性更高。因此载氧体再生过程以式(8)和式(9)为主要反应。
2 实验部分
2.1 载氧体制备
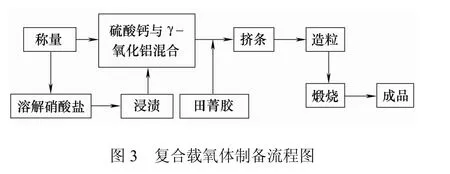
以工业级 Ni(NO3)3·6H2O、γ-Al2O3、CaSO4·5H2O(纯度>98%)为原料,以田菁胶为黏合剂。按CaSO4与NiO质量比为10∶0.3、10∶0.65和10∶1.0配比,分别称取一定质量硝酸盐加水得到饱和溶液,浸渍到硫酸钙和氧化铝的混合物中,以实现金属氧化物的均匀负载。加入适量田菁胶,搅拌混合均匀,得到一定湿度和黏度的固体混合物。经挤条、造粒,得到规则均匀的成型复合载氧体颗粒。自然干燥后转入马弗炉于900 ℃下煅烧3 h,使载氧体各组分晶型稳定。将所得颗粒筛分,密封保存以备使用。具体制备流程如图3。

2.2 实验装置及流程
2.2.1 热重实验
采用德国Netzsch STA 409 PC 综合热分析仪研究载氧体与煤的化学反应性。升温速率为 15 K/min,900 ℃后恒温30 min,整个反应在N2气氛下完成,N2流量为20 mL/min。实验采用神木煤为燃料,基于煤中固定碳与载氧体中活性氧完全反应生成 CO,计算确定载氧体与煤的质量比。神木煤的工业分析及元素分析见表1。

表1 神木煤的工业分析及元素分析
2.2.2 流化床实验
流化床实验装置如图4所示,化学链气化系统由高温流化床、温度控制器、供气系统(蒸汽发生器、气瓶、气体流量计)、气体分析系统和数据采集系统组成。流化床高650 mm,内径50 mm,分布板开孔率为 1%。基于煤中固定碳与载氧体中晶格氧完全反应生成 CO,计算确定载氧体与煤的质量比。分别称取一定质量煤和载氧体并混合均匀,由流化床顶部进料口送入流化床。氩气以 0.7 L/min的流量吹扫 30 min以排净空气。调整氩气流量为0.4 L/min,同时开启加热装置,当床内温度升至900℃时通入水蒸气,恒温还原反应 120 min。同时,利用气体样品袋在取样口处收集不同时间段气体产物,并用Clarus 500型气相色谱分析仪测量气体产物中各组分体积分数。反应结束后流化床仍保持900 ℃恒温,切换气氛为流量达0.5 L/min的空气进行氧化反应,氧化时间为 45 min。还原 -氧化反应循环10次。实验结束后停止加热,冷却至室温后收集固体产物并密封保存。

2.2.3 样品表征
固体物质的晶相组成采用 Rigaku D/max-2500/PC型X射线衍射仪来鉴定。载氧体微观形貌采用JEOL JSM-6700F型电镜扫描仪观察测试。载氧体颗粒粒度分布采用 Rise-2002型激光粒度分析仪测得。
2.3 数据处理方法
(1)气体产物干基浓度Pi,计算方法见式(12)。

式中,Pi,CUM为i=H2,CO,CH4,CO2的累积体积量。
(2)合成气含量Syn,定义为在一定时间内气化生成的有效气(CO,H2,CH4)占气体总量的分数,如式(13)。

式中,mH2、mCO、mCH4、mCO2分别为流化床反应器出口气体产物CO2、CO、CH4的累积量。
(3)碳转化效率XC

式中,mC为煤中碳的物质的量;mCO2(t)、mCO(t)、mCH4(t)分别为流化床反应器出口气体CO2、CO、CH4单位时间内的平均物质的量。
(4)冷煤气效率η,表示气化生成煤气的化学能与气化用煤的化学能之比。

式中,Qj为气体的低位热值;Qnet为煤的低位热值。
3 结果与讨论
3.1 复合载氧体反应特性
复合载氧体与煤还原反应的热重分析曲线如图5所示。曲线5显示了温度的变化过程;曲线1~4则分别显示了载氧体与煤发生反应导致的质量变化过程。
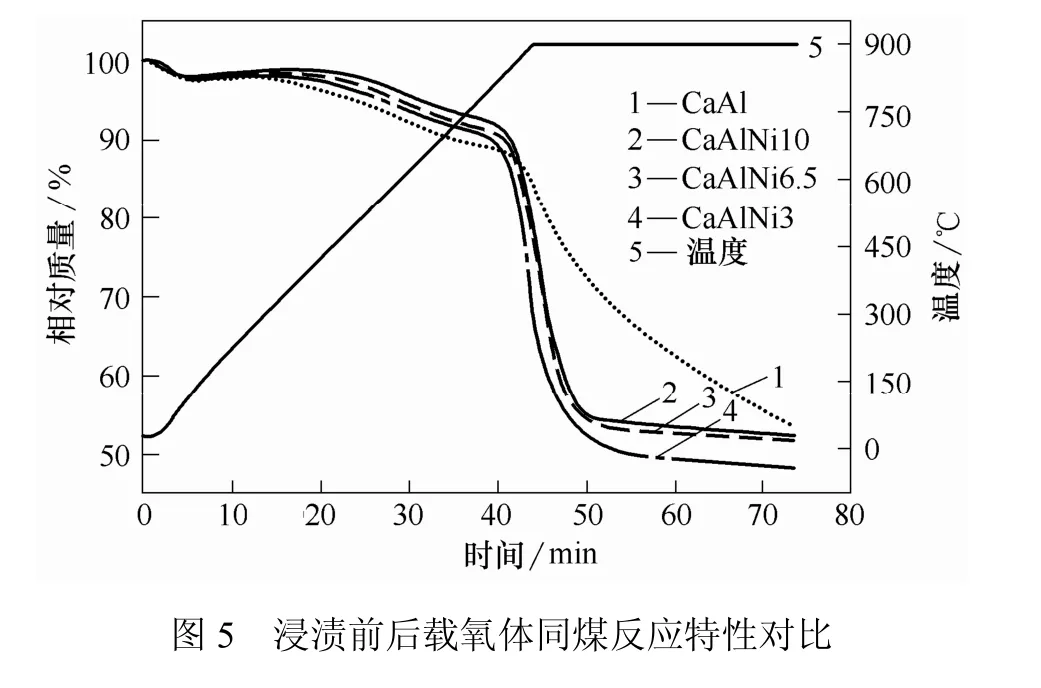
从曲线1可以看出,CaAl载氧体与煤的混合物在850 ℃左右质量急剧下降,说明此时CaAl载氧体与煤的还原反应快速进行,32 min后仍在持续。而曲线2~4在800 ℃即开始快速下降。由曲线2、3可知,CaAlNi6.5和CaAlNi10与煤反应时间较短,11 min内反应基本完成。曲线4表明,CaAlNi3与煤反应时间稍长,约14 min。对比曲线1与曲线2~4可知,浸渍Ni离子能够明显降低载氧体与煤反应的起始温度,加快反应速率,缩短反应时间。这是由于金属离子负载于CaSO4载氧体表面,构成一个个活性反应中心。这些活性中心可以降低固-固反应活化能,加快反应速率,改善载氧体的反应性能[13]。同时,图5表明,随着Ni离子浸渍量的增大载氧体与煤反应速率变化不明显,但反应时间略有缩短。因此,选取反应性较好的 CaAlNi10载氧体与煤在高温流化床中进行多次还原-氧化循环实验。
3.2 复合载氧体多次循环反应特性
3.2.1 气体产物随时间的变化

在反应器中载氧体与化学链气化的主要目标产物(H2、CO和CH4)发生反应式(4)~式(6),产生H2O和CO2。化学链气化气态产物干基体积流率随时间变化如图6所示,图6(a)和图6(b)分别为还原过程和氧化过程的气态产物干基体积流率,右上角为各气体累积干基浓度。由图 6(a)可以看出,H2的生成量占总气体产物(干基)的61.68%,CO、CH4与 CO2分别占气体产物的 6.08%、0.97%以及31.27%。CH4作为挥发分的主要成分,其体积流率接近零。这是由于煤在流化床升温前进料,大部分挥发分在升温过程中逸出。图6(a)中CO和CO2体积流率在第11 min达到最大值,H2体积流率的峰值出现在23 min。H2和CO的体积流率在反应初始阶段迅速增加,表明煤气化反应式(1)~式(3)及载氧体与焦炭的还原反应式(7)快速发生。随着反应物的不断消耗,式(1)~式(3)及式(7)反应速率逐渐减小至反应停止;同时,载氧体与各气体的还原反应式(4)~式(6)持续进行。因此,H2和CO的体积流率在23~120 min迅速降低至接近零。
如图6(b)所示,载氧体再生过程气体产物的主要成分是CO2,占总气体产物(干基)的99.05%;SO2仅有0.95%,极少量的SO2可能来自两个部分:煤焦燃烧反应和Ni3S2氧化反应式(10)。CO2体积流率在5 min内迅速升高至0.031 L/min。
3.2.2 固体产物随循环次数的变化

不同循环次数的固体产物 XRD分析谱图见图7。由图7可知,新鲜载氧体的主要成分是CaSO4,Al2O3和 NiO,没有其它杂质。说明制备流程及煅烧升温程序合理,硝酸盐全部分解成为目标氧化物。900 ℃时,CaAlNi10载氧体与煤1次、5次和 10次还原反应的直接产物是CaS、CaO和Ni3S2,验证了载氧体还原反应式(4)~式(7)。待切换为氧化气氛后,载氧体氧化反应式(8)~式(10)发生。从图 7中可以看出,载氧体再生产物主要组分是CaSO4、NiO和Al2O3,没有发现CaO的对应峰。因此,载氧体氧化反应的主要反应式为式(8)、式(9),Ni3S2与O2反应放出SO2的反应式(10)反应程度较低或不反应,与热力学分析结果相一致。由此可以判断,氧体再生过程产生的极少量的SO2来自煤焦燃烧反应;NiO在化学链气化过程中对S的释放有一定控制作用。在氧化阶段,CaO重新夺回被Ni3S2占有的S,提高了载氧体的再生率。
图8是不同循环次数CaAlNi10载氧体的SEM照片。由图8(a)可以看出,新鲜载氧体中CaSO4晶体呈棒状,表面较光滑,紧密地堆积在一起,孔隙率较小,孔结构不发达,而NiO晶体呈微小颗粒状,均匀的负载于CaSO4晶体表面。这些NiO颗粒在载氧体表面形成了一个个反应活性中心,使载氧体与煤的反应活性增强。对比图8(a)、(b)、(d)及(f)可以看出,随着还原反应的进行,新鲜载氧体的CaSO4晶体棒状结构逐渐破碎成为不规则块状;由图8(a)、(c)、(e)及(g)的对比可知,随着循环次数的增加NiO颗粒逐渐与CaSO4晶体相融合,由CaSO4晶体表面逐渐深入到内部,负载于CaSO4晶体表面的NiO颗粒逐渐减少。这是由于,载氧体再生阶段 Ni3S2主要发生反应式(9),Ni3S2和CaO氧化生成NiO和CaSO4。载氧体表面的反应活性中心逐渐深入到载氧体内部,导致载氧体反应活性随着循环次数的增加略有下降,但影响不大。

3.2.3 气体产物随循环次数的变化

气态产物的干基浓度随循环次数的变化如图 9所示。从图9中可以看出,第一次还原反应H2、CO、CH4、CO2的干基浓度分别为61.68%、6.08%、0.97%和31.27%。在10次循环中H2和CO干基浓度略微增大,第 10次循环时干基浓度分别为 66.04%、8.84%;相反,CO2干基浓度随循环次数的增加逐渐减小,第10次循环反应时降至24.03%;CH4干基浓度变化不明显。这是因为,载氧体反应活性随着循环次数的增加略有下降,载氧体化学链气化反应式(4)~式(7)则随着循环次数增加逐渐减弱。各气体产物干基浓度变化幅度很小,整体较稳定,CaAlNi10载氧体在流化床中表现出了良好的持续循环反应能力。
图10为冷煤气效率、碳转化率、有效合成气浓度随循环次数的变化。由图10可知,碳转化率随循环次数的增加逐渐降低,由第一次循环的76.75%下降到第10次的70.16%。表明载氧体的反应活性随循环次数的增加而逐渐降低。相反,合成气含量随循环次数的增加而增加,这是由于载氧体活性下降,化学链气化反应式(4)~式(7)减弱,H2和CO干基浓度略微增大。冷煤气效率随循环次数增加而降低,表明随着循环次数的增加,煤气化效率略有降低。
综上,载氧体反应活性和煤气化效率随循环反应的进行而降低,但10次循环中各评价指标变化幅度较小。载氧体在流化床中表现出了良好的持续循环反应能力,适用于煤化学链气化。

4 结 论
(1)建立了一种载氧体颗粒制备方法-湿式混合成粒法。该方法制备过程简单,混合均匀性好,成粒均匀,处理量大,适于载氧体的大规模制备。
(2)浸渍金属离子后钙基复合载氧体同煤的反应起始温度由850 ℃下降到800 ℃,反应速率明显加快,反应时间由35 min缩短至11 min。复合载氧体中添加的NiO对S的释放有一定的控制作用,提高了载氧体的再生率。
(3)经过10次还原-氧化循环反应后,载氧体颗粒表面活性反应中心减少,由CaSO4晶体表面逐渐深入到内部。载氧体反应活性略有下降,但仍较稳定。综合考虑反应性、持续循环能力及经济性,认为文中制备的CaAlNi载氧体适宜用于煤气化。
[1]周树理.非混合燃烧中CaSO4氧载体的研究[D].北京:中科院工程热物理研究所,2007.
[2]郑瑛,王保文,宋侃,等.化学链燃烧技术中新型氧载体 CaSO4的特性研究[J].工程热物理学报,2006,27:531-533.
[3]王京,杨士建,顾翀,等.过渡金属元素掺杂硫酸钙氧载体的还原性能[J].高校化学工程学报,2012,26(4):606-611.
[4]Tian H,Guo Q,Yue X,et al.Investigation into sulfur release in reductive decomposition of calcium sulfate oxygen carrier by hydrogen and carbon monoxide[J].Fuel Processing Technology,2010,91:1640-1649.
[5]Tian H,Guo Q.Investigation into the behavior of reductive decomposition of calcium sulfate by carbon monoxide in chemical-looping combustion[J].Industrial & Engineering Chemistry Research,2009,48:5624–5632.
[6]Scott S A,Dennis J S,Hayhurst A N,et a1.In situ gasification of a solid fuel and CO2separation using chemical looping[J].AIChE Journal,2006,52(9):3325-3328.
[7]丁宁,郑瑛,罗聪,等.钙基复合载氧体反应性能的研究[J].动力工程学报,2010,30(9):689-698.
[8]肖海平,周俊虎,曹欣玉,等.CaSO4在不同气氛下分解特性的实验研究[J].动力工程,2004,24(6):889-892.
[9]Song Q L,Xiao R,Deng Z Y,et a1.Chemical-looping combustion of methane with CaSO4oxygen carrier in a fixed bed reactor[J].Energy Conversion and Management,2008,49(111):3178-3187.
[10]Guo Qingjie,Zhang Jianshe,Tian Hongjing.Recent advances on CaSO4oxygen carrier for chemical-looping combustion (CLC)process[J].Chemical Engineering Communications,2012,199(11):1463-1491.
[11]Zheng M,Shen L,Xiao J.Reduction of CaSO4oxygen carrier with coal in chemical-looping combustion:Effects of temperature and gasification intermediate[J].International Journal of Greenhouse Gas Control,2010,4(5):716-728.
[12]叶大伦,胡建华.实用无机物热力学数据手册[M].第2版.北京:机械工业出版社,2002.
[13]Song Q L,Xiao R,Deng Z Y,et al.Effect of temperature on reduction of CaSO4oxygen carrier in chemical-looping combustion of simulated coal gas in a fluidized bed reactor[J].Industrial &Engineering Chemistry Research,2008,47(21):8148-8159.

