2型糖尿病并抑郁患者的认知功能障碍
万鸿平 邓小容
湖北中山医院神经一内科 武汉 430000
随着生活水平的提高,2型糖尿病(Type2diabete mellitus,T2DM)的患病人数正在逐年增加。糖尿病常并发肾功能不全、周围神经损害等多种并发症,对认知功能的损害已日益受到重视,许多资料显示,糖尿病患者中60%~70%存在轻中度认知功能障碍,研究证实糖尿病患者并发抑郁症的患病率高于正常人[1-2]。为探讨糖尿病与认知功能障碍、抑郁间的相关性,我们对比分析糖尿病并抑郁患者和糖尿病非抑郁患者的认知功能障碍,现报告如下。
1 资料与方法
1.1研究对象200例均为我院神经科门诊或住院的糖尿病患者,男104例,女96例;年龄38~76岁,平均(58.5±7.8)岁;病程6个月~12a,平均(6.4±3.7)a;受教育年限5~12a,平均(8.4±4.6)a。纳入标准:诊断符合1999世界卫生组织糖尿病的诊断标准:空腹血糖≥7.0mmol/L,或有高血糖症状及随机血糖≥11.1mmol/L,或OGTT 2h血糖≥11.1mmol/L。排除标准:(1)糖尿病酮症酸中毒、原发性高血压、脑血管病、缺血性心脏病及低血糖昏迷等;(2)精神发育迟滞、痴呆、脑外伤、癫、帕金森病、甲状腺功能减退、精神病及可能影响认知功能的疾病;(3)酒精依赖及其他精神活性物质滥用者;(4)服用影响认知功能的药物(如镇静催眠药、抗精神病药、糖皮质激素等)。对所有入选患者进行抑郁和认知功能测定,根据抑郁测定结果分为糖尿病并抑郁组与糖尿病非抑郁组。
2 认知功能和抑郁的检测
2.1抑郁检测汉密尔顿抑郁量表(HAMD):采用17项版本的 Hamilton抑郁量表 (HAMD)[3]测查,HAMD总分<8分为无抑郁,≥8分为轻度抑郁,≥17分为中度抑郁,≥24分为重度抑郁。
2.2认知功能检测(1)简易精神状态量表(mini-mental state examination MMSE):包括定向力、注意计算、语言理解、即刻记忆、短程记忆、物体命名、言语复述、阅读理解、语言表达及图形描画共11项,总分0~30分。正常与不正常的分界值与受教育程度有关:文盲(未受教育)组17分,小学(受教育年限≤6a)组20分,中学或以上(受教育年限>6a)组24分。分界值以下为有认知功能缺陷,以上为正常。(2)词语流畅性测验(verbal fluency test,VFT):要求受试者在1 min内说出尽可能多的动物数,记录总数,该测试反映患者从记忆库中调用某类事物的能力,测验瞬间语言记忆、自发的语言运动能力、思维组织能力及干扰抑制能力。(3)伦敦塔测验(the tower of London test,TOL):主要反映额叶计划性功能,要求受试者必须计划好每一步的移动。
2.3统计学处理运用SPSS 12.0统计软件对研究结果进行统计分析。计量资料采用s表示,计数资料用率表示,组间比较t检验。P<0.05为差异有统计学意义。
3 结果
3.1抑郁测定结果抑郁组88例:轻度68例,中度12例,重度8例;非抑郁组112例。抑郁组 HAMD评分16.8±0.6,非抑郁组7.2±2.8,2组比较差异有统计学意义(P<0.05)。
3.2 2组认知功能比较见表1。
表1 2组认知功能评分比较 (s,分)
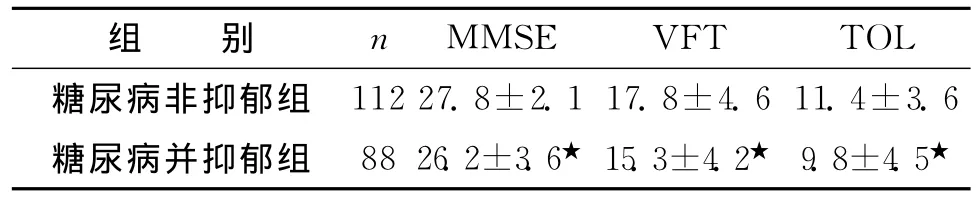
表1 2组认知功能评分比较 (s,分)
注:非抑郁组与抑郁组比较,★P<0.05
MMSE VFT TOL糖尿病非抑郁组组 别 n 112 27.8±2.1 17.8±4.6 11.4±3.6糖尿病并抑郁组 88 26.2±3.6★ 15.3±4.2★ 9.8±4.5★
3.3糖尿病不同程度抑郁组患者的认知功能比较见表2。
表2 糖尿病不同程度抑郁组认知功能比较 (s)
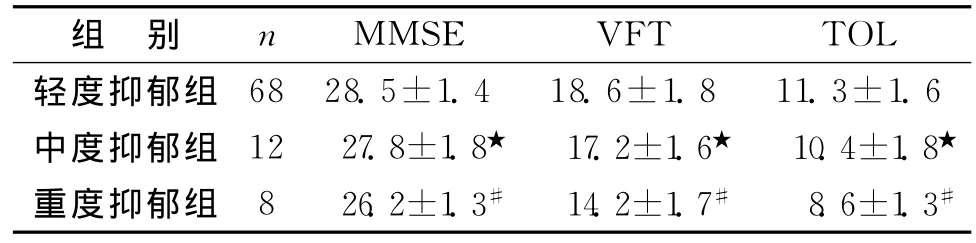
表2 糖尿病不同程度抑郁组认知功能比较 (s)
注:轻度、中度抑郁组比较,★P<0.05;中度、重度抑郁组比较,#P<0.05
MMSE VFT TOL轻度抑郁组组 别 n 68 28.5±1.4 18.6±1.8 11.3±1.6中度抑郁组 12 27.8±1.8★ 17.2±1.6★ 10.4±1.8★重度抑郁组 8 26.2±1.3# 14.2±1.7# 8.6±1.3#
4 讨论
糖尿病作为常见病、多发病,患病率明显上升,随着研究的深入,我们已经认识到糖尿病是一种与心理因素密切相关的身心疾病[4]。Anderson等[5]研究表明,糖尿病患者中抑郁症的患病率是非糖尿病患者的2倍,其中女性患病率高于男性,通过自评量表的调查方法得到的糖尿病患者中抑郁症患病率为32.9%。
抑郁症是一种常见的以情绪低落为主要特征的精神状态,常伴有心境低落、兴趣和愉快感丧失、无用感、自杀观念、精神运动迟缓及各种躯体症状。该症受多种遗传基因调控,同时与多种外在因素有关[6]。糖尿病导致抑郁的机制尚未完全阐明,目前认为主要为下丘脑-垂体-肾上腺轴(HPA)负反馈功能障碍。Lustman等[7]认为,高血糖本身可作为应激源,激活HAP轴,使机体产生一系列应激反应。Sapolsky等[8]研究显示,HAP轴激活后,肾上腺皮质可合成和释放糖皮质激素。人脑海马内有大量的糖皮质激素受体,皮质醇的增高可损伤海马、蓝斑等而导致神经元丢失,进而使海马发生器质性病变,损害海马对HPA轴的负反馈调节机制,使海马长期暴露在高水平的皮质醇下而出现抑郁症状。
既往研究表明,糖尿病患者存在学习及记忆、注意及执行等功能下降,且病程越长认知损害领域越多且严重[9-10]。Munshi等[11]发现糖尿病控制不良患者画钟测验成绩明显下降,反映其认知功能及执行功能下降;Saezynski等[12]报道糖尿病患者加工速度减慢;VanHarten等[13]报道糖尿病患者各项认知功能均明显下降;Mansehot等[14]认为糖尿病患者除执行功能、加工速度外,还存在记忆功能减退。另有研究表明,抑郁症患者存在明显的认知功能障碍[15-16],抑郁症患者额叶功能下降,明显影响注意力。Hammar等[17]研究发现,抑郁症患者识别简单目标时的表现和正常人无区别,但需要执行复杂注意搜寻时,其选择性注意反应时间比对照组延长。
本研究中所采用的简易精神状态量表、词语流畅性测验和伦敦塔测验为神经心理检测常用工具,反映糖尿病并抑郁患者不仅存在对事物的理解能力、短时记忆和即刻记忆、定向力、语言理解和表达等方面的认知功能障碍,还存在视空间、计划性功能等执行功能下降,因此糖尿病并抑郁患者存在广泛、全面的认知功能障碍。
因此,我们认为,糖尿病患者合并抑郁较非抑郁糖尿病患者认知功能下降更为明显,将来发展为痴呆的可能性更大,抑郁可能是导致认知功能下降的重要因素。抑郁对糖尿病患者认知功能的影响机制有待进一步深入的研究,对于糖尿病患者,我们不仅要注意控制血糖,也要控制肾功能损害、神经系统损害等并发症,还要重视抑郁及认知功能障碍,更要重视抑郁可能会加重认知功能损害,对此应引起足够的重视,并给予必要的治疗,避免病情加重。
[1]Golden SH,Lazo M,CarnethonM,et al.Examining abidirectional association between depressive symptoms and diabetes[J].JAMA,2008,299(23):2 751-2 759.
[2]Knol MJ,Twisk JW,Beekman AT,et al.Depression as a risk factor for the onset of type 2diabetes mellitus.A meta-analysis[J].Diabetologia,2006,49:837-845.
[3]张明园 .精神科评定量表手册[M].2版 .长沙:湖南科学技术出版社,1998:121-126.
[4]Moreira RO,Papelbaum M,Fontenelle LF,et al.Comorbidity of psychiatric disorders and symmetric distal polyneuropathy among type 2diabetic ourpatients[J].Braz J Med Biol Res,2007,40(2):269-275.
[5]Anderson RJ,Clouse RE,Freedland KE,et al.The prevalencc of comobid depression in adults with diabetes[J].Diabetes Care,200l,24(6):1 069-1 078.
[6]Mendelson SI.Metabolic syndrome and psychiatric illness[M].San Diego:Elsevier lnc,2008:49-51.
[7]Lustman PJ,Clouse SR.Depression in diabetes patients:the relationship between mood and glycemic control[J].J Dabetes Comlications,2005,19(2):113-122.
[8]Sapolsky RM.The possibility of neurotoxicity in the hippocampus in majory depression:aprimer on neuro death[J].Biolpsychiatry,2000,48(8)755-765.
[9]van Harten B,de Leeuw FE,Weinstein HC,et al.Brain imaging in patients with diabetes:a systematic review[J].Diabetes Care,2006,29:2 539-2 548.
[10]Logroscino G,Kang JH,Grodstein F.Prospective study of type 2diabetes and cognitive decline inwomen aged 70-81 years[J].BMJ,2004,328:548.
[11]Munshi M,Grande L,Hayes M,et al.Cognitive dysfunctionis associated with poor diabetes control in older adults[J].Diabetes Care,2006,29:1 794-1 799.
[12]Saczynski JS,Jonsdottir MK,Gareia ME,et al.Cognitive impairment:An increasingly important complication of type 2diabetes:The Age,Gene/Environment Susceptibility-Reykjavik Study[J].Am J Epidemiol,2008,168:1 132-1 139.
[13]Van Harten B,Oosterman J,Muslimovic D,et al.Cognitive impairment and MRI correlates in the elderly patients with type 2diabetes mellitus[J].Age and Ageing,2007,36:164-170.
[14]Manschot SM,Brands AMA,van der Grond J,et al.Brain magnetic resonance imaging correlates of impaired cognition in patients with type 2diabetes[J].Diabetes,2006,55:1 106-1 113.
[15]Ravnkide B,Videboch P,Clemmensen K,et al.Cog-nitivedeflcits in major depression[J].Seand J Psychol,2002,43(4):239-251.
[16]Porter RJ,Gallagher P,Thompson JM,et al.Neurocognitive impairment in drug-free patients with major depressive disorder[J].Br J Psychiat,2003,182(3):214-220.
[17]Harmer CJ,Bhagwagar Z,Cowen PJ,et al.Acute administration of citalopram facilitates memory consolidation in healthy volunteers[J].Psychopharmacology (Berl),2002,163:106-109 . (收稿2012-11-21)

