海水反硝化细菌的筛选及其对氨氮、亚硝态氮的降解性能
刘 芳
(西北农林科技大学,陕西杨凌,712100)
随着高密度工业化水产养殖业的发展,饵料残体、养殖动物的大量粪便和分泌物的积累,使养殖水体中的-N和-N等含氮污染物浓度日益增加,导致养殖动物易于患病甚至死亡,降低了养殖动物的总产和单产、增加了养殖成本,这已成为限制水产养殖业可持续发展的重要原因之一[1]。在养殖过程中,为了要保证水温和各种条件的稳定,也为了降低成本,不希望频繁大量换水。所以,在这样一个相对密闭的水环境中,如何高效及时的去除各种含氮污染物,特别是去除对养殖动物有强烈毒性的-N和-N[2],是当前急需要解决的关键问题之一。
目前关于淡水中各种氮的去除已有大量文献报道,也取得较大进展,而海水生物脱氮研究伴随着海水养殖产业化的快速发展业已成为一个重要课题,在减轻及消除海水氮素污染方面拥有广阔前景[3]。为了能够更加有效地通过微生物去除水中的-N和-N,应该深入研究微生物在高密度和工业化水产养殖业中的应用,从而实现可持续发展的目的[4]。本实验通过研究不同培养基分别接种的不同来源的菌种,从而筛选出对-N和-N具有较强的降解能力的菌种。并考察温度、pH值、C/N对其降解氨氮、亚硝态氮性能的影响,从而对实际应用的可行性提供指导。
1 材料和方法
1.1 取样地点及方法
分别从河北省昌黎县黄金海岸海边、秦皇岛粮丰海洋生态科技开发有限公司养鱼池、河北省昌黎县蒲河口取海水500 mL,带回放置冰箱冷藏室备用。
培养基用海水取自蒲河口(粗含盐质量浓度为35 g/L)。
1.2 培养基
1.2.1 基础培养基[5]葡萄糖 1.2 g,K2HPO40.5 g,KH2PO40.5 g,1/3 海水1 000 mL,pH 7.0,琼脂粉20 g。
1.2.2 筛选培养基 在基础培养基的基础上分别加入:(1)NaNO21.0 g;(2)(NH4)2SO42.0 g;(3)NaNO21.0 g,(NH4)2SO42.0 g。配置成3 种筛选培养基。
所用试剂均为分析纯。
1.3 菌体筛选
取3种不同来源的海水0.05 mL,在超净工作台处分别接种于3种不同的培养基平板。用无菌涂布棒涂布均匀。待样品干燥后将培养皿倒置于恒温培养箱中30℃培养。据菌落颜色及形态特征,挑取有代表性的单菌落,在相应培养基的平板上划线纯化,直至得到单菌落。将在固体平板上生长状况良好的菌种每个挑2环接种到相应的液体培养基中摇瓶培养,每个摇瓶中装液体培养基100 mL,3 d后对所培养菌种进行脱氮性能鉴定[6~9]。
利用筛选得到的反硝化细菌研究不同pH值,温度,C/N条件下去除氨氮及亚硝酸盐的能力。
培养基为基础培养基+NaNO21.0 g,(NH4)2SO42.0 g;pH值用盐酸调节,温度采用不同的恒温摇床,C/N为葡萄糖中的C与氨氮及亚硝酸盐中的N之比。
1.4 亚硝态氮及氨态氮测定
采用水博士氨氮测试盒和亚硝态氮测试盒测定NH+4-N,NO-2-N的质量浓度以及监测摇瓶溶氧量(溶氧量2 mg/L ±0.3 mg/L)。
1.5 数据处理统计方法
运用Excel和DPS软件对试验数据进行统计分析。
2 结果与分析
2.1 反硝化细菌的筛选
将3种不同来源海水分别接种于3种不同的培养基上之后,最终获得了5个菌种。对获得的5种菌分别取2 mL加入到相应的初始质量浓度分别为NH+4-N 200 mg/L,NO-2-N 150 mg/L的100 mL培养液中,经12 h后测得剩余NH+4-N 200 mg/L,NO-2-N的质量浓度如图1所示,剩余质量浓度越低说明降解效果越好。结果表明:4号菌所在培养基中亚硝态氮的剩余质量浓度最低,仅0.5 mg/L,说明其降解亚硝态氮的能力最强;5号菌所在培养基中氨氮的剩余质量浓度最低,约在12 mg/L,说明其降解氨氮的能力最强;但2号菌所在培养基中剩余氨氮、亚硝态氮的综合浓度是5种菌里边最低的,说明2号降解亚硝态氮、氨氮的综合能力最强,保留该菌种,进行后续试验。
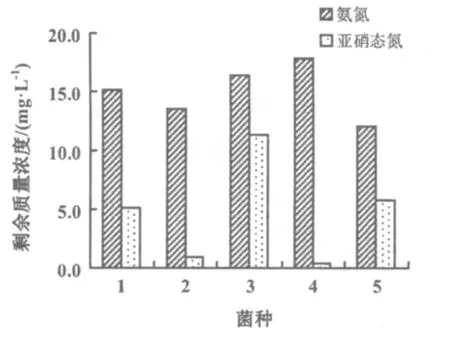
图1 不同菌处理后氨氮和亚硝态氮的剩余质量浓度
2.2 pH值对反硝化细菌降解氨氮、亚硝态氮性能的影响
36 h内不同pH值对反硝化细细菌去除亚硝态氮效果的影响情况见图 2。在36 h 后 pH 值在 6.5,7.5,8.5时的降解率,分别达到了 82.78%,94.65%,76.76%。pH值为7.5时降解率有最高值94.65%,pH值为6.5时的降解率与pH值为8.5时差异性不显著。pH值为5.5和9.5时对亚硝态氮的清除能力分别为45.89%,59.67%,明显比不上其他3种pH值下的降解率。综上可知,在pH值约为7.5时反硝化细菌对亚硝态氮的清除能力最强。
36 h内不同pH值对反硝化细菌去除氨氮效果的影响情况见图 3。在经过 36 h 后,pH 值在 6.5,7.5,8.5时的降解率,分别达到了 76.29%,83.25%,66.83%。而pH值在5.5,9.5时的降解率仅有36.64%,56.43%,明显逊色于其他3种pH值下的降解率,且pH值在6.5时的降解率与在7.5时的降解率差异不显著。所以,反硝化细菌对氨氮降解的最适pH值约为 7.5。
对比图2图3,反硝化细菌对亚硝态氮的清除能力比铵态氮强。pH值约在7.5时,对两者的清除能力均较强。
2.3 温度对反硝化细菌去除氨氮、亚硝态氮性能的影响
36 h内不同温度对反硝化细菌去除亚硝态氮效果的影响情况见图4。在不同的温度条件下,随着时间的增长,反硝化细菌对亚硝态氮的降解率逐渐增大,且在36 h时30℃条件下的清除率达到了94.63%,35℃条件下的降解率达到了97.68%,两者的降解效率比较接近,且都处于较高水平。在40,25,20℃时的降解率分别为81.43%,80.58%,67.34%。可以看出,在30,35℃的降解率差异不显著,且均处于较高水平,可知30~35℃的温度范围是反硝化细菌降解亚硝态氮的最适范围。
36 h内不同温度对反硝化细菌去除氨氮效果的影响情况见图5。经过36 h后,温度为35℃时有最高降解率85.32%,30℃时的降解率达到了78.54%,仅次于35℃时的降解率;而在温度为20,25,40℃下的降解率仅为45.34%,63.45%,56.12%,从而可以看出,温度在30~35℃时反硝化细菌对氨氮的清除能力较强。
对比图4图5,反硝化细菌对亚硝态氮的清除能力比氨氮强。温度在30~35℃间,对两者的清除能力均较强。
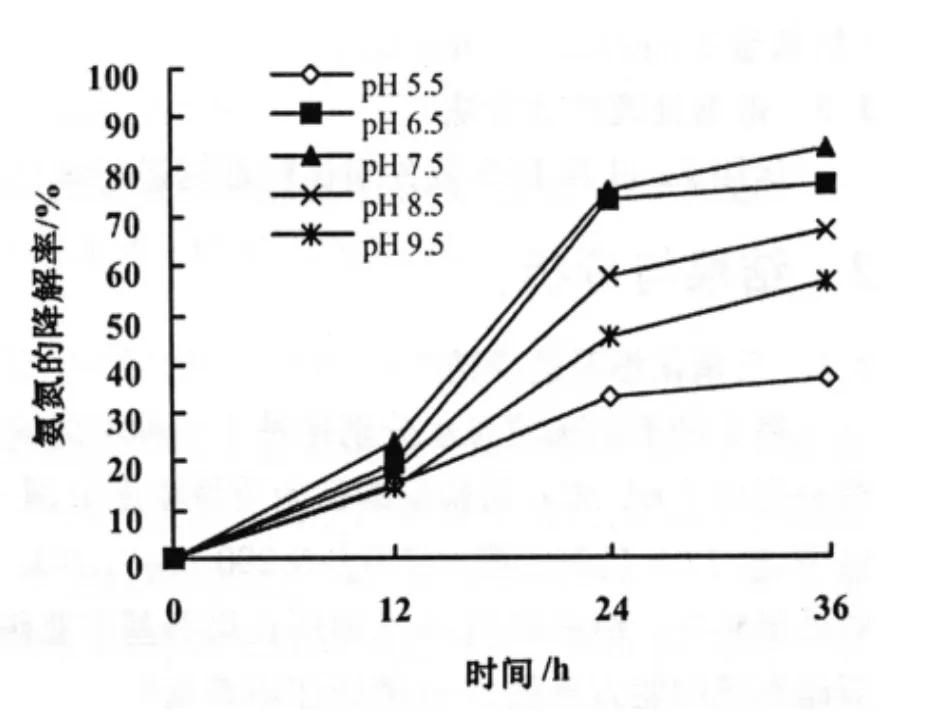
图3 pH值对反硝化细菌降解氨氮的影响
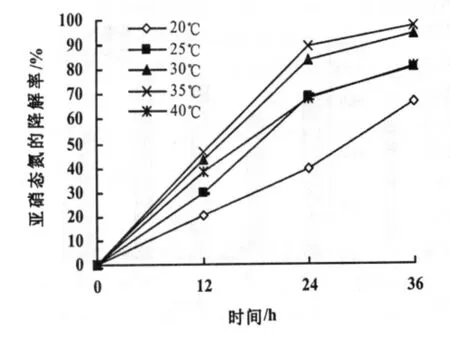
图4 温度对反硝化细菌降解亚硝态氮的影响

图5 温度对反硝化细菌降解氨氮的影响
2.4 C/N对反硝化细菌去除氨氮、亚硝态氮性能的影响
36 h内不同C/N下反硝化细菌对亚硝态氮的降解性能见图6。在起始阶段,不同C/N下的降解率均较低,12 h后对于降解率开始逐渐增强,且在36 h时,C/N为7时的降解率达到了最高值94.34%;降解率处于第二位的是在C/N为5时的降解率,达到了73.78%,两者之间的差异性显著;其他3种C/N下的降解率比C/N为5时的降解率还要低,故在C/N为7时反硝化细菌对亚硝态氮有较高的降解率。
36 h内不同C/N下反硝化细菌对氨氮的降解性能见图7。随着时间的延长,反硝化细菌在不同C/N下的降解率均逐渐增强,且C/N为7时的降解率一直处于优势状态。在36 h时,C/N为7时的降解率达到了最高值73.45%,相对于其他4种C/N比有明显优势。所以,在C/N为7时反硝化细菌对于氨氮具有较高的降解率。
对比图6图7,在C/N为7时,反硝化细菌对氨氮、亚硝态氮的降解率均较高,且随时间的延长降解率升高。

图6 C/N对反硝化细菌降解亚硝态氮的影响
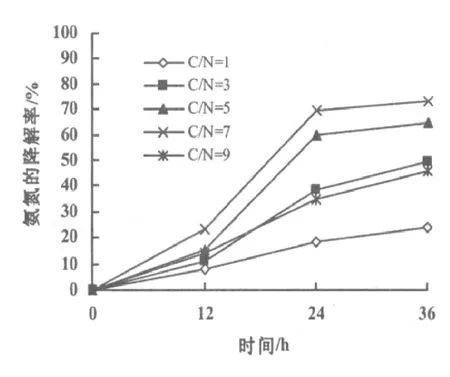
图7 C/N对反硝化细菌降解氨氮的影响
3 结论与讨论
本次研究结果表明,对反硝化细菌降解亚硝态氮、氨氮的最适pH值约为7.5,而一般认为在中性偏碱性条件下适合微生物进行反硝化作用[10]。当pH值超出这个范围时,会影响反硝化细菌的生长速率和反硝化酶的活性,使脱氮效率有所下降。王敏[11]认为,硝酸菌生长的最佳pH值为7.4~8.3。陈徉[12]认为,反硝化微生物生长的最适宜pH值为7.0~8.5,当pH值大于8.5或小于6.0时,将会较大地影响海水反硝化细菌的处理效果,使反硝化速率大大降低。
赵昕[7]认为,海水反硝化细菌的适应范围比较广,在25~40℃的范围内都有较好的降解效果,而本次研究获得的反硝化细菌在温度为30~35℃的范围内对亚硝态氮的降解率达到了94%以上,对氨氮的降解率达到了78%以上,因此还是需要较高水温的。
不同的碳源种类是通过影响硝酸还原酶以外的其他酶来影响反硝化作用过程的。C/N对反硝化作用的影响受培养方式、温度、所用碳源等多种因素的影响[13]。本次研究所选择的反硝化细菌适合的C/N为7。
本次研究获得的反硝化细菌有待进一步进行生物学鉴定。
利用微生物来降解养殖水体中的有害铵态氮、亚硝态氮是未来生态养殖的一个趋势,相信伴随着国民对食品安全性的重视,微生物制剂在水产养殖上有更广阔的应用前景。
[1]丁彦文,艾红.微生物在水产养殖中的应用[J].湛江海洋大学学报,2000,20(1):68-73.
[2]丁爱中,陈繁忠,雷剑全,等.光合细菌调控水产养殖业水质的研究[J].农业环境保护,2000,19(6):339-341,344.
[3]王晓姗,刘杰,于建生.海洋氮循环细菌研究进展[J].科学技术与工程,2009,9(17):5 057-5 064.
[4]李基东.反硝化脱氮碳源研究现状[J].山西建筑,2008,34(8):8-9.
[5]罗秀针,徐长安,唐旭,等.反硝化细菌的筛选及其亚硝酸盐降解特性的研究[J].福建农业学报,2010,25(4):513-516.
[6]李永勇,罗泽娇,毛绪美,等.好氧反硝化细菌的筛选及反硝化效率测定[J].安徽农业科学,2008,36(6):2 191-2 193.
[7]赵昕,夏文香,陈丽丽,等.海水反硝化细菌富集培养及性能研究[J].生物技术,2010,20(4):75-77.
[8]蔡昌凤,梁磊.高效好氧反硝化细菌的筛选及脱氮特性的研究[J].环境科学与技术,2011,34(1):41-44.
[9]BOIVIN A,CHERRIER R,SCHIOVON M.A comparison of five pesticides adsorption and desorption processes in thirteencontrasting fields soil[J].Chemosphere,2005,61:668-676.
[10]BAUMANN B,SNOZZI M,ZEHNDER A J B,et al.Inhibition of denitrification activity but not of mRNA induction in Paracoccus denitrificans by nitritc at a suboptimal pH[J].Antonie van Leeuwenhock,1997,72:183-189.
[11]王敏,汪建根.短程硝化-反硝化生物脱氮过程的影响因素研究[J].污染防治技术,2009,22(4):59-62,108.
[12]陈徉,陈英文,沈树宝.环境温度下短程硝化反硝化试验研究[J].中国给水排水,2008,24(15):93-96.
[13]傅利剑,郭丹钊,史春龙,等.碳源及碳氮比对异养反硝化微生物异养反硝化作用的影响[J].农村生态环境,2005,21(2):42-45.

