鸭疫里氏杆菌吉林分离株16S rRNA系统分析及其OmpA基因克隆
高云航,刘佳丽,王 巍,徐凤宇,张福君,马红霞*
(1.吉林农业大学动物科技学院,长春 130118;2.吉林正方农牧股份有限公司,吉林梅河 135000)
鸭疫里氏杆菌(Riemerella anatipestifer,RA)是一种能够引起家鸭、鹅、火鸡等禽类高发病率和高死亡率的传染性疾病[1-2]。该病雏鸭较为敏感,对养鸭业造成严重经济损失[3-4]。OmpA蛋白族是革兰氏阴性菌外膜中的主要成分,其主要作用是维持外膜的完整。缺少OmpA和胞壁脂蛋白的细菌变异株其形态为球形,细胞膜也不稳定[5]。众多试验研究证明,提纯的外膜蛋白和表达的外膜蛋白具有良好的抗原性[6],能刺激机体产生细胞免疫和体液免疫。OmpA是各血清型RA所共有的外膜蛋白,具有种内相对保守性,但在不同的血清型之间存在着差异。曾有研究认为这种差异不足以影响蛋白质的抗原特性,因此可以作为保护多种血清型RA的亚单位疫苗的候选[7]。而16S rRNA在原核生物的细胞中普遍存在[8],其在常见细菌的鉴别中发挥着不可忽视的作用。另外,16S rRNA在鉴别难于区分的细菌、生长速度缓慢的分支杆菌及微环境中广泛存在的细菌等方面均具有十分重要的意义[9]。
因此,本文对从吉林省某鸭场分离出的两株RA,对其16S rRNA基因的序列进行系统进化分析,设计特异性引物PCR扩增出两株菌各自OmpA基因进行了序列测定与分析,以寻求RA 16S rRNA变异与OmpA基因之间的关系,为进一步研究RA的变异及其亚单位疫苗提供一定参考依据。
1 材料
1.1 菌种 RA吉林分离株 JL-RA1、JL-RA3,本实验室分离并保存;大肠杆菌DH5α感受态细胞,北京全式金生物公司。
1.2 主要分子生物学试剂 EB、Amp,北京鼎国生物工程公司;ExTaq DNA聚合酶、Pyrobest DNA聚合 酶、T4 DNA Ligase、DNA Marker、dNTP、pMD-18T Simple Vector、限制性内切酶,日本TaKaRa公司;质粒小提试剂盒,天根生物公司;胶回收试剂盒,杭州维特洁生化技术有限公司。
1.3 引物设计 RA 16S rRNA基因序列的扩增采用细菌16S通用引物[10]:
TY -P1:5’-AGAGTTTGATCCTGGCTCAG -3’;
TY-P2:5’-AAGGAGGTGATCCAGCC-3’。
根据已发表的不同血清型RA的OmpA全基因组序列(JQ083167、JN871507、JN871505 等)利用DNAStar软件进行对比分析,并根据其保守区域设计特异性引物,由上海生物工程技术服务有限公司合成:
OmpA-P3:5’-GCGATGGRYAARGAATTTATG-3’;
OmpA-P4:5’-GCGTTATTTTCTTTTCTTTTTTAC-3’。
2 方法
2.1 RA基因组总 DNA提取 用碱裂解法[11]提取分离株JL-RA1、JL-RA3基因组总DNA。
2.2 分离株16S rRNA序列扩增与测定
2.2.1 分离株16S rRNA序列扩增 PCR反应体系:模板总 DNA 0.5 μL,TY - P1 0.5 μL,TY - P2 0.5 μL,2.5 mmol/L dNTPs Mixture 2.0 μL,10 ×Ex Taq Buffer(Mg2+Plus)2.5 μL,Ex Taq(5 U/μL)0.3 μL,ddH2O 18.7 μL,总体积 25 μL。PCR 反应条件:94℃预变性5 min;94℃变性1 min,52℃退火1 min,72℃延伸1 min,30个循环;72℃再延伸10min。
2.2.2 分离株16S rRNA序列测定与分析 将两株菌16S rRNA PCR产物均送往上海生工生物科技公司进行双向测序。测序结果利用NCBI BLAST软件于GenBank中同源性较高的菌株序列进行比对分析,选取RA各血清型代表菌株及高同源性菌株,并用DNAStar中Meg Align软件分析构建系统进化树,确定该菌株的分类学地位。
2.3 分离株OmpA序列扩增与测定
2.3.1 分离株OmpA序列扩增 PCR反应体系:模板总 DNA 0.5 μL,OmpA - P3 0.5 μL,OmpA - P4 0.5 μL,2.5 mmol/L dNTPs Mixture 2.0 μL,10 ×Ex Taq Buffer(Mg2+Plus)2.5 μL,Ex Taq(5U/μL)0.3 μL,ddH2O 18.7 μL,总体积25 μL。PCR 反应条件:94℃预变性5 min;94℃变性1 min,51℃退火1min,72℃延伸1min,30个循环;72℃再延伸10min。2.3.2 分离株OmpA序列测定与分析 将两株菌OmpA PCR产物均送往上海生工生物科技公司测序。测序结果利用NCBI BLAST软件于GenBank中同源性较高的菌株序列进行比对分析,并用DNAStar中MegAlign软件分析构建系统进化树,确定该菌株的分类学地位。
3 结果
3.1 分离株总DNA的提取结果 由图1电泳结果可知,两株分离株JL-RA1、JL-RA3总DNA,其核苷酸片段大小约为23000 bp,与预期结果相符。
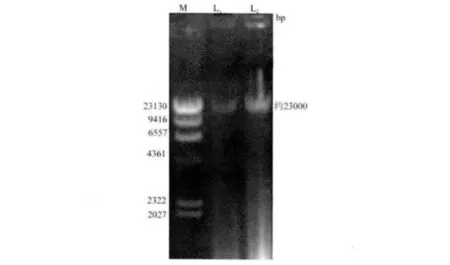
图1 RA总DNA电泳结果
3.2 分离株16S rRNA序列扩增结果与分析
3.2.1 分离株16S rRNA序列扩增结果 两株分离株JL-RA1和JL-RA3 16S rRNA序列扩增结果见图2,得到约为1478 bp的核苷酸片段,其片段大小与预期结果相符。
3.2.2 分离株16S rRNA序列测定结果与同源性分析 JL-RA1、JL-RA3 16S rRNA PCR扩增产物的测得序列大小均为1478bp,并将测序结果登陆到GenBank中,获得登录号分别为 HQ392516和HQ707076(登录系列为已去掉引物部分)。JL-RA1、JL-RA3 16S与GenBank中已知的RA16S rRNA序列相似性较高(图3)。鸭疫里默氏杆菌分离株系统进化分析结果如图4所示。
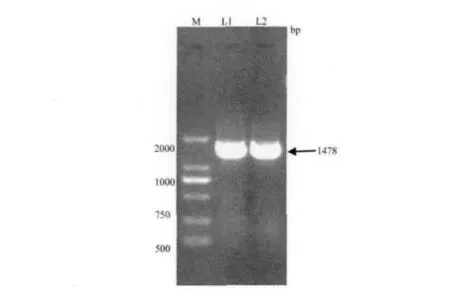
图2 16S rRNA PCR扩增结果
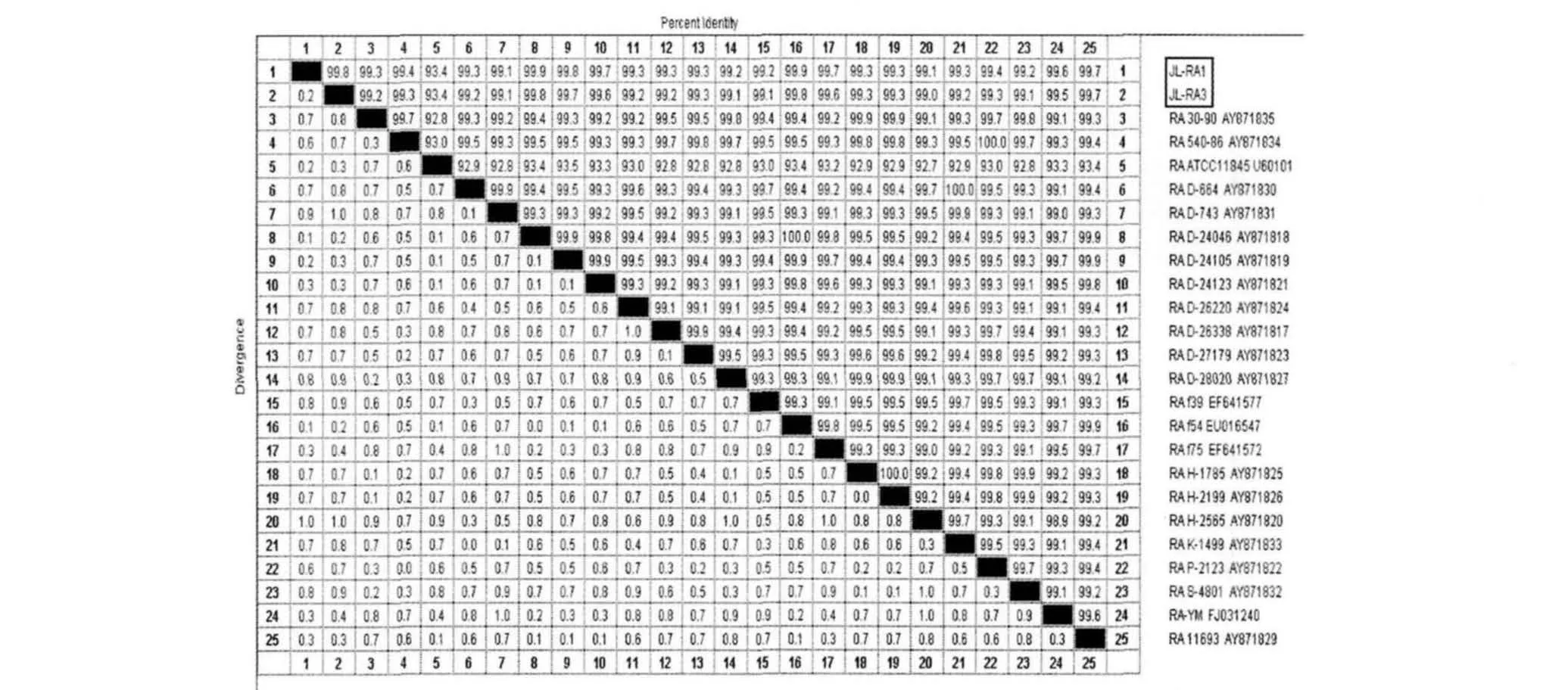
图3 分离株JL-RA1、JL-RA3 16S rRNA矩形图

图4 分离株JL-RA1、JL-RA3 16S rRNA系统进化树
3.3 分离株OmpA PCR序列扩增结果与分析
3.3.1 分离株 OmpA序列扩增结果 JL-RA1、JL-RA3 OmpA基因PCR扩增结果显示,仅有一条目的条带,大小约为1182 bp,PCR扩增产物大小与预计目的片段大小相符,见图5。
3.3.2 分离株JL-RA1 OmpA序列测定及同源性分析 将JL-RA1、JL-RA3 OmpA基因PCR产物测得序列大小为1182 bp,并将测序结果登陆到GenBank中,获得登录号分别为 HQ707077和HQ707078。

图5 JL-RA1 Om pA、JL-RA3 Om pA扩增结果
JL-RA1和JL-RA3 OmpA测得长度为1164个核苷酸的序列组成的ORF,编码387个氨基酸组成的蛋白质,起始密码子均为ATG,终止密码子均为TAA,其核苷酸序列非常保守。利用BLAST软件与GenBank中已知的鸭疫里默氏杆菌OmpA序列进行同源性对比,JL-RA1、JL-RA3与已报道的鸭疫里默氏杆菌株OmpA基因序列相似性较高(图6)。鸭疫里默氏杆菌分离株OmpA系统进化分析表明结果如图7所示。
4 讨论

图6 分离株JL-RA1 Om pA矩形图

图7 分离株JL-RA1 OmpA系统进化树
细菌的16S rRNA基因分子结构是保守区和特异性区域交替出现,因此针对保守区设计细菌通用引物,将所得的序列与GenBank中已知序列比对,此方法常用于对细菌的种属鉴定[12],比常规细菌生化鉴定更准确快速。李永峰等[13]根据Matsuki的研究,认为16S rRNA序列的同源性大于97%便可认为是同一种细菌。本试验分离株JL-RA1、JL-RA3与 RA标准株 ATCC11845(登录号U60101)序列同源性高达99.6%和99.5%,进一步说明两株分离株均为RA。这种方法可以更加快捷准确的确定细菌的种属及其分类地位。程龙飞等[14]对29株1型和2型 RA 16S rRNA 和16S-23S rRNA间隔区的核苷酸序列,亲缘关系比较以及针对各菌灭活苗进行交叉攻菌保护试验,证明2型RA菌株中的RA f11并不处在2型菌株的分支中,与1型菌株非常接近,其对1型菌株的攻击可产生较高的交叉保护率达53.8%。本试验分离株属于RA 1型,但与RA 2型较1型更近,推测分离株JL-RA1和JL-RA3是否具有1型和2型的交叉保护力,将对此进行进一步验证。
OmpA是革兰氏阴性菌外膜的主要组成成分,具有免疫原性和相对保守性,不仅可激发机体产生体液免疫,而且还可引起细胞免疫,常被用于试剂疫苗的研究,如多杀性巴氏杆菌、流感嗜血杆菌、鼠伤寒沙门氏菌、鸭疫里默氏杆菌、猪胸膜肺炎放线杆菌等的外膜蛋白,展现出良好的应用前景[15-16]。目前,已有不少学者对RA的表面免疫蛋白进行了研究,并认为OmpA基因是所有血清型的RA所共有的结构基因,尽管其机理尚未完全清楚,但周祖涛[17]等用PCR方法扩增了血清1型RA-YM株的主要外膜蛋白OmpA基因,并构建了原核表达载体pKG-OmpA,在大肠杆菌中进行了高效表达,融合蛋白大小约为68 kD,Western-blot结果表明该表达蛋白具有良好的免疫原性。本研究成功的扩增了 JL-RA1和 JL-RA3的 OmpA基因,与GenBank中已报道的RA OmpA(1型)的序列同源性较高。从JL-RA1 16S和OmpA系统进化分析可以看出,该分离株16S和OmpA均与血清型1型亲缘关系较近,与本试验结果一致。
本试验两株分离株JL-RA1、JL-RA3分离自同一发病养鸭场,JL-RA1为该鸭场初次发病时分离得到,病情得以控制后,再次发病时分离得到JL-RA3,与RA易反复爆发形成地方性疾病这一特征相符[18]。两株菌从16S rRNA基因和 OmpA基因同源性均为99.8%,由此可以看出,RA的16S rRNA基因和OmpA保护性基因有微小变异,但其毒力基因是否发生变异,需进行进一步验证。
[1] 陈溥言.兽医传染病学[M].北京:中国农业出版社.400-401.
[2] 李春业.鸭疫里氏杆菌病病原的分离鉴定[J].中国畜牧兽医,2012,39(9):95 -97.
[3] 黄承洪,李继样,黄 伟,等.重庆和四川地区鸭疫里默氏杆菌流行动态研究[J].中国预防兽医学报,2007,29(1):67 -70.
[4] [美]B.W.卡尔尼松.禽病学[M].高 福,刘大军,主译.第9版.北京:中国农业出版社,1998:195-200.
[5] Weiser JN,Gotschlich E C.Outermembrane protein A(ompA)contributes to serum resistance and pathogenicity of Escherichia coli k - l[J].Infect Immune,1991,59(7):2252 -2258.
[6] 朱德康,程安春,汪铭书,等.鸭疫里默氏杆菌基因组文库的构建及免疫原性基因初步筛选[J].中国兽医学报,2007,27(6):834-837.
[7] Sumat hi Subramaniam,Huang B,Loh H,etal.Characterization of a predominant immunogenic outermembrane protein of Riemerella anatipestifer[J].Clinical And Diagnostic Laboratory Immunlogy,2000,7(2):168 -174.
[8] 周 琳,张 杰.群落分析中的16S rRNA及其基因16S rDNA优化扩增[J].微生物学报,2010,50(1):7 -14.
[9] 杨 霞,陈 陆,王川庆.16S rRNA基因序列分析技术在细菌分类中应用的研究进展[J].西北农林科技大学学报(自然科学版),2008,36(2):55 -60.
[10]汪春蕾.具细菌漆酶活性的芽抱外壁蛋白CotA基因克隆及异源表达研究[D].黑龙江:东北林业大学,2011.
[11]李淑梅,汪铭书,程安春,等.鸭沙门氏菌的随机扩增多态性DNA 分析[J].中国兽医科技,2004,34(4):40 -44.
[12]陈泽祥,潘 艳,谢永平,等.鸭疫里氏杆菌广西分离株16SrRNA基因序列的测定和系统进化分析[J].广西农业科学,2007,38(2):205 -208.
[13]李永峰,任南琪,杨传平,等.16S rDNA测序快速鉴定废水生物处理系统目标细菌[J].哈尔滨工程大学学报,2005,26(6):806-810.
[14]程龙飞,傅光华,彭春香,等.1型和2型鸭疫里默氏菌的交叉保护[J].福建农林大学学报(自然科学版),2009,38(5):521-525.
[15] Cheema P S,Srivastava S K,Chaudhuri P,et al.Cloning and sequencing of a 21kDa outermembrane protein gene of Leptospira interrogans serovar Canicola strain Hond Utrecht IV[J].Vet Res Commun,2007,31(5):521 -527.
[16] Gebriel A M,Subramaniam G,SekaRan S D.The detection and characterization of pathogenic Leptospira and the use of OMPs as potential antigens and immunogens[J].Trop Biomed,2006,23(2):194-207.
[17]周祖涛,陈芬芬,李自力,等.鸭疫里默氏杆菌OmpA基因的克隆与表达[J].中国兽医学报,2008,28(1):20 -23.
[18]刘佳丽.鸭疫里默氏杆菌OmpA与鸭IL-2融合基因的克隆与原核表达[D].吉林:吉林农业大学,2011.

