前列腺癌ADC值与PSA浓度的相关性研究
陈昌毅,黄满华,王远梅,熊浩,胡新杰
前列腺癌是前列腺中最常见的恶性肿瘤,随着人口老龄化的不断发展和饮食结构的逐渐西方化,我国的前列腺癌发展形势将更加严峻。MRI具有较高的软组织分辨力,可进行多方位成像,是前列腺癌的理想检查方法[1]。扩散加权成像(diffusion weighted imaging,DWI)是目前唯一能够测定活体组织内水分子扩散运动的无创性检查方法。活体中水分子所在的组织不同,即所处的微环境不同,其扩散能力也不同,DWI检查能将这种扩散能力转化为图像并计算表观扩散系数(apparent diffusion coefficient,ADC)值,有助于病变的定性诊断[2]。血清前列腺特异性抗原(prostate specific antigen,PSA)是前腺癌的特异性标志物,有助于前列腺癌的诊断。本研究旨在探讨各期前列腺癌ADC值与PSA浓度的相关性。
材料与方法
1.研究对象
搜集我院2009年1月-2012年3月经病理证实的36例前列腺癌患者,平均年龄50.4岁。所有病例均行超声引导下穿刺活检(20例)或经手术病理证实(16例)。
2.MRI成像方法
MR平扫:采用GE signa1.5TMR成像仪行横轴面、矢状面、冠状面T1WI、T2WI检查,视野25cm×25cm,矩阵256×256mm,层厚4mm,层间距1mm。扫描前嘱患者检查前一天进食少渣食物,检查前适度充盈膀胱,患者取仰卧位,盆腔相控阵线圈,扫描中心位于耻骨联合上2cm处。
DWI采用单次激发SE-EPI加脂肪抑制序列,TR 3200ms,TE 94ms,翻转角90°,视野25cm×25cm,矩阵128×128,层厚4mm,层间距1mm。分别在SE序列180°脉冲前后施加梯度扩散因子,b值=600s/mm2。取层面选择、频率编码、相位编码三个方向,共同经计算机处理得到ADC图。
3.前列腺癌临床分期
目前前列腺癌临床采用两种分期方法:Whitmore-Jewett分期和TNM 法。Whitmore-Jewett分期分为 A、B、C、D四期[3]。A 期:未触及肿块,偶然发现无临床症状的隐性灶,A1为局限性,A2为弥漫性。B1期:肿瘤局限于前列腺包膜内,累及一叶,肿瘤直径<1.5cm;B2期:肿瘤局限于前列腺包膜内,累及二叶,肿瘤直径>1.5cm。C期:肿瘤穿破前列腺包膜,C1期可见包膜外小病灶,C2期肿瘤侵犯精囊、膀胱、直肠、壁等。D1期:上述任何一种情况伴盆腔淋巴结转;D2期:上述任何一种情况伴包括骨盆骨转移的远处转移。TNM分期中T1期为组织学检查偶然发现前列腺癌;T2期:肿瘤局限于腺体内;T3期:肿瘤侵犯前列腺顶部或侵犯被膜以外、膀胱颈部或精囊,但肿瘤尚未固定;T4期:肿瘤已固定或侵犯T3以外的邻近结构或器官,出现淋巴结或骨转移[4]。有文献显示MRI检查在前列腺癌TNM分期中是最精确且最常用的方法。本研究采用TNM分期。
4.统计学分析
结 果
36例前列腺癌患者根据其MR影像表现,按TNM分期法进行分期,其中T2期22例(图1)、T3期6例(图2)、T4期8例(8例均发生骨盆骨转移)。PSA浓度为5.1~430.0ng/ml,平均120.0ng/ml。所有病例均累及外周带,T2WI在高信号外周带内见结节样或片状信号减低区,部分病例表现为单侧或双侧外周带信号弥漫性减低。12例同时累及外周带和中央带,T2WI上表现为较大的低信号肿块,累及大部分腺体组织,边缘多呈结节状,累及中央带的部分难以确定其范围。所有病例病灶组织DWI成像时均表现为高信号。ADC值为(0.26~0.98)×10-3mm2/s,各期前列腺癌之间的ADC值差异无统计学意义(P>0.05),PSA浓度随着肿瘤分期的增加而增高,差异有统计学意义(P=0.02,表1)。
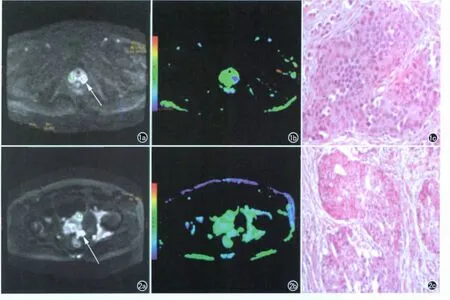
图1 前列腺癌,T2a期,PSA值76.8ng/ml。a)MRI示前列腺外周带局限性高信号(箭);b)前列腺癌ADC图,ADC值为0.68×10-3 mm2/s;c)镜下可见实性结构(×200,HE)。 图2 前列腺癌T3期,PSA浓度312.1ng/ml。a)MRI示外周带前部高信号(箭),局部包膜受侵;b)前列腺癌ADC图,外周带前部病灶ADC值为0.714×10-3 mm2/s;c)镜下可见腺体呈网状结构(×200,HE)。
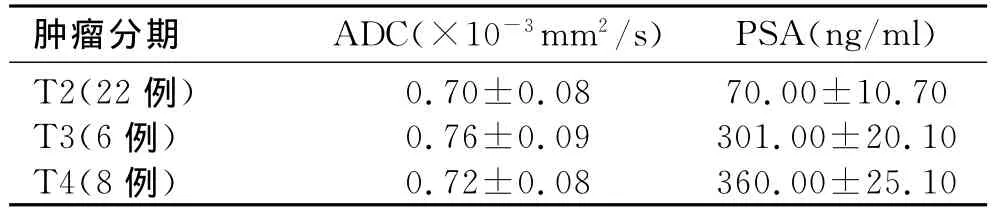
表1 36例前列腺癌ADC及PSA值
对各期ADC值和PSA浓度进行相关性分析,结果表明T2期ADC值和PSA浓度之间呈负相关,r=-0.638,P<0.01;T3期 ADC值和PSA浓度之间呈负相关,r=-0.674,P<0.01;T4期 ADC值和PSA浓度之间呈负相关,r=-0.731,P<0.01。
讨 论
扩散是指分子的随机侧向运动,即布朗运动。DWI是在T2WI序列180°脉冲前后加上两个对称的扩散梯度敏感脉冲。对于静止(扩散低)的水分子,第一梯度脉冲所致的质子自旋去相位会被第二梯度脉冲再聚焦,信号不降低;而对运动(扩散强)的水分子,第一梯度脉冲所致的质子去相位离开了原来的位置,不能被第二梯度脉冲再聚焦,信号降低。DWI与回波平面成像(echo planar imaging,EPI)技术结合使用可以减少成像时间,消除生理活动(呼吸、脉搏)所造成的ADC值下降。组织中水的扩散可以直接反映其内在组织环境,如组织微细结构、水分子结合程度、蛋白质聚焦程度、水环境中的大分子等。肿瘤中水的扩散可反映其营养成分的输送、清除过程,DWI通过组织内微环境中水分子的扩散特性,反应不同组织的空间结构信息[5]。ADC值是评价组织微环境流动效应的定量指标,组织的微观结构直接影响着扩散程度,在前列腺疾病诊断和鉴别诊断中有较高价值[6]。在动物肿瘤模型中扩散参数(ADC值)的测量已显示了其应用潜力,如提供肿瘤形态全貌、肿瘤坏死信息等,作为一种无创性检查方法,DWI可评估肿瘤的化疗、放疗疗效[7]。
前列腺癌通常由众多较小、紧密排列的肿瘤上皮细胞构成,细胞密度大,且肿瘤细胞有着比正常细胞更多的细胞内和细胞间的膜结构,另外,由于肿瘤细胞的增殖,细胞外间隙受压、扭曲、变小,细胞外间隙水分子的扩散运动受到限制,这些原因造成了肿瘤区水分子扩散运动的减弱,从而使ADC值下降,本研究结果与国内外相关研究结果相符[8-10]。
不同级别前列腺癌的生物学特征存在较大的差异,分化高的前列腺癌的细胞及组织结构的异型性小,细胞的结构与功能更接近于正常前列腺上皮细胞,细胞代谢及增殖相对较慢,对于血液供应的需求相对较低;分化低的前列腺癌细胞在功能与形态上与正常前列腺上皮细胞差异大,细胞密度及核浆比增大,细胞增殖速度快、排列紧密、代谢旺盛,对血液供应需求增加。肿瘤ADC值下降也可从影像学角度反应出癌组织血液供应与细胞增殖之间的相对平衡关系[11]。本研究显示肿瘤组织ADC值与TNM分期无明显相关性,可能是由于前列腺癌组织内细胞空间排列及间质成份不均匀,同时ADC值受多种因素干扰所致。
正常情况下,PSA是由前列腺上皮细胞分泌产生的一种丝氨酸蛋白酶,直接分泌到前列腺导管系统内,它的正常功能是帮助精液凝块水解液化,与男性生育功能有关。正常的前列腺导管系统周围存在血-上皮屏障,避免前列腺上皮产生的PSA直接进入血液之中,从而维持了血液中PSA的低浓度。一般认为,血清PSA浓度<4ng/ml为正常,>10ng/ml则患前腺癌的危险性增加。当前列腺发生癌变时可破坏血-上皮屏障,同时癌细胞分泌的PSA增多,致使更多的PSA直接进入血液内。前列腺癌恶性程度越高,对于正常前列腺组织的破坏越大,血液中PSA浓度越高。Ceriani等[12]认为前列腺癌PSA的升高与前列腺被侵犯程度及病理分期密切相关,前列腺癌的分期越晚,前列腺正常的生理屏障破坏越严重,导致更多的PSA渗透至血液循环中,血清PSA浓度就越高,与本研究显示的PSA浓度与前列腺TNM分期呈正相关相一致。
本研究显示前列腺癌ADC值与肿瘤TNM分期之间无相关性,PSA浓度与肿瘤TNM分期呈正相关。ADC值与PSA浓度在前列腺癌各期之间存在负相关关系。郑祥毅等[13]研究发现血清PSA浓度与肿瘤Gleason评分、临床分期呈正相关性,与本组研究结果一致。
磁共振DWI成像和PSA浓度测量有利于前列腺癌的诊断和分期,还可根据ADC值和PSA浓度的变化情况对前列腺癌的生物学特征进行初步评估。
[1]王锡臻,王滨,刘作勤,等.联合PWI与DWI评价前列腺癌生物学特征的应用价值[J],放射学实践,2008,23(11):1227-1231.
[2]赵新,白人驹,孙浩然.联合应用磁共振灌注成像和弥散成像对前列腺癌的诊断价值研究[J].天津医科大学学报,2009,15(3):434-436.
[3]Wilhe F,Whitmore Jr.Natural history and staging of prostate caneer[J].Urologic Clinics of NorthAmerica,1984,11(3):205-210.
[4]白人驹,马大庆.医学影像诊断学[M].北京:人民卫生出版社,2006:569.
[5]任静,宦怡,常英娟,等.DWI在正常前列腺及前列腺疾病的初步应用[J].中国医学影像技术学,2007,23(5):748-750.
[6]吴道清,陈自谦.DCE MRI与DWI对良恶性前列腺疾病诊断的价值[J],临床放射学杂志,2010,29(2):211-215.
[7]李飞宇,王霄英.前列腺癌的 MR进展[J].中华放射学杂志,2009,40(7):756-760.
[8]Housseinzadeh K,Schwarz SD.Endorectal diffusion-weighted imaging in prostate cancer to differentiate malignant and benign peripheral zone tissue[J].J Magn Reson Imaging,2004,20(5):654-661.
[9]王霄英,丁建平,周良平,等.前列腺癌的扩散成像初步研究[J].中华放射学杂志,2005,36(11):1207-1209.
[10]许东,王志军,全勇,等.磁共振扩散加权成像对前列腺癌的诊断价值[J].放射学实践,2006,21(12):1240-1242.
[11]王锡臻,王滨,刘金刚,等.磁共振灌注成像与前列腺癌分期、分
级及PSA的相关性研究[J].实用放射学杂志,2008,24(7):927-928.
[12]Ceriani L,Giovanella L,Salvadore M,et al.Tissue polypeptide specific antigen(TPS)immunoassay in the diagnosis and clinical staging of prostatic.cracinoma,comparison with prostate specific antigen(PSA)[J].Int J Bid Markers,1997,12(1):27-34.
[13]郑祥毅,秦杰,张晨光,等.前列腺癌血清PSA、f/tPSA与 Gleason评分、临床分期的相关性研究[J].中国男科学杂志,2007,21(1):14-17.

