山药中尿囊素最佳提取方法的优选△
易刚强,蒋孟良*,鲁耀邦,刘朝晖,钟振平,罗跃龙
(1.湖南中医药大学,湖南 长沙 410208;2.药圣堂制药有限公司,湖南 安乡 415600)
中药工业
山药中尿囊素最佳提取方法的优选△
易刚强1,蒋孟良1*,鲁耀邦1,刘朝晖2,钟振平2,罗跃龙1
(1.湖南中医药大学,湖南 长沙 410208;2.药圣堂制药有限公司,湖南 安乡 415600)
目的:优选尿囊素最佳提取方法。方法:以尿囊素含量为评价指标,采用高效液相色谱法测定20%乙醇与甲醇超声提取、20%乙醇与甲醇回流提取及水提法样品中尿囊素的含量。结果:提取的尿囊素含量由高到低顺序为甲醇超声提取2次>20%乙醇超声2次>甲醇超声1次>20%乙醇超声1次>甲醇回流1次>20%乙醇回流1次>水回流1次。结论:尿囊素以甲醇超声提取2次含量最高。
山药;尿囊素;提取方法;高效液相色谱;含量测定
山药为薯蓣科植物薯蓣DioscoreaoppositaThunb.的干燥根茎。具有补脾养胃、生津益肺、补肾涩精的作用。用于脾虚食少,久泻不止,肺虚喘咳,肾虚遗精,带下,尿频,虚热消渴[1]。山药是应用非常广泛、用量非常大的药食两用品种。山药中尿囊素具有促进细胞生长、加快伤口愈合、软化角质蛋白等生理功能,是皮肤创伤的良好愈合剂和抗溃疡药剂[2];它还是糖尿病、肝硬化及癌症治疗药物的重要成分[2]。为了尽量多地提出山药中尿囊素有效成分,实验以尿囊素的含量为评价指标,优选其最佳提取方法。
1 材料与仪器
1.1 药品与试剂
山药经湖南省药品检验所方石林主任药师鉴定为薯蓣科植物薯蓣DioscoreaoppositaThunb.的干燥根茎;尿囊素(供含量测定用,中国食品药品检定研究院,批号:111501-201003);甲醇(高效液相色谱淋洗剂,中国医药集团化学试剂有限公司,批号:T20111213);无水乙醇(分析纯,安徽安特生物化学有限公司,乙醇含量≥99.7%,批号:T20110928)。
1.2 仪器
Agilent1200型高效液相色谱仪(包括紫外可见分光光度检测器,美国);AB135-S型电子天平(0.01 mg,METTLER TOLEDO);KL-UP-Ⅲ-20型艾柯超纯水机(成都唐氏康宁科技发展有限公司);SK3300H型超声波清洗机(上海科导超声仪器有限公司);DK-S22型电热恒温水浴锅(上海精宏实验设备有限公司)。
2 方法
2.1 山药的不同提取方法
2.1.1 超声提取法 取山药细粉约1 g,4份,精密称定,第1份与第2份均加入20%乙醇50.0 mL,第3份与第4份加入甲醇50.0 mL,称重。第1份与第3份分别超声2次,每次30 min,两次之间间隔30 min;第2份与第4份分别超声1次(30 min)。超声完毕之后擦干瓶外侧的水,称重,用溶媒补足至原重,摇匀,即得。
2.1.2 回流提取法 取山药细粉约1 g,2份,精密称定,置烧瓶中,分别加入甲醇与20%乙醇各50.0 mL,置水浴中回流30 min,冷却之后擦干烧瓶外侧的水,称重,用溶媒补足至原重,摇匀,即得。
2.1.3 水提取法 取山药细粉约1 g,精密称定,置烧瓶中,加蒸馏水50.0 mL,置水浴中回流30 min,冷却之后擦干烧瓶外侧的水,称重,用水补足至原重,摇匀,即得。
2.2 含量测定
2.2.1 色谱条件 色谱柱为ODS-C18柱,流动相为甲醇-水(5∶95),流速为0.8 mL·min-1,柱温为30 ℃,检测波长为224 nm。
2.2.2 对照品溶液的制备 精密称取尿囊素对照品10.20 mg,置10 mL量瓶中,加蒸馏水至刻度,精密吸取1.0 mL于10 mL量瓶中,加流动相至刻度,摇匀作为对照品溶液(0.102 mg·mL-1)。
2.2.3 供试品溶液的制备 分别精密吸取2.1项下的各提取液10.0 mL,置小蒸发皿中,水浴上蒸干,残渣加流动相适量使溶解,转移至10.0 mL量瓶中,加流动相至刻度,摇匀,即得。再用针头式滤器(具0.45 μm微孔滤膜)滤过,备测。
2.2.4 线性关系的考察 精密吸取对照品溶液2,4,8,15,20 μL,分别注入高效液相仪中,照上述色谱条件分析,以尿囊素质量X(μg)为自变量,峰面积积分值Y为因变量进行线性回归,求得回归方程Y=342.09X+16.18,r=0.999 6,实验表明尿囊素在0.204~2.04 μg线性关系良好。
2.2.5 精密度试验 精密吸取同一供试品溶液10 μL,重复进样6次,测定峰面积,尿囊素的平均峰面积为982.6,RSD=0.97%,表明仪器的精密度良好。
2.2.6 稳定性试验 精密吸取供试品溶液10 μL,按上述色谱条件进行测定,其平均峰面积积分值为977.9,RSD=1.03%,表明供试品溶液在24 h内稳定。
2.2.7 重复性试验 取同一批山药细粉约1 g,精密称定,加甲醇50 mL超声2次,每次30 min,再按2.2.3方法制备供试液,平行制备6份,分别精密进样10 μL,用外标法计算尿囊素含量,RSD=2.4%。
2.2.8 加样回收率试验 取已知含量(3.12 mg·g-1)的山药细粉约0.5 g,6份,精密称定,分别加入0.75 mg·mL-1的尿囊素2.0 mL,再加入甲醇50.0 mL,称重,分别超声提取2次,每次30 min,两次之间间隔30 min,超声完毕之后擦干瓶外侧的水,称重,用溶媒补足至原重,摇匀,分别精密吸取各提取液10.0 mL,置小蒸发皿中,水浴上蒸干,残渣加流动相适量使溶解,转移至10.0 mL量瓶中,加流动相至刻度,摇匀,再用具0.45 μm微孔滤膜的针头式滤器滤过,取滤液依法测定,并计算回收率,结果表明,该方法回收率良好。见表1。
2.2.9 样品测定 分别精密吸取尿囊素对照品溶液与供试品溶液各10 μL,分别注入高效液相色谱仪中,依法测定,外标法计算含量,结果见表2、色谱图见图1。

表1 加样回收率试验

表2 不同提取方法尿囊素的含量(n=3)
结果表明,用甲醇超声提取2次,每次30 min,含量最高,其次为20%乙醇超声2次及甲醇超声1次,再次为20%乙醇超声1次与甲醇回流1次,20%乙醇与水回流含量最低。
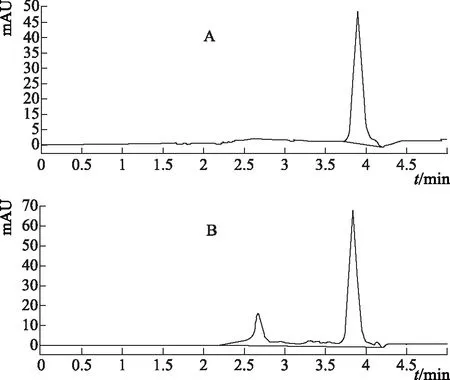
A.尿囊素 B.山药图1 尿囊素对照品及山药HPLC图
3 小结与讨论
实验结果表明,不同提取方法的山药中尿囊素含量顺序是:甲醇超声提取2次>20%乙醇超声2次>甲醇超声1次>20%乙醇超声1次>甲醇回流1次>20%乙醇回流1次>水回流1次。从提取方法来看,超声优于回流;从溶媒来看,甲醇优于20%乙醇,水最差,这可能是在样品处理时甲醇沸点低,受热影响少而破坏少,而水的沸点最高,受热影响大而破坏多,20%乙醇在二者之间;从提取次数来看,以提取2次为佳,增加了近11个百分点,故尿囊素的提取采用甲醇超声提取2次。
据报道,HPLC法测定尿囊素含量的流动相有用甲醇-水(1∶9)[3-5],本实验发现其分离效果并不好,其分离度不能达到分析要求;采用甲醇-磷酸二氢钾缓冲液(2∶98)[6-8]虽然分离效果更好,但此种比例的极性太大;还有采用纯水的[9-10],这对色谱柱的损害较大。经摸索最后采用甲醇-水(5∶95)作为流动相,基本能够达到较好的分离效果,尿囊素出峰的时间大约在3.8 min左右。据文献报道[11],尿囊素在碱性条件下不稳定,水解成脲、乙醛酸和尿囊素酸,因此稀对照品溶液及样品溶液最好在用前准备。
[1] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010:27.
[2] 张留记,屠万倩,都恒青.薄层扫描法测定怀山药降糖肠胃舒散中尿囊素的含量[J].中国中药杂志,2001,26(8):567-568.
[3] 王玲,王东.不同产地山药中尿囊素含量的HPLC测定[J].河南中医学院学报,2006,21(5):20-22.
[4] 吴利,梁晓燕,邓贤彬.正交法优选山药硫磺熏蒸工艺[J].中国中医药现代远程教育,2005,3(3):56-57.
[5] 赵海霞,刘伟.硫磺熏蒸对山药中尿囊素的影响[J].医学教育探索,2009,40(6):903-904.
[6] 张芳芳,李伟东,杨光明,等.HPLC法测定麸炒山药饮片中尿囊素的含量[J].南京中医药大学学报,2010,26(2):146-148.
[7] Ghasem Haghi,Rohollah Arshi,ALireza Safaei.Improved High-Performance Liquid Chromatography(HPLC) Method for Qualitative and Quantitative Analysis of Allantoin in Zea mays[J].J Agric Food Chem,2008,56(4):1205-1209.
[8] 刘雪东,杨光明,李伟东,等.山药道地药材和饮片中尿囊素的含量比较[J].中医药信息,2009,26(5):36-37.
[9] 杨连菊,冯学锋,张淑运,等.麸炒山药炮制工艺研究[J].中国中药杂志,2009,34(13):1658-1660.
[10] 杨连菊,冯学锋,杨京玉,等.生山药及麸炒山药的质量标准研究[J].中国中药杂志,2010,35(21):2846-2849.
[11] 周同惠.生物医药学色谱进展[M].第二卷.西安:西北大学出版社,1994:164.
OptimizationofExtractionMethodofAllantoininYam
YI Gang-qiang1,JIANG Meng-liang1*,LU Yao-bang1,LIU Zhao-hui2,ZHONG Zhen-ping2,LUO Yue-long1
(1.HunanUniversityofChineseMedicine,Changsha410208,China;2.YaoshengtangManufactureDrugCorporation,Anxiang415600,China)
Objective:To optimize allantoin extraction method fromDioscoreaoppositaThunb.Methods:Using allantoin content as the indexes,20% ethanol and methanol ultrasonic extraction,20% ethanol and methanol reflux extraction and water formulation samples were determined by HPLC.Results:The allantoin content:Methanol ultrasonic extraction 2 times>20% ethanol ultrasonic 2 times>methanol ultrasonic 1 time>20% ethanol ultrasonic 1 time>methanol reflux 1 time>20% ethanol reflux 1 time>water reflux 1 time.Conclusion:Methanol ultrasonic extraction 2 times has the highest allantoic content.
DioscoreaoppositaThunb.;Allantoin;Extraction methods;HPLC;Content determination
2013-02-05)
△
产学研校企合作项目(YXY2010-002)
*
蒋孟良,教授,硕士生导师,主要从事中药炮制与制剂研究,E-mail:hhjml@163.com

